Промышленная экология. Теор вопросы 7
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
Содержание Введение Экология – наука о закономерностях формирования, развития и устойчивого функционирования биологических систем разного ранга в их взаимоотношениях между собой и с окружающей их внешней средой. В истории развития экологии можно выделить три основных этапа. Первый этап – зарождение и становление экологии как науки (до 60-х годов 19-го века). Второй этап – оформление экологии в самостоятельную науку (с 60-х годов 19-го века до начала 20-го века). Третий этап – превращение экологии в междисциплинарную, комплексную науку (с 50-х годов 20-го века до настоящего времени). Стратегическая задача современной экологии состоит в том, чтобы на основе познания законов природы, используя все достижения научно-технического прогресса, создать научную базу для гармонизации взаимоотношений человеческого общества и природы и разработать практические рекомендации, направленные на оздоровление природной среды и поддержание её надлежащего качества. Теор вопросы 7, 26, 17 7 Представление о системе экологического нормирования. Нормативы качества окружающей среды. ПДК, ПДВ, ПДС, комплексные показатели. 26. Источники и классификация твёрдых отходов. Полигоны твёрдых отходов. Методы переработки твёрдых отходов. Использование твёрдых отходов в качестве вторичных материальных ресурсов (ВМР). 17. Примеры очистки отходящих газов от оксидов углерода, оксидов азота, диок-сида серы и сероводорода: условия и механизмы, уравнения химических ре-акций. Выбор номера решаемой задачи осуществляется по последней цифре, а варианта задачи – по предпоследней цифре учебного шифра студента. Задача 6 ЗАДАЧА 6 Определение содержания SO2 в дымовых газах При сжигании топлива одним из основных продуктов горения является диоксид серы SO2. Присутствие в воздухе больших концентраций диоксида серы приводит к выпадению кислотных дождей – в результате его взаимодействия с водяными парами, поэтому необходимо вести строгий учет количеств SO2, по- ступающих в атмосферу. Расчет содержания диоксида серы SO2 в дымовых газах Х (мг/м3) прово- дится по формуле: Х = . 1000, 0 2V A где V0 (м3/ч) – объем образующихся дымовых газов при н.у.; А (г/ч) – количество серы в сжигаемом топливе: А = . 1000, %100С В где В (кг/ч) – количество сжигаемого топлива; С (мас.%) – концентрация серы в топливе. Исходные данные для расчета по вариантам содержатся в Таблице 11.
7 Представление о системе экологического нормирования. Нормативы качества окружающей среды. ПДК, ПДВ, ПДС, комплексные показатели. Экологические нормативы и стандарты имеют чрезвычайно важное значение в исследованиях риска экономических потерь, вызванных снижением качества окружающей среды, особенно вследствие постоянных антропогенных воздействий. Данные показатели позволяют выразить уровень такого снижения в виде определенных количественных характеристик, имеющих достаточно ясное смысловое содержание, как, например, отклонение текущего состояния окружающей среды от «нормативного» или «фонового» (обычного) состояния. Это, в свою очередь, позволяет сформировать информационную базу, необходимую для решения другой важной задачи риск-анализа — оценки величины ущерба объекта (в натуральной или стоимостной форме) в зависимости от степени снижения качества окружающей среды. Широкомасштабная деятельность по разработке стандартов и нормативов состояния окружающей среды берет свое начало с середины 60-х гг. XX в. В 80-х гг. природоохранные органы уже более чем 100 государств в той или иной степени использовали различные варианты систем экологических нормативов в практической работе. В это же время усилиями международных организаций были подготовлены первые нормативные документы межрегионального уровня, содержащие информацию о рекомендуемых нагрузках на окружающую среду в рамках Всемирной стратегии охраны природы. Экологическое нормирование — это деятельность специально уполномоченных государственных органов по разработке, утверждению экологических нормативов и обеспечению их соблюдения хозяйствующими субъектами. Экологические нормативы — это научно обоснованные и обязательные для выполнения меры предельно допустимого воздействия человека на окружающую природную среду. Под отрицательным воздействием понимается деятельность человека, вносящая физические, химические, биологические изменения в природную среду, которые угрожают состоянию здоровья и жизни человека, состоянию растительного и животного мира. С помощью экологических нормативов осуществляется конкретизация установленных законодательством требований экологической безопасности. Превышение экологических нормативов является экологическим правонарушением и влечет за собой прекращение, приостановление или ограничение экологически вредной деятельности (ст. 25, 45, 50—54 Федерального закона «Об охране окружающей среды»), а также применение мер юридической ответственности. Экологические нормативы устанавливаются на основании трех показателей: а) медицинского, т.е. порогового уровня угрозы здоровью человека, его генетическому фонду; б) технологического, т.е. способности имеющихся технологий обеспечить выполнение установленных нормативов; в) научно- технического, т.е. способности научно-технических средств контролировать предельно допустимое воздействие по всем его параметрам. Систему экологических нормативов в соответствии с действующим законодательством составляют: 1) нормативы качества окружающей природной среды, 2) нормативы предельно допустимого вредного воздействия на окружающую природную среду', 3) нормативы {лимиты) использования природных ресурсов', 4) нормативы санитарных и защит ных зон. В соответствии со ст. 42 Конституции Российской Федерации каждый гражданин имеет право на благоприятную окружающую среду, достоверную информацию о ее состоянии и на возмещение ущерба, причиненного его здоровью или имуществу экологическим правонарушением, а в соответствии со ст. 58 — каждый обязан сохранять природу и окружающую среду, бережно относиться к природным богатствам. Согласно ст. 19 Федерального закона "Об охране окружающей среды" от 10.01.2002 № 7-ФЗ нормирование в области охраны окружающей среды заключается в установлении нормативов качества окружающей среды, нормативов допустимого воздействия на окружающую среду при ведении хозяйственной и иной деятельности, и осуществляется в целях государственного регулирования этого воздействия, гарантирующего сохранение благоприятной окружающей среды и обеспечение экологической безопасности. По своему назначению нормирование в области охраны окружающей среды служит инструментом управления хозяйственной и иной деятельности для обеспечения экологической безопасности на основе современных достижений науки и техники с учетом международных правил и стандартов. Законодательно установлены две группы нормативов: 1) нормативы качества окружающей среды; 2) нормативы допустимого воздействия на окружающую среду при осуществлении хозяйственной и иной деятельности. Нормативы качества окружающей среды — это официально установленные допустимые, т.е. разрешенные, значения химических, физических, биологических показателей, характеризующих объекты окружающей среды. Нормативы качества окружающей среды устанавливаются для оценки состояния окружающей среды в целях сохранения естественных экологических систем, генетического фонда растений, животных и других организмов. К нормативам качества окружающей среды относятся: нормативы, установленные в соответствии с химическими показателями состояния окружающей среды, в том числе нормативы предельно допустимых концентраций химических веществ, включая радиоактивные вещества; нормативы, установленные в соответствии с физическими показателями состояния окружающей среды, в том числе с показателями уровней радиоактивности и тепла; нормативы, установленные в соответствии с биологическими показателями состояния окружающей среды, в том числе видов и групп растений, животных и других организмов, используемых как индикаторы качества окружающей среды, а также нормативы предельно допустимых концентраций микроорганизмов; иные нормативы качества окружающей среды. Предельно допустимая концентрация ПДК– такое содержание вредного вещества в компонентах окружающей среды (воздухе, воде, почве), которое при периодическом (т.е. за определенный промежуток времени) или постоянном (т.е. в течение всей жизни человека) воздействии практически не влияет на здоровье человека и не вызывает неблагоприятных последствий у его потомства. ПДК веществ для воздуха выражаются в мг/м3, для воды – в мг/л, для почвы – в мг/кг. Величины ПДК разрабатываются с использованием научных методов и устанавливаются в законодательном порядке –Государственным Комитетом санитарно-эпидемиологического надзора (Госкомсанэпиднадзор) при правительстве РФ. Первые нормативы ПДК вредных веществ в нашей стране были установлены: для воды - в 1939 г., для воздуха - в 1951 г., для почвы - в 1980 г. Сейчас в РФ утверждены и действуют более 500 нормативов ПДК вредных веществ для воздуха, более 1900 - для водоемов и более 130 - для почв. Производственно-хозяйственные нормативыкачества устанавливают требования к источнику вредного воздействия, ограничивая его деятельность определенной пороговой величиной. Основными санитарно-гигиеническими нормативами являются: предельно допустимый выброс ПДВ и предельно допустимый сброс ПДС. Под выбросом понимается поступление вредных веществ в атмосферу, под сбросом – поступление вредных веществ вместе со сточными водами в природные водные объекты. +Предельно допустимый выброс ПДВ– максимальное количество загрязняющего вещества, выбрасываемого в атмосферу отдельным конкретным источником в единицу времени, превышение которого ведет к превышению ПДК загрязняющего вещества в приземном слое воздуха и, как следствие, к неблагоприятным последствиям в окружающей источник природной среде и угрозе для здоровья людей.Предельно допустимый сброс ПДС– максимальное количество загрязняющего вещества, сбрасываемого в составе сточных вод в природный водный объект, превышение которого ведет к превышению ПДК загрязняющего вещества в данном природном объекте. ПДВ выражается в г/с, ПДС – в мг/л или г/м3. Постановление о введении ПДВ (ПДС) в практику природоохранной деятельности в нашей стране было принято в 1978 году. ПДВ (ПДС) определяется индивидуально для каждого химического вещества и каждого источника выбросов (сбросов), которых может быть несколько на одном предприятии. Величины ПДВ (ПДС) устанавливаютсяГосударственным комитетом по охране окружающей среды (Госкомэкологии России), Минприроды РФ или специально уполномоченными органами в области охраны окружающей среды. Санитарно-гигиенические нормативы – это нормативы предельно допустимых уровней химического, биологического, физического и радиационного воздействий (применительно к здоровью человека). Основными санитарно-гигиеническими нормативами являются: предельно допустимая концентрация вредных веществ (ПДК – для химических и биологических воздействий) и предельно допустимый уровень воздействия (ПДУ – для физических и радиационных воздействий Предельно допустимая концентрация – это такое максимальное содержание вредного вещества в компонентах окружающей среды (воздухе, воде, почве), которое при периодическом (т.е. за определённый промежуток времени) или постоянном (т.е. в течение всей жизни человека) воздействии практически не влияет на здоровье человека и не вызывает неблагоприятных последствий у его потомства. ПДК веществ для воздуха выражаются в мг/м3, для воды – в мг/л, для почвы – в мг/кг. Производственно-хозяйственные нормативы устанавливают требования к источнику вредного воздействия, ограничивая его деятельность определённой пороговой величиной. Основными производственно-хозяйственными нормативами являются: предельно допустимый выброс (ПДВ) и предельно допустимый сброс (ПДС). Предельно допустимый выброс – максимальное количество загрязняющего вещества, выбрасываемого в атмосферу отдельным конкретным источником в единицу времени, превышение которого ведет к превышению ПДК загрязняющего вещества в приземном слое воздуха и, как следствие, к неблагоприятным последствиям в окружающей источник природной среде и угрозе для здоровья людей. Предельно допустимый сброс – максимальное количество загрязняющего вещества, сбрасываемого в составе сточных вод в природный водный объект, превышение которого ведет к превышению ПДК загрязняющего вещества в данном природном объекте. ПДВ выражается в г/с, ПДС – в мг/л или г/м3. ПДВ (ПДС) определяется индивидуально для каждого химического вещества и каждого источника выбросов (сбросов), которых может быть несколько на одном предприятии. 26. Источники и классификация твёрдых отходов. Полигоны твёрдых отходов. Методы переработки твёрдых отходов. Использование твёрдых отходов в качестве вторичных материальных ресурсов (ВМР). Источники и классификация твердых отходов этим термином понимают разнообразные по составу и физико-химическим свойствам остатки, характеризующиеся потенциальной потребительской ценностью (пригодностью для полезного использования) и являющиеся по своей природе вторичными материальными ресурсами (BMP), использование которых в материальном производстве, как правило, требует определенных дополнительных операций с целью придания им необходимых свойств или четкой фиксации этих свойств. Накопление значительных масс твердых отходов во многих отраслях промышленности обусловлено существующим уровнем технологии переработки соответствующего сырья и недостаточностью его комплексного использования. Удаление отходов и их хранение являются дорогими мероприятиями (1,5-8 руб/т) в ценах на 1990 год. На металлургических производствах СССР, ТЭС и углеобогатительных фабриках затраты на них составляли примерно 8-30% стоимости производства основной продукции. Между тем, в отвалы и шламохранилища ежегодно поступают огромные массы вскрышных пород и отходов обогащения и переработки минерального сырья. По имеющимся оценкам, на территории стран СНГ в них накоплены десятки миллиардов тонн различных горных пород (известняков, кварцитов, доломитов, огнеупорных глин, каолинов, песчаников и др.), более 1,2 млрд.т золошлаковых отходов ТЭС, 580 млн.т металлургических шлаков, 350 млн.т галита, 200 млн.т фосфогипса и значительные количества других (часто ценных и дефицитных) материалов. Наряду с этим уровень оперативной утилизации отходов является низким: в хозяйственный оборот вовлекается только пятая часть шлаков цветной металлургии, 10-12% золошлаковых отходов и фосфогипса, менее 4% отходов углеобогащения, что ведет к нарастанию массы складируемых отходов. В то же время значительная часть твердых отходов промышленных предприятий может быть эффективно использована в народном хозяйстве. Так, строительная индустрия и промышленность строительных материалов стран СНГ ежегодно добывают и потребляют около 3,5 млрд.т нерудного сырья, большая часть которого может быть заменена промышленными отходами. Задача утилизации последних тем более актуальна, что организация производства продукции на их основе требует затрат в 2-3 раза меньше, чем для соответствующих производств на основе специально добываемого природного сырья. Кроме того, увеличение комплексности использования минерального сырья при одновременном решении задач защиты биосферы способствует сокращению потребления ряда его видов. В СССР экономия 1% соответствующих видов минерального сырья была равноценна в 70-е - 80-е годы дополнительному вовлечению в производство сырья, необходимого для получения около 1 млн.т стали, примерно 6,5 млн.т угля и 4,9 млн.т нефти, до 6 млрд. м3 природного газа и 15 млрд. кВт*ч электроэнергии. Источники возникновения твердых отходов в материальном производстве иллюстрируются схемой (рис. III-1). Конкретные причины их образования весьма многообразны, причем некоторые из них могут быть без значительных издержек достаточно легко и быстро устранены, для устранения других, напротив, требуются продолжительные исследования и крупные затраты. В настоящее время отсутствует общая научная классификация твердых отходов промышленности, охватывающая все их многообразие по тем или иным принципам, что, очевидно, объясняется широтой их номенклатуры даже в рамках одного предприятия (например, на бывшем Северодонецком ПО «Азот» образуется 178 видов твердых отходов) и еще незавершенной работой по составлению кадастров отходов по предприятиям, подотраслям, отраслям, министерствам и ведомствам. Существующие классификации твердых отходов весьма многообразны и в большинстве своем односторонни. Так, твердые отходы классифицируются по отраслям промышленности (отходы химической, металлургической, топливной и других отраслей) или их группам, по конкретным производствам (например, отходы сернокислотного, содового, фосфорнокислотного и др. производств), по тоннажности, степени использования, ценностным показателям, воздействию на окружающую среду, способности к возгоранию, коррозийному воздействию на оборудование и тому подобное. Полигон захоронения ТБО - это комплекс природоохранных сооружений, предназначенных для складирования, изоляции и обезвреживания твердых бытовых отходов, обеспечивающий защиту от загрязнения атмосферы, почвы, поверхностных и грунтовых вод, препятствующий распространению грызунов, насекомых и болезнетворных микроорганизмов. Полигон для твердых бытовых отходов в общем случае состоит из следующих частей: - подъездная дорога, по которой осуществляются подвоз ТБО и обратное движение порожних мусоровозов; - хозяйственная зона, предназначенная для организации эксплуатации полигона; - участок складирования ТБО, где размещаются и захораниваются отходы; участок складирования соединяется с хозяйственной зоной временной внутриплощадочной дорогой; - линия электроснабжения от внешних электрических сетей. Массив отходов полигона ограничен системами инженерных сооружений: верхним окончательным покрытием и противофильтрационным экраном для управления эмиссией полигона - сокращения неблагоприятного воздействия на окружающую среду. Захоронение на полигонах является самым распространенным в мире методом утилизации отходов. Этот метод применяют к несгораемым отходам и к отходам, которые при горении выделяют токсичные вещества. Полигоны, на котрых утилизируют отходы, не являются обычными свалками. Современные полигоны — это сложные инженерные сооружения, на которых установлены системы борьбы с загрязнениями воздуха и подземных вод. Некоторые полигоны умеют перерабатывать образующийся в процессе гниения мусора газ в тепло и электроэнергию. К сожалению, всё это в большей степени относится к развитым европейским странам, так как в России до сих пор очень малый проценнт полигонов соответствует этим характеристикам. Главный минус захоронения отходов — даже при использовании многочисленных фильтров и систем очистки этот вид утилизации не позволяет полностью избавиться от негативных эффектов разложения отходов — гниения и ферментации — загрязняющих воздух и воду. Поэтому, несмотря относительную дешевизну захоронения ТБО, экологи рекомендуют перерабатывать отходы, тем самым минимизируя риски загрязнения окружающей среды. Сжигание ТБО позволяет в 3 и более раз уменьшать вес отходов. При этом при сжигании устраняется запах и уничтожаются токсичные бактерии. Кроме того, энергию, выделяемую при сжигании твердых бытовых отходов, можно использовать для получения тепла и электричества. Несмотря на свои преимущества, этот вид утилизации мусора имеет существенный недостаток — сильное загрязнение окружающей среды. При сжигании мусора в воздух выбрасываются такие опасные вещества, как бифенилы, диоксины, дибензофураны и тяжелые металлы. Кроме того, до сих пор окончательно не решен вопрос с безопасным захоронением токсичной золы. Сегодня во многих странах Европы владельцы мусорозжигательных заводов тратят значительные средства на установку воздухоочистительных систем и захоронение золы. За счет этого существенно увеличивается стоимость строительства таких заводов, составляя в среднем 150 млн долларов. Компостирование широко применяется для переработки отходов растительного происхождения. Это технология основана на естественном биологическом разложении органического мусора. Результатом такой переработки мусора является компост, который применяют в сельском хозяйстве. Сегодня активно используются технологии получения смешанного компоста за счет переработки донных отложений водоемов и осадков сточных вод. Вторичная переработка — самый безопасный для окружающей среды метод переработки мусора. Кроме того, для многих владельцев заводов по переработке ТБО она является дополнительной прибылью за счет продажи отсортированного мусора (стеклобой, пластик, картон) перерабатывающим компания. К сожалению, лишь некоторая часть отходов поддается вторичной переработке, поэтому полностью решить вопрос о безопасной утилизации ТБО до сих пор невозможно. Несовершенство организационного обеспечения сбора отходов для использования в качестве ВМР заключается: в отсутствии федерального органа, в функции которого входила бы задача координации деятельности по сбору и использованию ВМР в промышленности, что сдерживает разработку и принятие более совершенных мер государственного регулирования в этой области; в отсутствии в системе жилкоммунхоза, осуществляющей сбор и удаление твердых коммунальных отходов, производственной инфраструктуры по селективному сбору отходов для использования в качестве вторичного сырья; в несовершенстве системы ответственности субъектов хозяйственной деятельности и органов административного управления за сбор и переработку ВМР. 17. Примеры очистки отходящих газов от оксидов углерода, оксидов азота, диоксида серы и сероводорода: условия и механизмы, уравнения химических реакций. Оксид углерода или угарный газ действует на кровь, вытесняя кислород из оксигемоглобина крови с образованием карбоксигемоглобина, в результате кровь теряет свойства переносить кислород. Для оксида углерода установлены ПДК: - ПДКР.З. – 20 мг/м3 ; - ПДКМ.Р. – 3 мг/м3 ; - ПДКС.С. – 1 мг/м3 . Оксид углерода – несолеобразующий оксид, химически инертен, поэтому методы хемосорбции для его удаления практически не используется. Достаточно легко окисляется кислородом: 2СО + О2 → 2СО2, поэтому методы дожигания и каталитического окисления получили большое применение. Способен взаимодействовать с водородом (гидрируется): СО + 3Н2 → СН4 + Н2О. Так как получается метан, то процесс называется метанированием. Гидрирование (метанирование) осуществляется на катализаторе при высоких температурах 300- 500°С и под давлением. Способы: Хемосорбционное поглощение оксида углерода. Использовались для очистки конвертированного газа в производстве аммиака. В качестве поглотителя использовался медно-аммиачный раствор. [Cu+1(NH3)2]CH3COO + CO + NH3 ↔ [Cu+2(NH3)3CO]·CH3COO. Регенерация осуществляется термическим способом: [Cu(NH3)3CO] 2+ → [Cu(NH3)2] + + CO + NH3. Особенность данного метода – необходимость низких температур при поглощениях СО (5–15°С). Это создавало большие проблемы в летнее время. В крупнотоннажных агрегатах синтеза аммиака используется процесс метанирования для поглощения оксида углерода. Способы дожигания оксида углерода Суть метода заключается в окислении СО до СО2 кислородом воздуха: 2СО + О2 → 2СО2 + Q. 90 Процесс осуществляется в двух вариантах: термическим некаталитическим дожиганием при температуре 900-1000°С, и каталитическим дожиганием при температуре 350–400 °С. Схема установок приведена на рисунках 5.1 и 5.2. 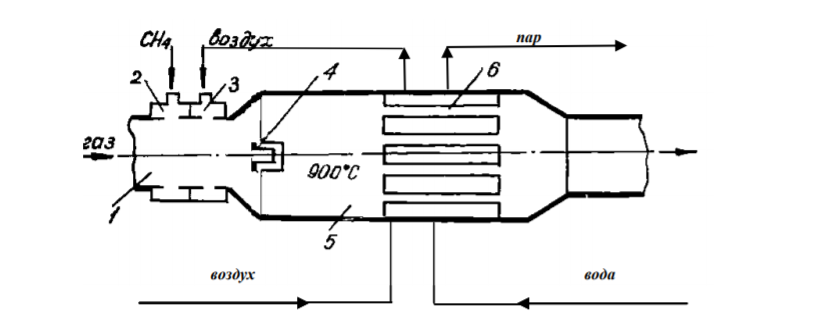 1 – газоход; 2,3 – патрубок; 4 – запальная свеча; 5 - камера дожигания; 6 – теплообменный утилизатор. 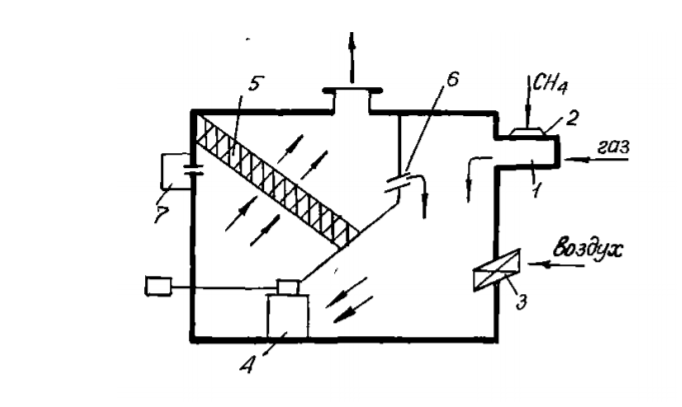 Рисунок 5.1 - Некаталитическое дожигание СО 1 – газоход; 2 – патрубок; 3 – заслонка; 4 – вентилятор; 5 – заслонка. Действие установки некаталитического дожигания СО заключается в следующем: в газоход подают газы на очистку, сюда же поступают топливо и воздух. С помощью запального устройства газовая смесь поджигается и горит в камере дожигания. Температура газа на выходе из камеры 1100-1200°С, поэтому рационально устанавливать за камерой теплообменники, в которых температура 91 дымовых газов уменьшается до 200-300°С. Данный метод используется для очистки ваграночных и агломерационных газов. Метод гидрирования оксида углерода (процесс метанирования) Используется в крупнотоннажных агрегатах синтеза аммиака для тщательной очистки азото-водородной смеси. от СО и СО2: СО + 3Н2 → СН4 + Н2О, СО2 + 4Н2 → СН4+ 2Н2О. Схема приведена на рисунке 5.3. 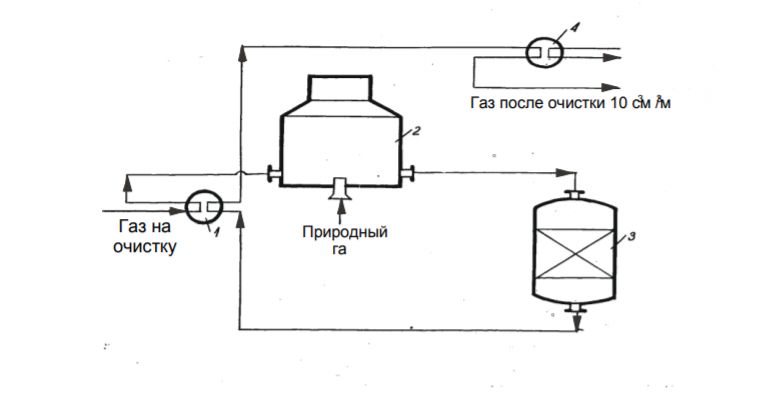 1-теплообменник; 2-печь; 3 –метанатор; 4-холодильник. Рисунок 5.3 - Схема установки метанирования Краткая характеристика оксидов азота N2O - не солеобразующий оксид, “веселящий газ”, наркотик - используется для наркоза при операциях. NO – не солеобразующий оксид, бесцветный газ, который при попадании в организм действует на центральную нервную систему, а в больших количествах разрушает кровь, переводя оксигемоглобин крови в метгемоглобин. Физико-химические основы методов очистки газовых выбросов 69 от оксидов азота. Существует два подхода к решению проблемы снижения выбросов оксидов азота: - очистка газовых выбросов; - подавление процесса образования оксидов азота в агрегатах. Способы очистки отходящих газов от оксидов азота разделяют на окислительные, восстановительные и сорбционные. Физико-химические основы методов каталитического восстановления состоят в том, что при определённых условиях происходит разложение оксидов азота в соответствии с реакциями: 2NO ↔ N2 + O2 , 2NO2 ↔ N2 + 2O2. При этом равновесие можно сдвинуть вправо, если связывать образовавшийся кислород восстановителем (водород, метан, оксид углерода, аммиак). В зависимости от применяемого газа-восстановителя процесс очистки выражается следующими суммарными реакциями: (NO + NO2) + 3H2 → 150-200°C → N2 + 3H2O, 4(NO + NO2) + 3CH4 → 350-500°C → 4N2 + 3CO2 + 6H2O, (NO + NO2) + 3CO → 250-500°C → N2 + 3CO2, (NO + NO2) + 2NH3 → 250-300°C → 2N2 + 3H2O. Поступающая в реактор на очистку газовая смесь должна иметь температуру зажигания катализатора. Количество свободного кислорода в очищаемом газе является одним из факторов, определяющих выбор газа-восстановителя. Каталитическое восстановление оксидов азота с использованием метана (высокотемпературный метод) Схема приведена на рисунке 4.1. Производится разбавленная азотная кислота, содержащая 50-60% мас. НNО3. Исходное сырье – аммиак. Физико-химические основы производства разбавленной серной кислоты заключается в следующем: - окисление аммиака в контактном аппарате на платиновом катализаторе (сетка) при температуре 700-800оС и под давлением 0,73 МПа до оксида азота: 4NН3 + 5О2 ↔ 4NО + 6Н2О; - окисление NО до NО2 кислородом воздуха под давлением и при охлаждении нитрозных газов: 2NО + О2 ↔ 2NО2; 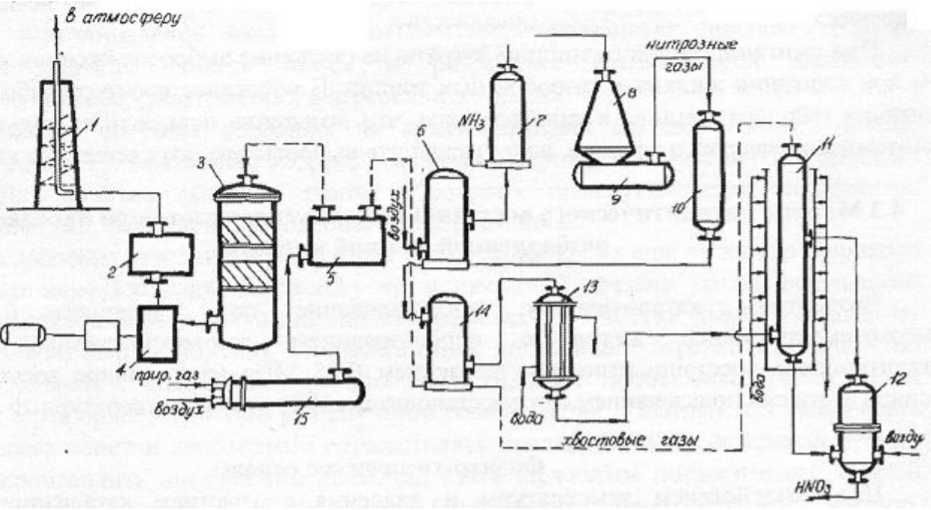 1 – выхлопная труба; 2,9 – котёл-утилизатор; 3 – реактор очистки; 4 – газотурбина; 5,7 - смеситель; 6 – подогреватель воздуха; 8 – контактный аппарат; 10 – окислитель; 11 – абсорбционная колонна; 12 – отпарная колонна; 13 – холодильник; 14 – подогреватель. Рисунок 4.1 – Схема производства слабой азотной кислоты под давлением 7,3 ∙ 105 Па с очисткой хвостовых газов в контактном аппарате - абсорбция NО2 водой при температуре до 30оС под давлением в абсорбционной колонне: 3NО2 + Н2О ↔ 2НNО3 + NО. Отходящие хвостовые газы из абсорбера содержат 0,10-0,25% об. оксидов азота. Они выходят с температурой 30-50°С и поступают в подогреватель, где их температура повышается до 150°С, после чего газы направляются в смеситель, в котором они смешиваются с топочными газами, получаемыми в печи путём сжигания природного газа, подогреваясь до температуры 390-500°C. Селективное низкотемпературное восстановление оксидов азота В качестве газа-восстановителя используется аммиак, который селективно, т.е. избирательно по отношению к оксидам азота; в присутствии кислорода при температуре 240– 280°С восстанавливает оксиды азота до азота: 6NO + 4NH3 → 5N2 + 6H2O. В качестве катализатора используют алюмованадиевокобальтовый катализатор (АВК-10). Схема приведена на рисунке 4.2. 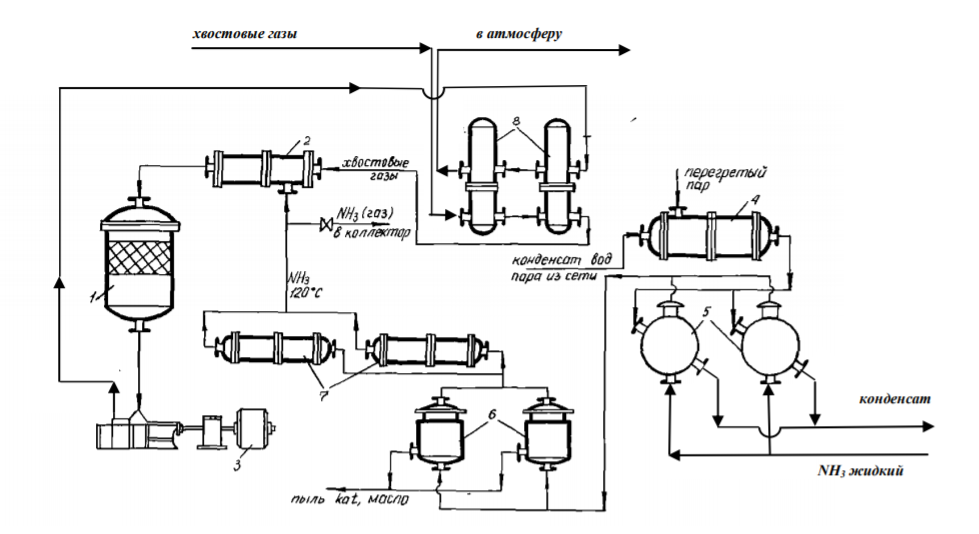 1 – реактор; 2 – смеситель; 3 – турбокомпрессор; 4 – подогревательконденсатор; 5 – испаритель жидкости NH3; 6 – фильтр; 7 – подогреватель газообразного NH3; 8 – подогреватель хвостовых газов. Рисунок 4.2 - Схема каталитической очистки хвостовых газов в производстве разбавленной HNO3 под давлением 3,5 · 105 Па ОЧИСТКА ГАЗОВЫХ ВЫБРОСОВ ОТ ДИОКСИДА СЕРЫ Всего в мире в атмосферу выбрасывается 100-150 млн. тонн диоксида серы антропогенного происхождения. Наибольшее количество выбросов SO2 приходится на черную и цветную металлургию, тепловую энергетику, угольную промышленность (горение терриконов). Характеристика поглотителя. В известковом методе используется суспензия извести СаО с концентрацией 100-150 г/л (растворимость СаО при 0оС 0,13 г на 100 г воды; при 80оС – 0,66 г/100 г воды) или известковое молоко с концентрацией 150-200 г/л раствора (растворимость Са(ОН)2 при 0оС 0,176 г на 100 г воды; при 20оС – 0,16 г/ 100 г воды; при 80оС – 0,092 г/ 100 г воды). Следует учитывать химическое взаимодействие: СаО + Н2О = Са(ОН)2 + 986,6 кДж/моль, (ΔН 0 Са(ОН)2 = -986,6 кДж/моль) Учитывая малую растворимость СаО или Са(ОН)2 в суспензии (растворе) содержатся преимущественно в твердой фазе ( Т ÷ Ж ≈1÷15 ) Физико-химические основы методов. При поглощении SO2 суспензией извести (известковым молоком) протекают химические реакции: SO2 + Н2О ↔ H2SO3, Ca(OH)2 + H2SO3 → CaSO3 · 2H2O ↓ Температура дымовых газов до 160оС. При избытке диоксида серы: CaSO3 + SO2 + Н2О ↔ Са(НSO3)2 При наличии кислорода в очищаемом газе: CaSO3 · 2H2O + 0,5О2 → CaSO4 · 2Н2О ↓ гипс Растворимость гипса при 20оС составляет 0,206 г/100 г воды. Если кристаллы гипса выделить фильтрованием насыщенной суспензии, а затем подвергнуть термической обработке при температуре 125-150оС, образуется гипсовое вяжущее: t, Р CaSO4 · 2Н2О → CaSO4 · 0,5Н2О ↓ + 1,5Н2О ↑ Аммиачные методы очистки газовых выбросов от диоксида серы Область применения: химическая промышленность, тепловая энергетика, черная металлургия. Характеристика поглотителя: исходный поглотитель – 5-28% водный раствор аммиака, в циклах абсорбция SО2 – термическая регенерация NН4НSO3 используется сульфит-бисульфитный раствор аммония с концентрацией сульфита аммония при абсорбции SО2 20-25% мас. рН поглотительного раствора 5,0-5,4. Физико-химические основы методов. При приготовлении водного раствора аммиака образуется аммиачная вода: NН3 + Н2О ↔ NН4ОН. При абсорбции (хемосорбции) диоксида серы раствором аммиака протекают химические реакции с образованием сульфит – бисульфитного раствора аммония: 2 NН4ОН + SО2 ↔ (NН4)2SО3 + Н2О, (NН4)2SО3 + SО2 + Н2О ↔ 2NН4НSО3. рН раствора снижается с 5,4 до 4,1. Для уменьшения потерь аммиака за счет разложения NН4ОН и (NН4)2SО3 абсорбцию SО2 следует проводить при температуре не более 35оС. Побочные реакции при абсорбции: − при наличии кислорода в дымовых газах: (NН4)2SО3 + 0,5О2 → (NН4)2SО4; − при наличии серы в сульфит-бисульфатном растворе: (NН4)2SО3 + S → (NН4)2S2О3; То есть, образуются сульфат и тиосульфат аммония В аммиачно-азотнокислотном методе: NН4НSО3 + НNО3 → NН4NО3 + SО3↑ + Н2О. Получают высококачественное азотное удобрение в виде кристаллического нитрата аммония. Аммиачно-сернокислотный метод: 2 NН4НSО3 + Н2 SО4 → 2 (NН4)2SО4 + SО2↑ + 2Н2О. Наименее привлекателен, так как сульфат аммония имеет самое низкое содержание азота и содержит балласт в виде сульфат-иона SО4 2- (то есть при использовании такого удобрения происходит подкисление почвы). Во всех кислотных методах следует отделять высококонцентрированный диоксид серы (содержание SО2 в парогазовой смеси 15-30% об.), который может быть переработан в товарный продукт (сжатый газ SО2, серная кислота). Описание технологической схемы комбинированного аммиачного метода очистки газовых выбросов от SО2 Технологическая схема метода приведена на рисунке 1.2. 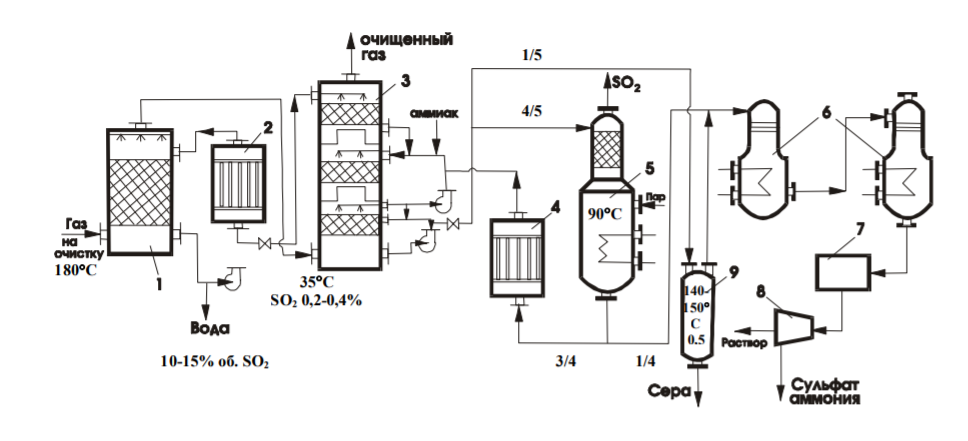 1 – скруббер; 2, 4 – холодильники; 3 – поглотительная башня; 5 – отгонная колонна; 6 – выпарные аппараты; 7 – кристаллизатор; 8 – центрифуга. Рисунок 1.2 – Схема аммиачно-комбинированного метода очистки газов от SО2 На очистку подаются газы, содержащие 0,2-0,4% объёма SO2. Если это дымовые газы теплоэлектростанций, то они имеют температуру 180-220°С и содержат пыль, поэтому газы предварительно обеспыливают в электрофильтрах или циклонах и подают на охлаждение в холодный скруббер – это насадочный аппарат, 180°С 35°С SO2 0,2-0,4% об. 10-15% об. SO2 1/5 4/5 3/4 1/4 140- 150° С 0,5 Мпа 90°С 16 охлаждаемый водой. При контакте горячих газов с водой их температура понижается до 30-35°С. Вода нагревается, при этом в ней растворяется 10-15% диоксида серы от общего количества и вода подкисляется за счёт образования сернистой кислоты. Горячую воду необходимо охладить и опять использовать в холодном скруббере. Для охлаждения воды используют градирни, оросительные или воздушные холодильники. Часть подкисленной воды подаётся на орошение поглотительной башни – абсорбера диоксида серы. Охлаждённый дымовой газ подаётся из холодного скруббера в многоярусную поглотительную башню, где осуществляется очистка от с 0,2-0,4% об. SO2 до 0,02- 0,04% об. (степень очистки ≈ 90%). Поглощение диоксида в абсорбере ведётся в три ступени: 1-ая и 2-ая ступень (по ходу газа) орошается по замкнутой циркуляционной схеме каждая. Поглотительный раствор многократно орошает насадку, циркулируя с помощью насоса. Часть раствора перетекает с верней ступени в нижнюю, при этом регенерированный раствор подаётся на орошение 2-ой ступени. 3-я ступень очистки орошается подкисленной водой из цикла холодного скруббера и, пройдя насадку, смешивается с раствором 2-го цикла. Между ступенями расположены тарелки с колпачками, через которые газ перетекает из нижней части в верхнюю часть аппарата. В нижней части абсорбера расположен сборник – куб. В кубовой части собирается насыщенный раствор, содержащий наибольшее количество бисульфита NH4HSO3. Описание технологической схемы аммиачно-фосфорнокислотного метода очистки газовых выбросов от SО2 В этом методе разложение сульфит-бисульфитного раствора аммония проводится с использованием ортофосфорной кислоты. При этом протекают следующие реакции: 3(NН4)2SО3 + 2Н3РО4 → 2(NН4)3РО4 + 3SО2↑ + 3Н2О↑, ПГС 3NН4НSО3 + Н3РО4 → (NН4)3РО4 + 3SО2↑ + 3Н2О↑. ПГС В результате этого метода образуется парогазовая смесь (водяные пары и SО2), содержащая до 30% SО2, который может быть далее переработан в серную кислоту; а также фосфорные удобрения (ортофосфат аммония), ценность которого заключается в наличии в нем азота и фосфора. Технологическая схема метода приведена на рисунке 1.3. 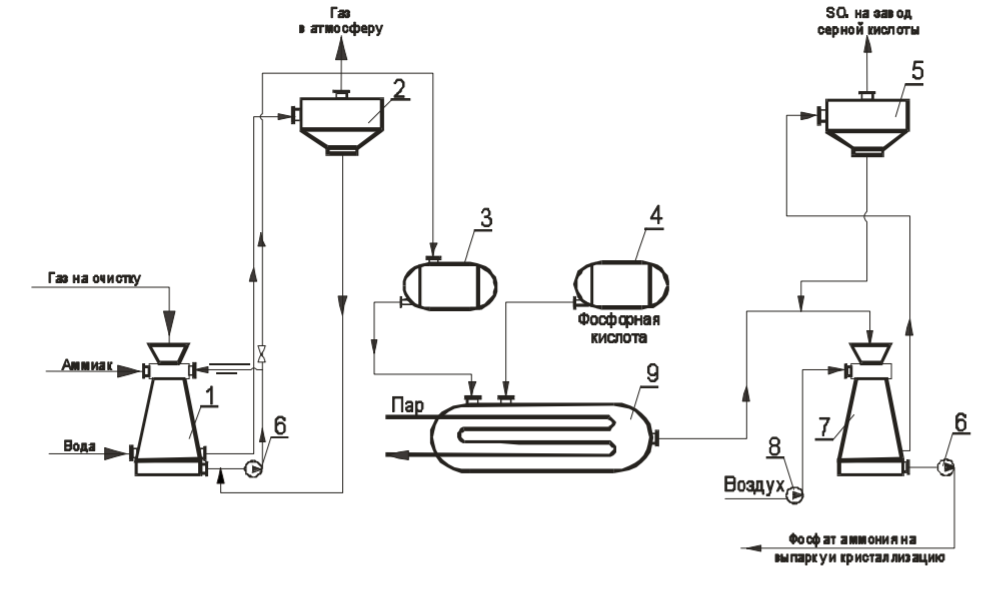 1 – абсорбер Вентури; 2, 5 – каплеуловители; 3 – сборник; 4 – емкость; 6 – насос; 7 – десорбер Вентури; 8 – воздуходувка; 9 – реактор разложения. Рисунок 1.3 – Схема аммиачно-фосфорнокислотного метода очистки газов от SО2 ОЧИСТКА ГАЗОВЫХ ВЫБРОСОВ ОТ СЕРОВОДОРОДА И СЕРООРГАНИЧЕСКИХ СОЕДИНЕНИЙ 2.1 Краткая характеристика веществ Сероводород (H2S) – вещество с неприятным запахом, сильный токсичный яд. При его концентрации 1 мг/л развивается мгновенное отравление – судороги, потеря сознания, остановка дыхания, смерть. ПДК – 10 мг/м3 . Для населения ПДКМ.Р. – 0,008 мг/м3 , ПДКС.С. – 0,008 мг/м3 . Сероводород является химически активным соединением серы. Взаимодействуя с водой, образует сероводородную кислоту. Соли сульфиды (FеS, СuS), которые образуются при взаимодействии сероводорода с металлами. Поэтому сероводород вызывает значительную коррозию металлов. Кроме этого, сероводород угнетающе действует на растения. Для многих катализаторов H2S опасен как катализаторный яд, поэтому газовые смеси очищают от сероводорода. Железо-содовый метод очистки газовых выбросов от сероводорода Область применения: очистка воздуха аспирационных систем и газовых выбросов промышленных предприятий от сероводорода. В качестве поглотителя используется железо-содовый раствор в виде суспензии, содержащей гидроксид трёхвалентного железа. Для приготовления раствора берут 18-ти процентный раствор сульфата железа FeSO4 и 10-ти процентный раствор соды Na2СO3. После их смешивания и продувки воздухом получается суспензия гидроксида железа: FeSO4 + Na2CO3 + H2O → Fe(OH)2 + Na2SO4 + CO2, 2Fe(OH)2 + 0,5O2 + H2O → 2Fe(OH)3. Физико-химические основы метода. При поглощении сероводорода вначале образуются кислые соли, бисульфид и бикарбонат за счёт реакции: H2S + Na2CO3 → NaHS + NaHCO3. Бисульфид натрия затем взаимодействует с гидроксидом трёхвалентного железа с образованием сульфидов железа: 3NaHS + 2Fe(OH)3 → Fe2S3 + 3NaOH + 3H2O, 3NaHS + 2Fe(OH)3 → 2FeS + S + 3NaOH + 3H2O. Таким образом, в поглотительном растворе накапливаются сульфиды железа и сера. Для регенерации поглотительного раствора необходимо его продувать воздухом, в результате чего происходит окисление сульфидов с выделением серы: Fe2S3 + 3H2O + 0,5O2 → 2Fe(OH)3 + 3S, 2FeS + 3H2O + 0,5O2 → 2Fe(OH)3 + 2S. Если в очищаемом газе есть кислород, то эти реакции протекают уже на стадии поглощения сероводорода по механизму авторегенерации. В итоге в поглотительном растворе накапливается сера. Продувку кислородом осуществляют в специальных аппаратах с целью окончательной регенерации и флотации серы. Щелочно-гидрохиноновый метод очистки газовых выбросов от сероводорода. Область применения: очистка аспирационных выбросов в производстве вискозы, целлофана. В качестве исходного поглотителя используется содово-гидрохиноновый раствор. Поглотительный раствор содержит 10 г/л соды Na2CO3, 1 г/л гидрохинона. Физико-химические основы метода. Гидрохинон растворяется в воде, является сильным восстановителем, окисляется на воздухе. При окислении образуется хингидрон С12Н10О4 и затем хинон С6Н4О2 или . Хинон легко восстанавливается в гидрохинон. Сода взаимодействует с сероводородом, в результате чего образуются кислые соли – бисульфид и бикарбонат натрия. Очистка газовых выбросов от сероводорода активированным углем Краткая характеристика активированных углей. Активированный уголь (АУ) является адсорбентом с губчатой пористой структурой. Внутри АУ присутствуют каналы-поры. Сырьём для получения АУ являются торф, уголь, древесина, отходы кожевенной промышленности, скорлупа орехов, косточки плодов, кости животных. Технология получения активированного угля заключается в термической обработке сырья без доступа воздуха. При этом образуется уголь-сырец с крупнопористой структурой. Для увеличения количества мелких пор, а, соответственно, увеличения доли пор в АУ, уголь-сырец активируют путём окисления газами, а также обработки химическими реагентами. В результате достигается микропористая структура. По назначению АУ классифицируются на: - газовые (СКТ, АГ-2, АГ-3, КАУ, ТАУ, БАУ); - рекуперационные (АРТ, АР-3); - осветляющие (ОС, ОУК, АГС-4). По размеру и форме частиц активированные угли бывают гранулированные и порошкообразные. Гранулированные АУ делят на пять фракций в интервале 0,15– 4,7 мм, порошкообразные АУ имеют частицы размером меньше 0,15 мм. АУ гидрофобны и горючи. Они не разрушаются водой и могут быть использованы для очистки увлажненных газов. Горение АУ начинается при температуре 250°С и выше. Особенно опасным является в этом отношении использование АУ в стационарном слое. Физико-химические основы метода. Поглощение соединений серы активированным углем основано физической адсорбцией соединений и последующим их взаимодействием в порах АУ. Сероводород в порах угля взаимодействует с кислородом. АУ насыщается серой: H2S + 0,5O2 → H2O + S + 220 кДж. Регенерация АУ осуществляется путем отмывки серы из пор угля раствором сульфида аммония и термическим разложением полисульфида: (NH4)2S + (n-1) S → (NH4)2Sn – полисульфид, (NH4)2Sn → 125-130°С → (NH4)2S + (n-1)S. В порах АУ протекает также побочная реакция образования серной кислоты: H2S + 2O2 → H2SO4 + 790 кДж. При этом выделяется большое количество тепла и АУ разогревается. Поэтому серную кислоту целесообразно нейтрализовать: NH3 + H2SO4 → (NH4)2SO4. Описание технологической схемы. Схема приведена на рисунке 2.3. 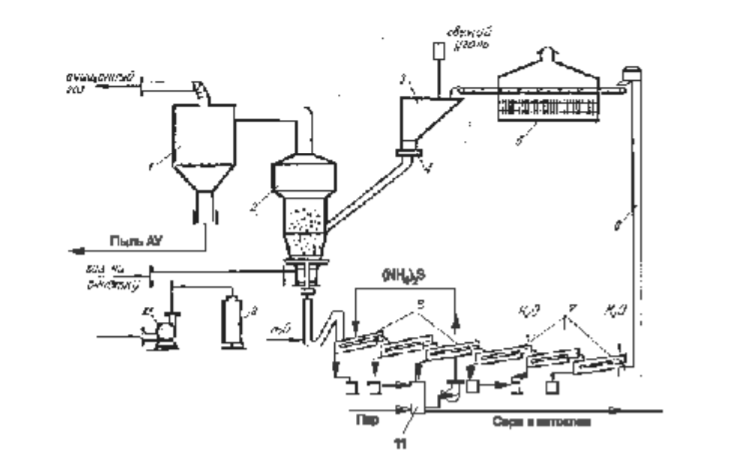 1 – пылеулавливатель; 2 – очистной аппарат; 3 – бункер; 4 – питатель; 5 – сушильная установка; 6 – элеватор; 7 – отделение промывки; 8 – отделение экстракции серы; 9 – баллон NН3; 10 – воздуходувка; 11 – регенератор полисульфида. Рисунок 2.3 – Схема очистки газа от Н2S в кипящем слое АУ Очищаемый газ направляется в дутьевую коробку адсорбера. К нему добавляется небольшое количество аммиака из баллона. Далее газ проходит отверстия в перфорированной решётке в дутьевой коробке, при этом создаётся большая скорость движения струи газа, АУ поступает в адсорбер сверху, падает в эти струи и начинает «витать», таким образом, создается зона «кипения» и обеспечивается необходимое время контакта между адсорбентом и очищаемым газом, что, в свою очередь, способствует эффективности очистки. В центре перфорированной решётки имеются отверстия, куда попадают некоторые частицы, насыщенные серой и осуществляется выгрузка АУ из аппарата. Далее насыщенный серой АУ поступает на систему ленточных транспортёров, где орошается раствором сульфида аммония (отделение экстракции серы). При взаимодействии с серой образуется раствор полисульфида аммония, который собирают в сборник и нагревают острым паром. После отстаивания раствор сульфида аммония отделяется путём декантации (медленное сливание), а более тяжёлая часть, насыщенная 43 коллоидной серой, загружается в автоклав. После плавления получают товарную серу. После промывки водой в отделении промывки, регенерированный влажный АУ элеватором подаётся в сушильную установку, а после сушки загружается в бункер, из которого подаётся в адсорбер кипящего слоя. ЗАДАЧА 6 Определение содержания SO2 в дымовых газах При сжигании топлива одним из основных продуктов горения является диоксид серы SO2. Присутствие в воздухе больших концентраций диоксида серы приводит к выпадению кислотных дождей – в результате его взаимодействия с водяными парами, поэтому необходимо вести строгий учет количеств SO2, по- ступающих в атмосферу. Расчет содержания диоксида серы SO2 в дымовых газах Х (мг/м3) прово- дится по формуле: Х = . 1000, 0 2V A где V0 (м3/ч) – объем образующихся дымовых газов при н.у.; А (г/ч) – количество серы в сжигаемом топливе: А = . 1000, %100С В где В (кг/ч) – количество сжигаемого топлива; С (мас.%) – концентрация серы в топливе. Исходные данные для расчета по вариантам содержатся в Таблице 11.
Список литературы 1. Арустамов Э.А. Природопользование. – М.: Издательский Дом «Дашков и К0», 2000. 2. Аширов А. Ионообменная очистка сточных вод, растворов и газов. – Л.: Химия, 1983. 3. Боголюбов С.А. Экологическое право. – М.: Издательская группа НОРМА-ИНФРА-М, 1997. 4. Ветошкин А.Г. Теоретические основы защиты окружающей среды. – Пенза: Изд. ПГАСА, 2002. 5. Ветошкин А.Г. Процессы инженерной защиты окружающей среды (теорети-ческие основы). – Пенза: Изд. ПГУ, 2004. 6. Воронков Н.А. Экология общая, социальная, прикладная. – М.: Высшая школа, 1999. |
