КОНТРОЛЬНАЯ РАБОТА. Теоретические вопросы (13) Как определяют объём продуктов сгорания
 Скачать 298 Kb. Скачать 298 Kb.
|
|
Решение: Cтв + O2газ = CO2газ ΔН=ΔU+ΔvRT; Qp = Qv + ΔνRT. Δν = 1 моль + 1 моль = 2 моль; ΔνRT = 2 моль · 8,314 Дж · моль–1 · К–1 · 298 К = 4848 Дж; Qр,298 = –393,51 кДж + 4,85 кДж = –388,66 кДж. ЗАДАЧА 2 Написать реакцию горения компонентов газового топлива. Бензола в кислороде. Решение: 1. Записываем реакцию горения С6Н6 + О2 → СО2 + Н2О. 2. В молекуле бензола 6 атомов углерода, из них образуется 6 моле- кулы углекислого газа С6Н6 + О2 → 6СО2 + Н2О. 3. Атомов водорода в молекуле бензола 6, из них образуется 3 мо- лекулы воды С6Н6 + О2 → 6СО2 + 3Н2О. 4. Подсчитаем число атомов кислорода в правой части уравнения 6*2+1=13 5. В левой части уравнения также должно быть 13 атомов кислорода. Молекула кислорода состоит из двух атомов, следовательно, перед кислородом нужно поставить коэффициент 7,5, тогда С6Н6 + 7,5О2 = 6СО2 + 3Н2О, или 2С6Н6 + 15О2 = 12СО2 + 6Н2О. Реакция горения бензола выражается термохимическим уравнением: С6Н6 + 7,5(О2 + 3,76N2) = 6СО2 + 3Н2О + 7,5×3,76N2 ЗАДАЧА 3 а) Определить нижний и верхний пределы воспламеняемости газа при наличии инертных примесей и без них (формулы (11), (12)). б) Определить максимальную скорость распространенеия пламени в трубке диаметром 25 мм.
Решение: Газ имеет следующий состав: СН4 - 98,7%; С2Н6 - 0,3%; С3Н8 - 0,1%; С4Н10 - 0,1%; СО2 -0,1%; N2 - 0,7%. Горючая часть газа составляет 100 - (0,1 + 0,7) = 99,2%. Состав горючей части без балластных примесей: СН4 = 98,7/99,2*100 = 99,49%; С2Н6 = 0,3/99,2*100 = 0,3%; С3Н8 = 0,1/99,2*100 = 0,1%; С4Н10 = 0,1/99,2*100 = 0,1%. Определяем пределы воспламеняемости (верхний, нижний) газовой смеси без балластных примесей по формуле: Lг =100/( 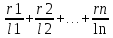 ); );где Lгн (в)-пределы воспламеняемости (верхний, нижний) газовой смеси; r1, r2 ...rn- содержание компонента в газовой смеси, %; l1,l2 ...ln- пределы воспламеняемости (верхний, нижний) отдельных компонентов. Lгн = 100/(99,49/5,3+0,3/3,22+0,1/2,37+0,1/1,86) = 5,28 об %; Lгв =100/(99,49/14+0,3/12,45+0,1/9,5+0,1/8,41) =13,98 об %; Пределы воспламеняемости (верхний, нижний) газовой смеси содержащей балластные примеси определяем по формуле: Lб = Lг 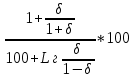 ; ;где Lбн (в)-пределы воспламеняемости (верхний, нижний) газовой смеси с примесями; Lгн (в)-пределы воспламеняемости (верхний, нижний) газовой смеси без примесей; δ- содержание балластных примесей в долях единицы; Lбн= 5,28 (1+0,8/(1+0,8)) / (100 + 5,28 (0,8/(1-0,8))) * 100 = 6,336 об %; Lбв= 13,98 (1+0,8/(1+0,8)) / (100+13,98 (0,8/(1-0,8))) * 100 = 12,582 об %; Горение сложных газов можно рассматривать как одновременное и независимое горение нескольких простых смесей индивидуальных газов с воздухом. Также, содержание горючих газов и воздуха таково, что в смеси, если бы она горела отдельно, пламя распространялось бы с такой же скоростью, какой она распространяется в сложной смеси. Исходя из вышесказанного определим величину скорости распространения пламени для смеси сложного газа с воздухом по формуле: W = L 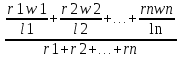 ; ;где W - максимальная скорость распространения пламени смеси, м/сек; L - содержание сложного газа в смеси; r1, r2, rn - содержание простых газов, %; w1, w2, wn - максимальная скорость распространения пламени простых газов; l1,l2 ,ln - содержание простых газов в смеси с воздухом, дающая максимальную скорость распространения пламени, %. Lв =100/(99,49/9,8+0,3/6,5+0,1/4,6+0,1/3,6) =9,76; W = (98,7*0,67/9,8 + 0,3*0,85/6,5 + 0,1*0,82/4,6 + 0,1*0,82/3,6) / (98,7+0,3+0,1+0,1) * 9,76 = 1,69; Wд = W (1-0,01N2 - 0.012 CO2) = 1,69(1-0.01*0.7 - 0.012* 0.1) = 0,698 м/сек. ЗАДАЧА 4 Сохранив неизменной тепловую мощность инжекционной горелки определить диаметр нового сопла и давление газа перед горелкой при переходе на топливо иного состава (инжекционная горелка низкого давления рассчитана для сжигания природного газа с Qн=38,74 МДж/м3 и плотностью ρг = 0,807 кг/м3 при номинальном давлении Р=1275 Па. Диаметр сопла, установленного в горелке d - 4.2 мм. Рассчитать диаметр сопла горелки при работе на сжиженном газе с Q'н= 87,99 МДж/м3 и плотностью ρг' = 1.55 кг/м3 при номинальном давлении Р1=2940 Па). Решение: По формуле: d1 = d 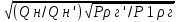 ; ;где d - диаметр газового сопла при работе на газе первоначальной теплоты сгорания, мм; Qн , Qн' - расчетная и действительная теплота сгорания газа, МДж/м3; ρг , ρг' - расчетная и действительная плотность газа, кг/м3; P- расчетное давление газа, Па; P1 - давление газа при работе на газе иного состава, Па. d1 = 4,2 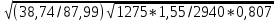 = 2,66 мм. = 2,66 мм.Для сохранения тепловой мощности горелки, без изменения диаметра сопла, при работе на сжиженном газе необходимо поддерживать давление: P1= 1275*(1,55/0,87)*(38,74/87,99)2 = 440 Па. ЗАДАЧА 5 По объемному составу сухого газа взятому из табл. вычислить: -Низшую теплоту сгорания газа, как сумму произведений величин теплоты сгорания горючих компонентов на их объемные доли, деленную на 100. Значения теплоты сгорания горючих компонентов принять по [1]. - Плотность сухого газа, как сумму произведений плотности горючих компонентов на их объемные доли, деленную на 100. Плотности горючих компонентов принять по [1]. -Показатели горения газов (руководствуясь примером). -Калориметрическую температуру сгорания природного газа. Влагосодержание воздуха принять dв= 12 г/м3 сухого воздуха.
Решение: Расчет показателей горения газа
1) Расчет продуктов горения газа при теоретическом количестве воздуха (α=1): При расчетах учитываем, что N2/О2=79/21=3,76 Балластные газы СО2 и N2 переходят в продукты сгорания без изменений. Теоретическое количество воздуха V= 938,71м3 или 9,39 м3/ м3 Кол-во избыточного воздуха: 939*(1,15-1) = 140,85 Объем влаги внесенной с воздухом: (12*938,7)/(1000*0,804)=14,01 м3 Расход воздуха при α=1,15 Vв=10,8 м3/ м3. Объем водяных паров: Vвп = 2,1 м3/ м3. Количество сухих продуктов сгорания: Vс г= Vг - Vвп = 11,8-2,1= 9,7 м3/ м3. Состав влажных продуктов сгорания, %: СО2 = 99,2/1178,5*100 = 8,42 Н2О = 212,4/1178,5*100 = 18,03 О2 = 19,8/1178,5*100 = 1,68 N2 = 100 - (СО2+ Н2О+ О2) = 71.87 2) Теплота сгорания газа: Qcн = 0,01(98*35840 +0,2*63730 + 0,1*93370) = 35697 кДж/м3; Плотность газа: ρс = 0,01 (98*0,717 + 0,2*1,357 + 0,1*2,019 + 0,5*1,977 + 1,2*1,251) = 0,733 кг/м3; Относительная плотность газа: Sc = 0.733/1.15 = 0.638 IT = tTΣVTCT= tT (VCH4CCH4 + VC2H6CC2H6 + VC3H8CC3H8 + VCO2CCO2 + VN2CN2) =25(0.98*1.573 + 0.002*2.4381 + 0.001*3.1637 + 0.005*1.625 + 0.012*1.2992) = 39.33 кДж/м3; IВ = αV0CBtв = 1.15*10.8*1.2976*25 = 403 кДж/м3; Qcн + IT + IВ = 35697 + 40 + 403 = 36140 кДж/м3; 3) Калориметрическая температура сгорания - температура, до которой нагрелись бы продукты полного сгорания, если бы все тепло топлива и воздуха пошло на их нагревание. Уравнение теплового баланса: Qcн + IT + IB = IK , Где Qcн - низшая теплота сгорания газообразного топлива, кДж/м3; IT ,IB - физическое тепло топлива и воздуха, отнесенное к 1 м3 газообразного топлива, кДж/м3; IK - теплосодержание дымовых газов при калориметрической температуре сгорания tK , ̊ С, отнесенное к 1 м3 газообразного топлива, кДж/м3; tK = (Qcн + tТ Σ VTCT + α V0CBtB)/( VN2CN2 + VO2CO2 + VСO2 СCO2 + VH2OCH2O); tK = (35967 + 39,33 + 403)/ (0.98*1.573 + 0.002*2.4381 + 0.001*3.1637 + 0.005*1.625 + 0.012*1.2992) = 1855; где tK - калориметрическая температура сгорания,̊ С; tТ , tB- температура газообразного топлива и воздуха,̊ С; VN2 ,VO2 ,VСO2 , VH2O- объемы продуктов сгорания N2 , О2 , СО2 , Н2О, м3 отнесенные к 1 м3 сжигаемого газа; CT - средние объемные теплоемкости компонентов газообразного топлива при постоянном давлении, кДж/м3 ̊С; CB, CN2, CO2, СCO2, CH2O- средние объемные теплоемкости воздуха N2 , О2 , СО2 , Н2О при постоянном давлении, кДж/м3 ̊С. 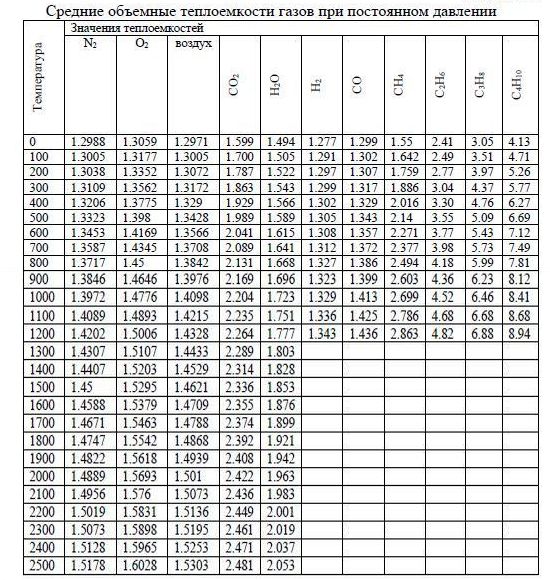 4) Калориметрическая температура сгорания природного газа: tк = 1855 ̊С СN2 = 1,4822; CO2 = 1,5618; CСО2 = 2,408; CН2О = 1,942; VN2 = 8,541 ; VО2 = 0,198 ; VСО2 = 0,992 ; VН2О = 2,124 ; tк = 36140/(8,541*1,4822 + 0,198*1,5618 + 0,992*2,408 + 2,124*1,942) = 36140/19,48 = 1855 ̊С. ЗАДАЧА 6 Рассчитать подовую горелку низкого давления без принудительной подачи воздуха для водогрейного секционного котла типа "Энергия-6" с поверхностью нагрева 52,7 м2. Котел работает на природном газе с QHP=36000 кДж/м3. Максимальный расход газа котлом VK= 86.8 м3/ч. Теоретическое количество воздуха, необходимого для сжигания газа, V0=9.49 м3воздуха/ м3газа. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
