Л.Р.ТФ_4. Теплоёмкость идеального газа
 Скачать 157.77 Kb. Скачать 157.77 Kb.
|
|
ЛАБОРАТОРНАЯ РАБОТА ПО ТЕПЛОФИЗИКЕ № 4 ТЕПЛОЁМКОСТЬ ИДЕАЛЬНОГО ГАЗАОзнакомьтесь с теорией в конспекте и учебнике (Савельев, т. 1, § 105). Запустите программу. Выберите «Термодинамика и молекулярная физика», «Теплоёмкость идеального газа». ЦЕЛЬ РАБОТЫ: Знакомство с компьютерными моделями идеального газа. Знакомство с понятием теплоемкости идеального газа. КРАТКАЯ ТЕОРИЯ: Для того, чтобы изменить температуру тела, к нему необходимо подвести некоторое количество теплоты. Отношение количества теплоты ΔQ к изменению температуры ΔT называют теплоемкостью тела. СТЕЛА = 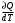 . .Удобно понятие теплоемкости относить к 1 молю вещества (молярная теплоемкость): В случае газа теплоемкость сильно зависит от рассматриваемого процесса, так как газы при нагревании или охлаждении могут изменять объем и совершать работу, величина которой зависит от процесса. Например, теплоемкость газа в изохорическом процессе СV меньше, чем теплоемкость в изобарическом процессе CP. ТЕПЛОЕМКОСТЬ ПРИ ПОСТОЯННОМ ОБЪЕМЕ: СV = 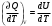 . .ТЕПЛОЕМКОСТЬ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ идеального газа, молекулы которого имеют i степеней свободы CP = 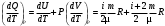 (1). (1).Молярные теплоемкости и связаны соотношением Р. Майера: CV+CP=R, где R=8.31 Дж/(моль К) - универсальная газовая постоянная. Для одного моля одноатомного газа. ОТНОШЕНИЕ 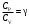 является константой (в определенном диапазоне температур) для данного газа. Эта константа называется показателем адиабаты. является константой (в определенном диапазоне температур) для данного газа. Эта константа называется показателем адиабаты.МЕТОДИКА И ПОРЯДОК ИЗМЕРЕНИЙ Внимательно рассмотрите картинку на рисунке. Ознакомьтесь с графиками в правой части изображения. Зарисуйте необходимое в свой конспект лабораторной работы. Получите у преподавателя допуск для выполнения измерений. 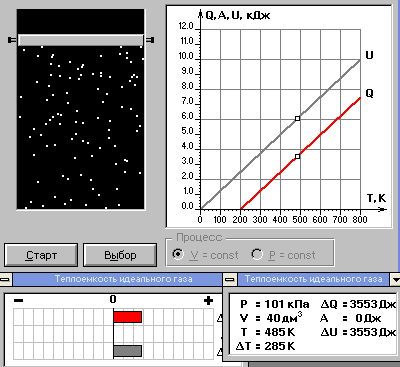 ИЗМЕРЕНИЯ: Запустите программу. Нажмите мышью кнопку «Старт» на экране и наблюдайте перемещение белых точек по кривым. Попробуйте останавливать процесс нажатием кнопки «СТОП». Последующий запуск процесса осуществляется нажатием кнопки «Старт». Нажмите мышью кнопку «Старт» и «ВЫБОР». Установите значение процесса «V=const». Снова нажмите «СТАРТ». Через каждые значения ΔТ=100° запишите значения давления, объёма, температуры, внутренней энергии, работы газа и теплоты в таблицу. Рассчитайте значение темпоёмкости для каждого значения температуры. Установите значение процесса «Р=const». Снова нажмите «СТАРТ». И повторите пункты 3 и 4. Постройте зависимость теплоёмкости от температуры. Сделайте вывод. ТАБЛИЦА. Результаты измерений
ОБРАБОТКА РЕЗУЛЬТАТОВ И ОФОРМЛЕНИЕ ОТЧЕТА: Зарисуйте в координатах «давление-объём» все три функции. Определите в каком случае наибольшее и наименьшее изменение работы, наибольшее и наименьшее изменение внутренней энергии и теплоты. Запишите ответы и проанализируйте ответы и графики. Вопросы и задания для самоконтроля Дайте определение внутренней энергии газа. Что такое теплота? Как будет определяться внутренняя энергия в различных термодинамических процессах? Как будет определяться теплота в различных термодинамических процессах? Дайте определения теплоёмкости. Перечислите различные виды теплоёмкости. Их математические определения. Соотношения Майера. Теплоёмкость при различных процессах. Константа адиабатического процесса. Связь теплоёмкости при различных процессов с числом степеней свободы молекулы газа. |
