Заказ №44 Термодинамический цикл 5 (Вариант 07). Термодинамический цикл 5
 Скачать 0.88 Mb. Скачать 0.88 Mb.
|
|
Термодинамический цикл 5
Дано: Совершает цикл. Известны параметры: Р1= 96·103 Па Р5 =2,75·105 Па T3=1215 °С T4 =2220 °C V2 =1,58 n=10 Определить: 1. Параметры в характерных точках цикла Р,υ , T. 2. Средние массовые теплоемкости в процессах цикла. 3. Термодинамическую l и потенциальную работу w, теплоту q, изменение внутренней энергии Рисунок: 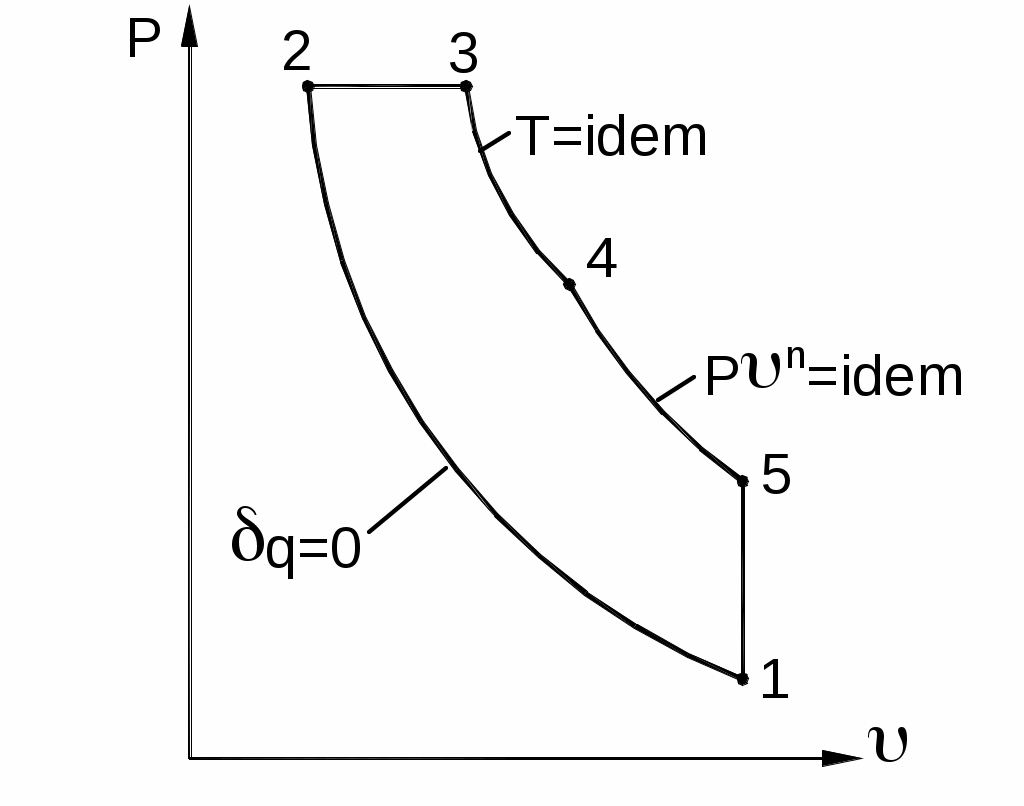 4. Построить цикл в координатах Р-V и Т -S. Расчет газовой смеси (табл.1) Состав газовых смесей
а) определение массового состава смеси: 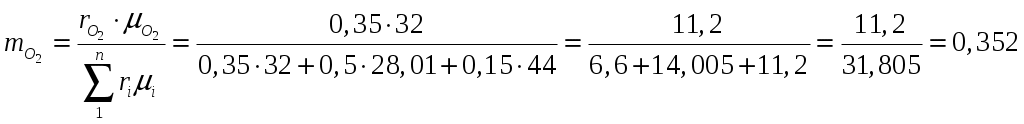 ; ;Проверка: 0,362 + 0,44 + 0,208 = 1. б) определение кажущейся молярной массы смеси: Проверка: через объемные доли: в) определение газовой постоянной смеси: Ri = 8314/ Проверка: через объемные доли: РАСЧЕТ ПАРАМЕТРОВ: Параметры состояния определяют по уравнению процесса, по соотношению между параметрами в процессах (табл.2), если в одной точке процесса известно три параметра, а в другой - один. Уравнение состояния – Клайперона применяют, если в точке известны два параметра из трех и для проверки. 1. p2 – по уравнению изобарного процесса 1-2, т.е. р = idem; р2 = р1 = 96·103 Па. 2. Где: k = Для определения Таблица:
По формуле определяются средние массовые теплоемкости смеси в диапазоне температур от 0°С до 580°С и от 0°С до 1215°С, по формуле (2) - в диапазоне температур от 580°С до 1215°С. Проверка по закону Майера: Rсм= 0,262 КДж/кг·К; 1,036 – 0,775 = 0,262 Проверка: Проверка: 1,177 – 0,915 = 0,262 Показатель адиабаты К = 1,177/0,915 = 1,3 3. p3 - из соотношений адиабатического процесса 2 – 3: Проверка по уравнению Клайперона: 4. По уравнению изотермического процесса 4 - 5: T4 = T5 = 2493 К 5. Р5/Т5 = Р1/Т1 6. 7. В изохорном процессе 5 – 1: Проверка: 8. v4 - из соотношения параметров для политропного процесса 3 – 4: 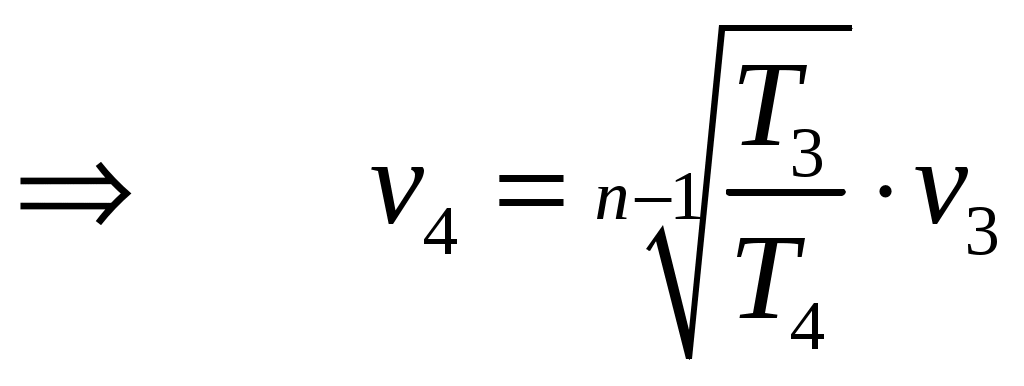 9. Р4- тоже из соотношения параметров для политропного процесса 3 – 4: 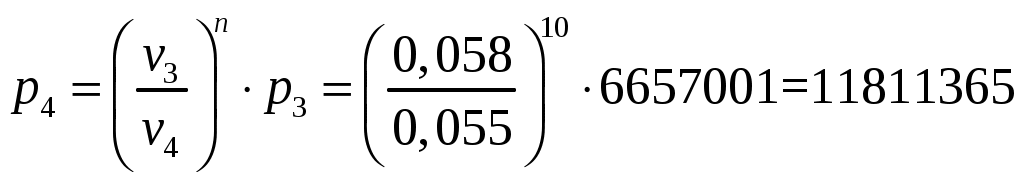 Па = 118,11·105 Па Па = 118,11·105 ПаПроверка: Или по уравнению изотермического процесса 4 - 5:
Результаты сводятся в табл. 3. Таблица №3:
Средние массовые теплоемкости в процессах цикла Расчет теплоемкостей в процессах цикла ведется аналогично расчету в адиабатном процессе 1-2. Сначала определяются средние массовые теплоемкости компонентов смеси Например, для кислорода – в интервале температур от 0°С до 873 °С: 0,993 – 0,733 = 0,260 1,076 – 0,779 = 0,297 1,04 – 0,851 = 0,189 После проверки результаты расчета сводятся в табл. 4. Таблица №4:
Затем рассчитываются средние массовые теплоемкости смеси от 0°С до температур точек цикла по формуле (расчет обязательно проверяется по закону Майера). Таблица №5:
Средние массовые теплоемкости смеси в процессах цикла рассчитываются по формуле (2). Для изотермического процесса 4-5. Т.к. изменение температуры равно нулю. Проверив расчет теплоемкости по закону Майера, результаты сводят в табл. 6. Таблица №6:
Термодинамическая работа l, потенциальная работа w, изменение внутренней энергии Процесс 2-3, адиабатный: k = 1,3 w 23 q23= 0 dS = Следовательно: S2 = S3 Остальные процессы цикла рассчитываются аналогично, используя формулы табл.2. Изобарный : Изотермический 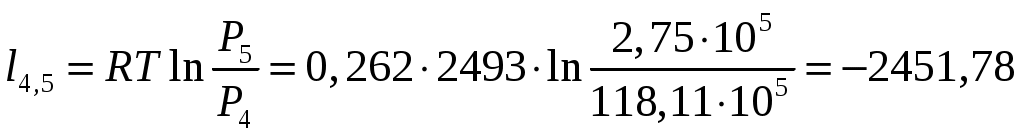 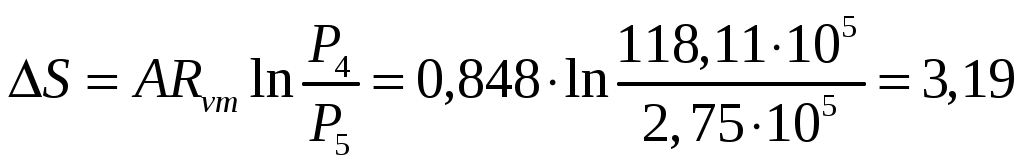 Изохорный Политропный 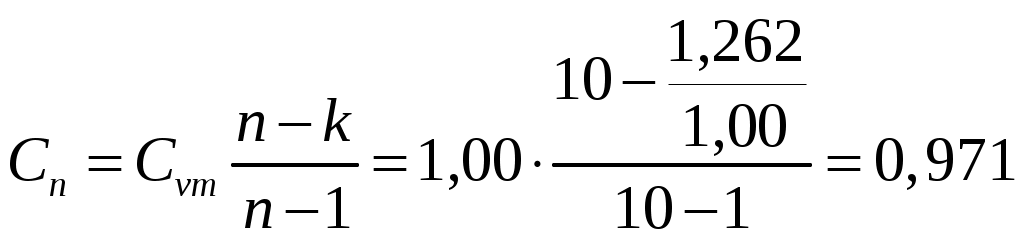 Результаты расчетов сведены в табл. 7:
Термический к.п.д. цикла: 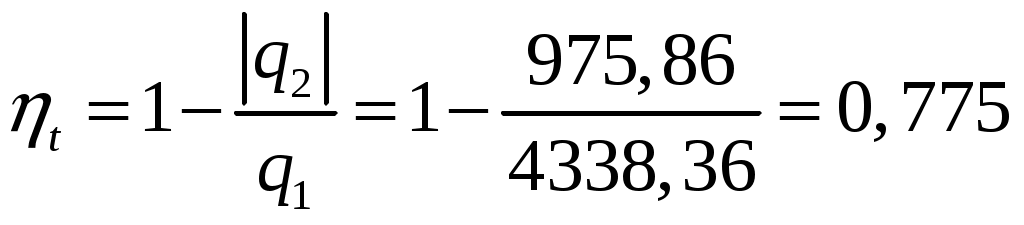 q2 = q45 + q51 + q12 = –2451,78–1571,064 – 315,52= – 4338,36 кДж/кг q1 = q34 =975,86 кДж/кг lц=q1 – Построение цикла в Р -V и Т -S координатах: При изображении цикла в координатах Р-V (рис.2) сначала строятся характерные точки цикла (1, 2, 3, 4, 5) по известным значениям давления и удельного объема. Затем - процессы, изображаемые прямыми линиями - изобарический процесс 1- 2 и изохорический процесс 5-1. Для построения криволинейных процессов – адиабатического 2-3, изотермического 4 - 5 и политропного 3 - 4 - необходимо определить две-три промежуточные точки между характерными точками по уравнению процесса: pVk = idem pV = idem pVn = idem При построении цикла в координатах Т -S (рис.3) также сначала строятся характерные точки цикла по значениям T и (S1 выбираем произвольно): Рис. 2 - Расчетный цикл в координатах T-S:  4 5 1 3 2  1 2 3 4 5 Рис. 3 - Расчетный цикл в координатах P-V: Средняя массовая теплоемкость при постоянном давлении газовый теплоемкость термодинамический | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
