ТЕРМОДИНАМИКА ПРИ ПЛАВЛЕНИИ ФЕРРОСПЛАВОВ
АННОТАЦИЯ Обзор термодинамической информации и моделей шлаков, включая соответствующее программное обеспечение, если оно доступно,представлена. Актуальность и точность этих моделей обсуждается путем сравнения их прогнозов дляразличные термодинамические свойства шлака с имеющимися экспериментальными данными. Практическая промышленнаяприложения будут проиллюстрированы обзором литературы по процессу дефосфоризации ферромарганца.сплавов и описанием поведения Ti при производстве силикомарганцевых сплавов. Этот последний примерпокажет, как термодинамические модели были использованы для предложения флотационной обработки при низкихтемпература для улучшения удаления TiC. 1. ВВЕДЕНИЕ В течение последних десятилетий были предприняты усилия по разработке термодинамических моделей для многокомпонентныхоксидные системы. Эти модели предназначены для расчета фазовых диаграмм и термодинамических диаграмм.такие свойства, как активность компонентов, сульфидная и фосфатная емкость и т. д.Эти модели содержат набор самосогласованных параметров, которые были откалиброваны по доступнымтермодинамическая информация, как правило, экспериментальные диаграммы состояния, разделение шлак / газ и шлак / металлэксперименты. К сожалению, для некоторых элементов, представляющих наибольший интерес для производства ферросплавов, таких как Ti,Cr, V или Nb, информация часто бывает редкой и разрозненной. Первая часть статьи, посвященнаятермодинамические данные в основном сосредоточены на информации, собранной в литературе относительно этих элементов.Представление моделей шлака, предложенных во второй части, не претендует на полноту. Представленов основном это модели, способные работать с многокомпонентными системами и реализованные вкоммерческое программное обеспечение или математические выражения которого можно легко обработать "вручную".Последняя часть статьи посвящена двум приложениям термодинамических концепций и моделей. Первоекасается литературного обзора процесса дефосфоризации ферромарганцевых сплавов (выбор шлакасостав, влияние состава сплава и температуры). Второй пример больше сфокусирован напотенциальный вклад термодинамических моделей. Это касается возможности удаления Ti при кремний-производство марганцевых сплавов.
2. ТЕРМОДИНАМИЧЕСКИЕ ДАННЫЕ Атлас шлаков остается одним из лучших справочников для пользователей, желающих получить быстрый доступ к сжатыми рассмотрена информация об основных термодинамических данных, касающихся металлургических шлаков. Кромеоксиды, которые являются основными компонентами металлургических шлаков, таких как SiO 2 , Al 2O 3 , Fe 2O 3 , FeO, MnO, MgO,CaO, по которому имеется достаточно полная и достоверная информация, также можно найти информацию наоксиды переходных элементов, таких как хром или ванадий, которые представляют наибольший интерес для ферросплавапромышленность. Однако, поскольку этим оксидам посвящено мало экспериментальных исследований, эта информациячасто бывает мало или не всегда пригодны для непосредственного использования. Например, фазовые диаграммы относительно хрома или титанаоксиды в большинстве случаев образовывались в окислительных условиях, когда эти элементывалентные состояния сильно отличаются от тех, которые они имеют в шлаках во время металлургической обработки. Ниже приводитсякраткий обзор литературы по хрому, титану, ниобию и ванадию, где акцент сделан нананесены данные о перегородке металл / шлак. 2.1 Хром Большинство фазовых диаграмм, касающихся хрома, было получено в воздухе, где хром имеет валентное состояние Cr3 +, и они представлены в Атласе шлаков. Коэффициенты распределения хромового шлака / металла обычно измерялись в равновесии с жидким чугуном, но также и со сплавами Pt-Fe в контролируемой атмосфере [2-4] и с жидким серебром [5]. Измерения активности также проводились с использованием кислородного зонда [6-8] или ячейки Кнудсена [9]. Эти разные методы позволяют изучать шлаки с очень разным содержанием оксидов хрома и железа: • шлаки, принадлежащие к системе SiO2-Al2O3-CrOx-MgO-CaO-CaF2 без оксидов железа, исследованы методами, не использующими жидкое железо [2-9], но также в равновесии с ферросплавом Cr, насыщенным углеродом [10,11], • SiO2-Al2O3-CaO шлаки с низким содержанием оксида железа и с высоким и низким содержанием оксида хрома и содержанием MgO до 14% [12-14],
• SiO2-FeOx-MnO и SiO2-FeOx-CaO-MgO шлаки с высоким и низким содержанием оксида Cr [15-19].

Рис. 1. Экспериментальная вариация коэффициента равновесия хромовый шлак / содержание металла с металлическим кремнием, основность шлака и содержание глинозема
Во всех этих ситуациях хром присутствует в двух валентных состояниях Cr2+ и Cr3 +, и отношение Cr2+ / Cr3+ увеличивается с уменьшением активности кислорода и уменьшением основности. На рисинке 1 показано влияние содержания Si в жидкой стали, легированной хромом, на равновесное распределение хрома LCrs / m, определяемое как (% Cr) шлак / [% Cr] металл, для кислого шлака [11]. В дальнейшем (% i) будет обозначать массовую долю i в шлаке, а [% i] - массовую долю i в металле.
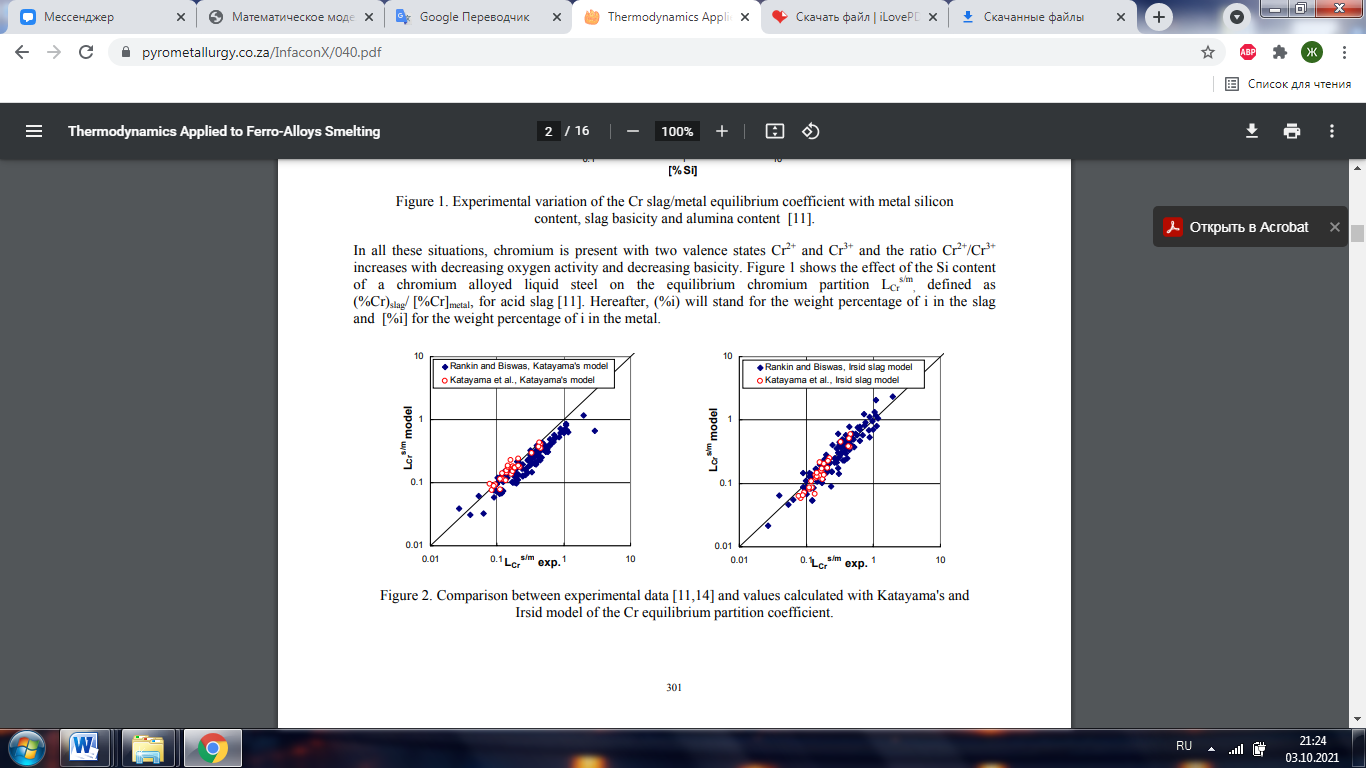
Рисунок 2. Сравнение экспериментальных данных [11,14] и значений, рассчитанных с использованием модели Катаямы и Ирсид для равновесного коэффициента распределения Cr.
Авторы предлагают полезное выражение коэффициента распределения Cr в зависимости от состава шлака и металла и температуры:
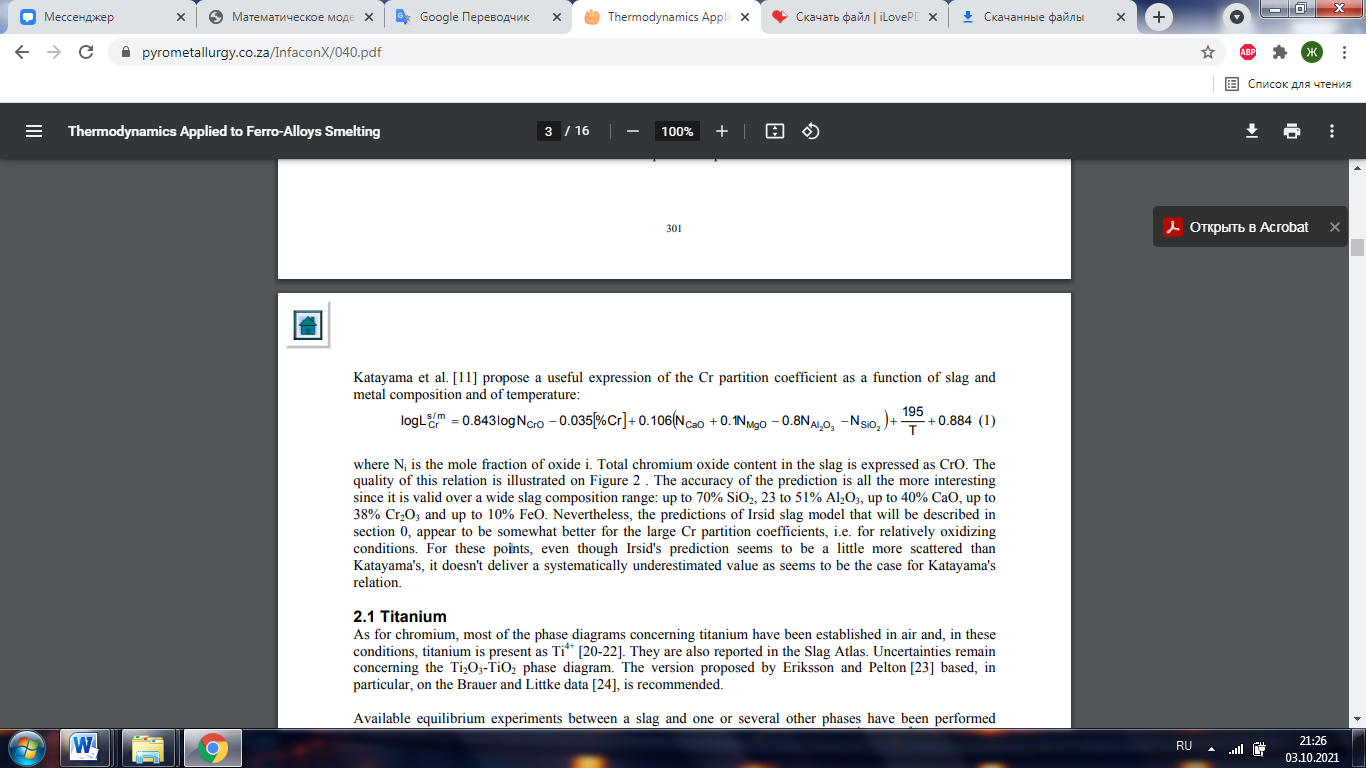
где Ni - мольная доля оксида i. Общее содержание оксида хрома в шлаке выражается в CrO. Качество этой связи показано на рисунке 2. Точность прогноза тем более интересна, что он действителен в широком диапазоне составов шлака: до 70% SiO2, от 23 до 51% Al2O3, до 40% CaO, до 38% Cr2O3 и до 10% FeO. . Тем не менее, прогнозы модели шлака Ирсид, которая будет описана в разделе 0, оказываются несколько лучше для больших коэффициентов распределения Cr, то есть для относительно окислительных условий. По этим пунктам, хотя предсказание Ирсида кажется немного более разбросанным, чем предсказание Катаямы, оно не дает систематически заниженной ценности, как, по-видимому, имеет место для отношения Катаямы. 2.1 Титан Что касается хрома, большинство фазовых диаграмм, касающихся титана, было получено на воздухе, и в этих условиях титан присутствует в виде Ti4+ [20-22]. О них также сообщается в Атласе шлаков. Остается неопределенность относительно фазовой диаграммы Ti2O3-TiO2. Рекомендуется вариант, предложенный Эрикссоном и Пелтоном [23], основанный, в частности, на данных Брауэра и Литтке [24]. Доступные эксперименты по установлению равновесия между шлаком и одной или несколькими другими фазами были выполнены в более восстановительных условиях, когда титан присутствует с двумя валентными состояниями Ti 4 + и Ti 3 +. Этими другими этапами являются: • газовая фаза [25]. При этом для системы SiO2-TiOx-CaO измерены только отношение Ti4 + / Ti3 + и отношение коэффициентов активности TiO2 / Ti2O3. • твердая металлическая фаза, железный тигель или сплав Pt-Mn, или жидкое серебро или медь, и контролируемая атмосфера. Относительно окислительные условия, преобладающие во время этих экспериментов (соответствующие активности кислорода выше 0,03 в эталонном состоянии 1 мас.%), Позволили изучить подсистемы SiO2-Al2O3-TiOx-FeOx-MnO-CaO [26-33] . • жидкая металлическая фаза (медь, никель, сталь и нержавеющая сталь), создающая более восстановительные условия для исследования системы TiOx-Al2O3-CaO [34-37] и системы SiO2-TiOx-CaO [38,39]. • графитовый тигель в контролируемой атмосфере для системы SiO2-TiOx-Al2O3-MgO-CaO [40-42].
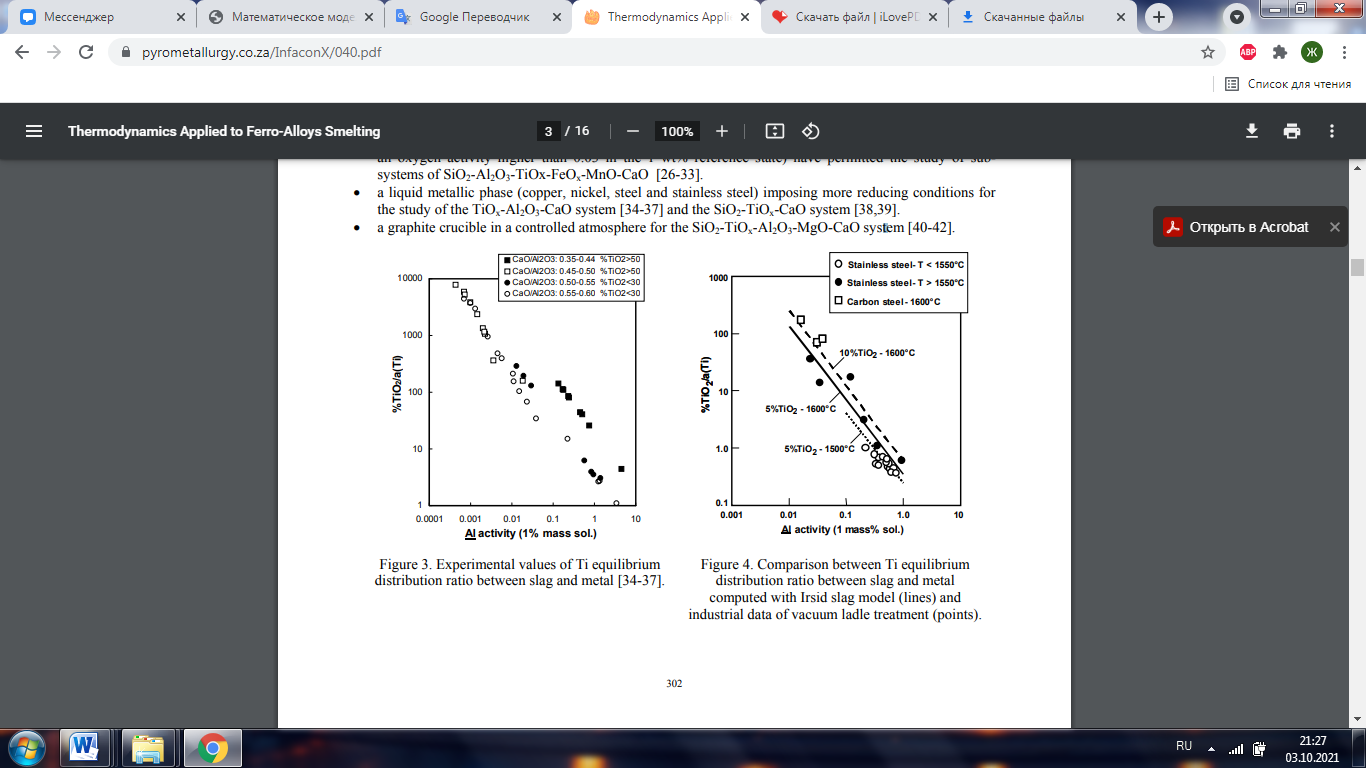
Рис 3. Экспериментальные значения коэффициента равновесного распределения Ti между шлаком и металлом [34-37]. Рис. 4. Сравнение коэффициента равновесного распределения Ti между шлаком и металлом, рассчитанного с помощью модели шлака Irsid (линии), и промышленных данных обработки в вакуумных ковшах (точки).
Для первого типа, как и в двух последних типах экспериментов, химический анализ разделения Ti3 + / Ti4 +. Что касается хрома, лабораторные эксперименты показывают, что соотношение равновесного распределения титана между шлаком и металлом зависит главным образом от кислородного потенциала, то есть, в случае алюминатных шлаков Са, показанных на Рисунке 3 [34-37], от активности металлического Al. Это соотношение увеличивается с уменьшением соотношения% CaO /% Al2O3, но эта зависимость более выражена для шлаков с высоким содержанием оксида титана. На этом рисунке характеристики стали выражены с помощью активности Ti и Al, что позволяет объединить информацию об углеродистой и нержавеющей стали. Для углеродистых сталей активности практически равны содержанию в% по массе, тогда как в случае нержавеющих сталей они существенно различаются (aAl 3-4% Al и aTi
7-8% Ti для рассматриваемых марок ). Эта тенденция была подтверждена промышленными результатами, как показано на рисунке 4, относительно обработки в ковше углеродистых и нержавеющих сталей [43], выполняемой со шлаками, имеющими более высокое содержание CaO, чем те, которые исследовались экспериментально. Для этих ковшевых шлаков с содержанием TiO2 менее 10% изменение соотношения% CaO /% Al2O3 относительно мало влияет на коэффициент распределения, тогда как увеличение содержания TiO2 или температуры вызывает увеличение коэффициента распределения. На рисунке линиями представлены расчеты, выполненные с использованием модели шлака Irsid (см. § 3.3) для составов шлака 5% и 10% TiO2, 10% MgO,% CaO /% Al2O3 = 1,4 при 1500 ° C и 1600 ° C, и экспериментальные точки представляют собой промышленные данные для составов шлака, несколько разбросанные вокруг этих значений. Хотя содержание оксида титана в шлаке выражается в% TiO2, в расчетах учитываются Ti3 + и Ti4+. 2.2 Ниобий Термохимические данные для ниобия меньше, чем для хрома или титана. Немногочисленные доступные фазовые диаграммы относятся к валентному состоянию Nb5+, и только две тройные диаграммы представлены в диаграммах фазового равновесия [44], то есть CaO-SiO2-Nb2O5 и CaO-TiO2-Nb2O5. В металлургических условиях ниобий также существует в двух валентных состояниях Nb5+, Nb4+ [45]. Среди имеющихся данных о коэффициентах равновесного распределения шлак / металл лишь несколько исследований относятся к химическим системам, представляющим металлургический интерес: • один на системе SiO2-NbOx-FeOt-MnO-MgO [46,47], • два по системе SiO2-NbOx-Al2O3-CaO [45,48].

Рис. 5. Влияние активности кислорода, основности шлака и температуры на коэффициент распределения Nb между жидкой сталью и шлаками SiO2-NbOx-Al2O3-CaO [45].
Даже если они касаются очень ограниченного диапазона составов, они предоставляют по крайней мере качественную информацию о влиянии нескольких ключевых параметров, таких как активность кислорода, основность шлака и температура. Например, данные, представленные на рисунке 5, относительно шлаков SiO2-NbOx-Al2O3-CaO с содержанием Al2O3 от 30 до 45% [45], достаточно четко показывают влияние основности шлака (ее увеличение приводит к увеличению Коэффициент распределения Nb), но экспериментальный разброс не позволяет выявить температурный эффект. Остальные исследования представляют собой в основном кинетические эксперименты по удалению ниобия из чугуна и не могут использоваться в качестве источника данных о равновесии [49-55]. 2.3 Ванадий Для систем, содержащих оксид ванадия, доступно очень мало фазовых диаграмм. В этих исследованиях, как и в случае титана, ниобия и хрома, ванадий находится в более высоком валентном состоянии V5+. В Атласе шлаков указаны только один бинарный CaO-V2O5 и часть тройного Na2O-SiO2-V2O5. Некоторые другие предложены в Фазовых диаграммах для керамистов, но для большинства из них их рисунок, по крайней мере, частично гипотетический. Исследования разделения ванадия на шлак и металл проводились в основном для оптимизации извлечения ванадия из чугуна. Поэтому они были выполнены в довольно окислительных условиях за счет уравновешивания шлаков: • с прочной стальной фольгой [56, 57], • с жидким чугуном [58,59] или • в ванадиевых тиглях в контролируемой атмосфере [60]. Состояние валентности ванадия в этих условиях остается довольно спорным. Согласно Werme [57], можно найти три валентности; V3 +, V4 + и V5 +. Например, был исследован эффект добавления CaO, Na2O, MgO, Al2O3 и TiO2 в FeOx-SiO2 [56,57]. Все эти добавки, за исключением TiO2, приводят к уменьшению коэффициента разделения ванадия. Также были изучены шлаки, содержащие Na2O, такие как шлаки Na2O-CaO-CaF2-SiO2, дважды насыщенные CaO и 2CaO.SiO2, выполненные Tsukihashi et al. [61] или шлаки Na2O-SiO2 по Werme et al. [56]. Селин [62,63] предлагает графическое представление коэффициентов разделения ванадия для шлаков CaO-FeOx-SiO2, насыщенных MgO (рис. 6). Эту же графику можно использовать без какой-либо поправки для шлаков, содержащих Al2O3 до 14% и TiO2 до 13%, пока они остаются насыщенными магнезией.

Рис. 6. Равновесный коэффициент распределения ванадия s / m L V (1,0) между шлаками CaO-FeOx-MgOsat-SiO2- 1,0 мас.% V и жидким железом при 1600 ° C.
3. МОДЕЛИ ТЕРМОДИНАМИЧЕСКОГО ШЛАКА И КОМПЬЮТЕРНОЕ ПРОГРАММНОЕ ОБЕСПЕЧЕНИЕ
Чтобы их было удобно использовать и максимально безопасно экстраполировать, эти данные использовались для оценки математических моделей. Эти модели были включены в компьютерные программы для решения сложных металлургических задач, требующих расчетов, включающих, например, помимо жидкой фазы шлака, жидкую металлическую фазу и, возможно, одну или несколько твердых фаз. Краткий обзор этих моделей представлен здесь вместе с областью их применения с точки зрения состава шлака и, если таковые имеются, компьютерного программного обеспечения, в котором они были реализованы. 3.1 Модели регулярных решений В этих моделях коэффициенты активности оксидов рассчитываются как квадратичные полиномы мольных долей компонентов. Например, выражения активности оксидов, основанные на этом формализме, были предложены для шлаков SiO2-FetO-CaO Ban-ya et al. [64,65] или коэффициента распределения P-шлак / металл в шлаках SiO2-P2O5-FetO-MgO-CaO [66]. 3.2 Модели подрешеток Модель двух подрешеток [67] для ионных растворов является расширением общей модели подрешеток [68]. Предполагается, что жидкая силикатная фаза состоит из двух подрешеток: одной для катионов, а другой - для анионов и нейтральных частиц. Эта модель реализована в Thermo-Calc [69], MTDATA [70] и GEMINI2 [71]. Одним из последних достижений этой модели, предложенной в Thermo-Calc, является оценка системы Ca-Fe-O-Si [72,73]. В этой оценке и жидкий металл, и шлаковая система CaO-FeO-Fe2O3-SiO2 описываются ионной двухподрешеточной моделью с единым набором параметров. Новая математическая модель была разработана Бьёркваллем [74]. Он использует описание Темкина энтропии ионных расплавов в сочетании с описанием силикатных и алюминатных расплавов Ламсдена [75], где ионные расплавы рассматриваются как кислородно-ионная матрица с распределенными в ней катионами. В отличие от модели с двумя подрешетками, предполагается, что в структуре расплава не должно присутствовать нейтральных частиц, и для оценки параметров используется только информация из бинарных подсистем. Эта модель была применена к составам в системе Al2O3-CaO-MgO-MnO-SiO2 с в целом удовлетворительным согласием с экспериментальными значениями, но также вызвала некоторые разногласия, которые, как считается, указывают на необходимость дополнительной надежной экспериментальной информации. Модель для прогнозирования сульфидных мощностей, основанная на том же описании структуры, также была разработана в KTH [76]. Логарифм сульфидных емкостей определяется как полином мольных долей различных катионов в кислородно-ионной матрице. Он был применен для прогнозирования сульфидных емкостей в шлаках «FeO» -Al2O3-CaO-MgO-MnO-SiO2 [77,78]. Могутнов и др. [79] разработали модель ассоциированного раствора жидких шлаков и силикатов, основанную на теории Пригожина, и успешно применили ее к тройным и четвертичным составам системы CaF2-CaO-Al2O3-SiO2-MnO-Ca3P2. 3.3 Квазихимические модели Эта категория моделей использует квазихимическую теорию Гуггенхайма [80] для учета ближнего порядка в ионных расплавах. Модифицированная квазихимическая модель [81] была оценена для многокомпонентных систем, содержащих различные комбинации компонентов Al2O3, CaO, MgO, MnO, FeO, Na2O, TiO2, Ti2O3 и ZrO2. Эта модель используется в программном обеспечении FactSage, которое является результатом слияния F * A * C * T [82] и ChemSage [83]. База данных для этого пакета недавно была значительно увеличена за счет критической оценки различных бинарных, тройных и четвертичных оксидных систем, содержащих оксиды свинца, цинка или хрома [84-86]. Кроме того, та же модель использовалась для термодинамического моделирования жидких штейнов Fe-Ni-Cu-Co-S [87] и Co-Fe-Ni-S [88], что привело к созданию полной базы данных по выплавке меди. и уточнение [89]. Эта база данных была впоследствии расширена для расчетов в системе Zn-Pb-Cu-Ca-Fe-Si-O-S [90,91]. В этой базе данных фазы шлака, штейна и сплава рассматриваются как разные фазы, все они описываются модифицированной квазихимической моделью, а растворимость сульфидов в шлаке предсказывается моделью Редди-Бландера, модифицированной Пелтоном. Моделирование штейна и шлака как одной оксисульфидной фазы объявлено предметом будущих работ. Модель ячейки IRSID для шлаков также основана на квазихимической теории [92]. В настоящее время он используется для расчетов в системе SiO2-TiO2-Ti2O3-Cr2O3-Al2O3-Fe2O3-CrO-FeO-MgO-MnO-CaO-CaF2-S [93]. Реализации этой модели доступны в Thermocalc [69] и FactSage [83], а также в некоммерчески доступном пакете CEQCSI, разработанном в IRSID. Расширение этой модели до описания модели оксисульфидов с полным диапазоном растворимости между чистыми оксидами и чистыми сульфидами также было объединено для системы SiO2-Al2O3-Fe2O3-FeO-MgO-MnO-CaO-S [94 ]. В этой модели для описания многокомпонентных систем используются только бинарные параграфы. 3.4 Другие модели Несмотря на то, что она не реализована ни в каком коммерческом программном обеспечении, адаптация модели Флуда и Грйотейма [95] дает очень точные оценки распределения P, O, Mn и S между жидкой сталью и основными рафинировочными шлаками [96,97]. Он основан на предположении об идеальном смешивании ионных частиц: катионов Ca2+, Mg2+, сложных анионов SiO44-, PO43- и простых анионов O2-, S2. Затем используются полуэмпирические корреляции для оценки отклонения от идеальности.
Некоторые более перспективные подходы, в частности, основанные на молекулярной динамике, предлагаются [98-101], но в настоящее время их использование ограничено простыми двойными или тройными системами, и будущее развитие этого метода для сложных систем весьма неопределенно.
3.5 Оптическая основность
В литературе предлагается несколько корреляций для связи химических свойств шлаков, таких как сульфидная или фосфатная емкость, с их оптической основностью, выраженной как линейная комбинация оптической основности каждого из его компонентов. В Атласе шлаков можно найти обзор полезных соотношений для емкости сульфидов и фосфатов по кислороду, марганцу, ванадию и воде. Уточкин [102] предлагает такую же корреляцию для оценки нитридных емкостей в титансодержащих шлаках, а Wall et al. [48] для коэффициента активности оксида ниобия. Недавно был разработан удобный программный пакет с целью обеспечения доступа к базе данных оптической базисности для технологических приложений и для целей научной оценки [103].
Однако пользователь должен проявлять осторожность при использовании этих отношений за пределами своей области действия. Например, было показано, что использование соотношения Сосинского и Соммервилля для оценки емкости сульфидов [104] может привести к ошибкам до двух или трех порядков величины при применении к шлакам, богатым MnO и / или FeO [105].
4. ПРОМЫШЛЕННОЕ ПРИМЕНЕНИЕ Первое приложение, представленное ниже, касается возможности дефосфоризации ферромарганцевых сплавов путем реакции шлак / металл. Второй иллюстрирует использование термодинамического моделирования для оптимизации удаления Ti из силикомарганцевых сплавов. 4.1. Дефосфоризация ферромарганцевых сплавов Большинство экспериментальных исследований по дефосфоризации ферромарганца проводилось в окислительных условиях. В этих условиях реакция дефосфоризации может быть выражена как:
4.1.1 Влияние состава шлака
Экспериментальные исследования в основном проводились со шлаками, содержащими BaO или BaCO3, и сплавами с высоким содержанием углерода.
для температур от 1300 до 1400 ° C [106-108]. Они показывают, что эти шлаки содержат фосфат.
мощности на несколько порядков выше, чем Са-содержащие шлаки, обычно используемые при рафинировании стали [109–113].
Для таких шлаков коэффициенты дефосфоризации, определяемые как 100.
([% P] конечный- [% P] начальный) / [% P] начальный), до 70% может быть
получено [114].
Отметим, что эти Ba-содержащие шлаки обладают более высокой сульфидной емкостью, чем Ca-содержащие шлаки, и, следовательно,
Эти шлаки могут частично обессеривать марганцевые ферросплавы во время операции дефосфорации.
4.1.2 Влияние состава ферросплавов
В отличие от сталей, присутствие углерода усиливает дефосфоризацию ферромарганца (Рис 7) и ограничивает окисление марганца [106,107,115]. Это связано с тем, что увеличение содержание углерода увеличивает коэффициент активности фосфора при одновременном снижении активности марганца коэффициент (рис. 8) и не уменьшает кислородный потенциал, налагаемый Mn / MnO
равновесие. Поскольку марганец увеличивает содержание углерода при насыщении графитом [116-118], это выгодно
влияние содержания углерода может быть использовано для усиления дефосфорации ферросплавов с высоким содержанием марганца.

Рис. 9. Области стабильности фосфатов и фосфидов Ba и равновесие между оксидом Mn и сплавом Fe-70% Mn-7% C при 1300 ° C [107]. Рис. 10. Области стабильности фосфатов и фосфидов Са и равновесие между оксидом Mn и сплавом Fe-70% Mn-7% C при 1300 ° C [107].
Например, экспериментальные исследования дефосфорации в восстановительных условиях были выполнены с использованием шлаков Ca-Si-CaF2 и CaC2-CaF2 [113, 120, 122, 123]. Затем фосфор удаляется карбидом
кальция по реакции:
 3CaC2 + 2[P] (Ca3P2) + 6[C] (5) 3CaC2 + 2[P] (Ca3P2) + 6[C] (5)
В таких восстановительных условиях можно получить коэффициенты разделения 500 [124] по сравнению с коэффициентами менее 100, которые могут быть получены для дефосфорации в окислительных условиях [114,116]. Чтобы обеспечить подходящие восстановительные условия, в расплав следует добавить алюминий или кремний. Ли [116] рекомендует содержание кремния более 0,6%. Степень дефосфоризации заметно снижается при увеличении содержания углерода или уменьшении содержания марганца [122,125]. В таких восстановительных условиях при дефосфоризации образуются нестабильные фосфины (PH3), которые в присутствии воды превращаются в токсичную фосфорную кислоту [109]. В настоящее время переработка шлака или газа не разработана.
4.1 Описание поведения титана в силикомарганцевых сплавах Силикомарганцевые сплавы, используемые в сталелитейной промышленности, должны соответствовать некоторым строгим требованиям, касающимся максимального содержания в них посторонних элементов, таких как титан. Целью исследования, представленного здесь [126], было определение условий процесса для получения путем осаждения карбида титана и флотации как можно более низкого содержания титана для промышленных сплавов. Для этого сначала необходимо было разработать термодинамическую модель сплавов и оценить ее на основе лабораторных экспериментов. 4.2.1Термодинамическое моделирование Термодинамические свойства системы Mn-Fe-Si-C и всех подсистем описывались моделью «Центральных атомов» [127]. Эта модель основана на физическом описании структуры металлической жидкости в виде ячеек. Каждая ячейка состоит из центрального атома, окруженного его ближайшими соседями, расположенными на двух типах атомных позиций, различаемых в структуре: замещающих и междоузельных. Эта модель позволяет с помощью небольшого числа параметров точно описывать свойства жидкой фазы. В качестве примера на рисунке 11 показано удовлетворительное согласие между активностями Mn, рассчитанными с помощью модели, и имеющимися экспериментальными данными для системы Mn-Si-Fe. Другой пример представлен на рисунке 12, на котором сравниваются экспериментальные линии насыщения углерода и карбида кремния и прогнозы модели.

Рис. 11. Активности Mn в системе Mn-Si-Fe при 1700 K: литературные данные [128] и моделирование.
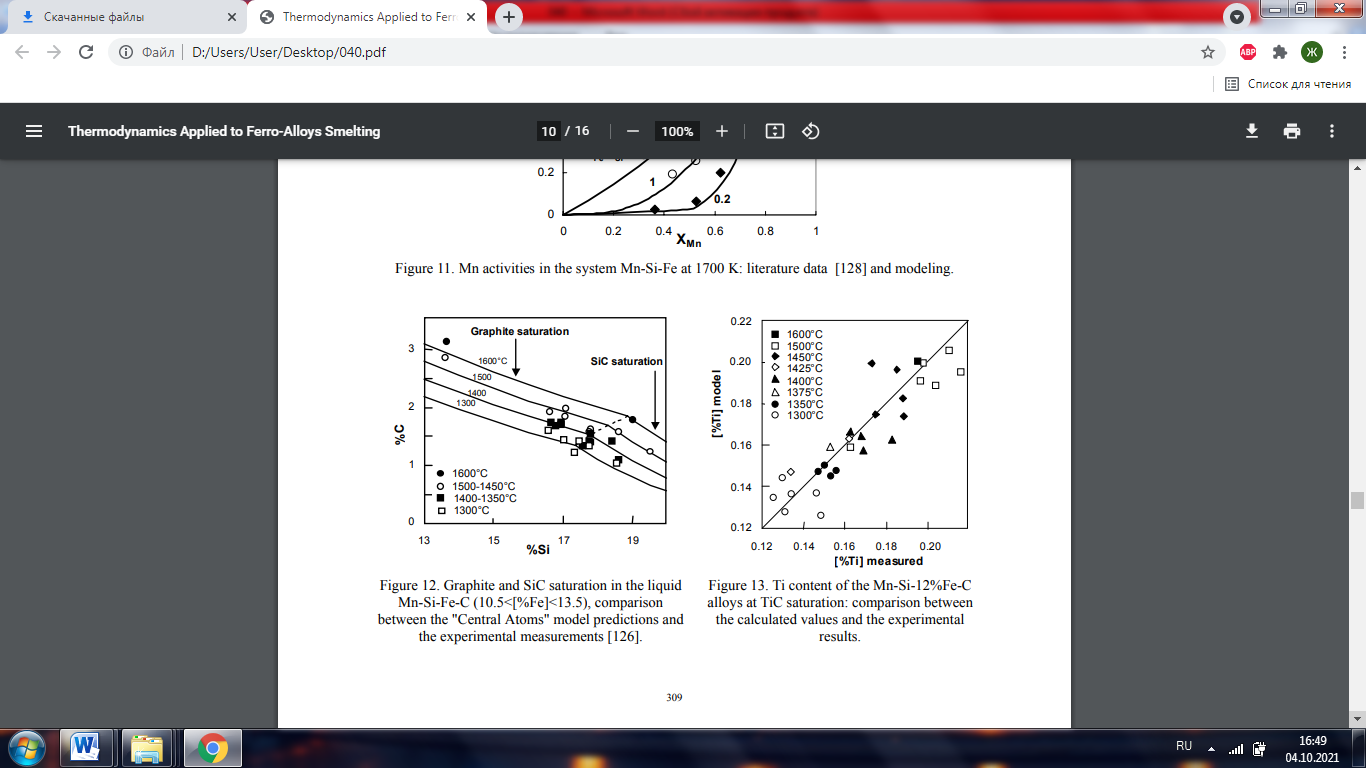
Рис. 12. Насыщение графита SiC в жидкости. Mn-Si-Fe-C (10,5 <[% Fe] <13,5), сравнение между предсказаниями модели «Центральные атомы» и экспериментальные измерения [126]. Рис. 13. Содержание Ti в сплавах Mn-Si-12% Fe-C при насыщении TiC: сравнение расчетных значений и экспериментальных результатов.
Из-за его низкого содержания в сплавах поведение Ti было смоделировано с помощью формализма 1% разбавленного раствора. Рисунок 13 показывает, что это моделирование дает вполне удовлетворительные оценки содержания Ti при насыщении TiC по сравнению с лабораторными результатами, полученными на промышленных сплавах [126]. 4.2.2 Промышленное применение Анализы промышленных силикомарганцевых сплавов показаны на Рисунке 14 вместе с различными линиями насыщения (TiC / графит и TiC / SiC), как предсказано термодинамической моделью. Этот рисунок ясно показывает потенциальную выгоду флотационной обработки, состоящей из мягкого перемешивания газа, при всплывании частиц TiC. Даже при 1600 ° C флотация TiC далека от завершения, и с помощью флотационной обработки при 1300 ° C можно было бы получить гораздо более низкое содержание титана. Например, для сплава с 20% Si, полученного при 1600 ° C, может быть достигнуто содержание титана 0,16%, тогда как для сплава с 16% Si может быть получено еще меньшее содержание 0,11%. Эта флотационная обработка была бы более выгодной для сплавов, насыщенных графитом с низким содержанием Si, чем для сплавов с высоким содержанием Si, насыщенных SiC. Для этих сплавов с высоким содержанием кремния обработка флотацией приведет к потере кремния, которая может иметь коммерческий ущерб.

Рис. 14. Равновесное содержание титана в сплавах Mn-Si-12% -Fe-C, насыщенных TiC, влияние флотационной обработки при 1300 ° C на два сплава с различным содержанием кремния, выплавленных при 1600 ° C. 5.ВЫВОДЫ
В последние десятилетия как термодинамическое моделирование шлаков, так и комплексное программное обеспечение для расчета равновесия достигли значительного прогресса. Например, теперь с помощью этого программного обеспечения можно довольно точно описать равновесное состояние большинства химических систем, представляющих интерес для сталеваров. Что касается промышленности ферросплавов, термодинамическое моделирование может также использоваться во многих интересных ситуациях, как было показано в этой статье на примере удаления Ti из марганцевого сплава. Но, к сожалению, остаются важные пробелы в знаниях о термодинамических свойствах важных для этой отрасли элементов, таких как Nb или V. До любой попытки смоделировать поведение таких элементов обзор литературы в этой статье показывает, что отсутствует больше всего восполняют этот пробел экспериментальные результаты.
|
 Скачать 1.83 Mb.
Скачать 1.83 Mb.






 3CaC2 + 2[P] (Ca3P2) + 6[C] (5)
3CaC2 + 2[P] (Ca3P2) + 6[C] (5)

