Расчётно графическая работа № 1. мансурова карина ргр1. Термодинамика процессов горения топлива
 Скачать 52.96 Kb. Скачать 52.96 Kb.
|
|
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования «Магнитогорский государственный технический университет им. Г.И. Носова» Расчетно-графическое задание по дисциплине «Физико-химические основы металлургического процессов » раздел «ТЕРМОДИНАМИКА ПРОЦЕССОВ ГОРЕНИЯ ТОПЛИВА» Выполнила: Студентка гр.МХБ-21-12 Мансурова К.И. Проверил: (подпись) Смирнов А.Н. Магнитогорск 2023 ФОРМУЛИРОВКА ЗАДАНИЯ Задача №1. Для реакции водяного газа: CO(г) + H2O(г) = CO2(г) + H2 (г) (1) определить возможное направление реакции и равновесный состав газа при соответствующих температурах и составе исходной смеси (табл. 1). Уравнение зависимости константы равновесия от температуры имеет вид: 𝑙gKp = (1913/Т) -1,75 (2) Определить аналитически и графически температуру при которой исходная смесь будет находиться в равновесии. Задача №2. Для реакции: С(т) + CO2(г) = 2СО(г) (3) уравнение зависимости константы равновесия от температуры имеет вид: 𝑙gKp = - (8916/Т) + 9,11 (4) определить равновесный состав газа в зависимости от температуры и давления (табл. 2). Полученные значения представить в виде таблицы и графика. Таблица 1 Температура и состав исходной смеси для реакции водяного газа (исходные данные для задачи №1)
Таблица 2 Значение температуры и давления для реакции С(т) + CO2(г) = 2СО(г) (исходные данные для задачи №2)
ПРИМЕР РЕШЕНИЯ ЗАДАНИЯ Задача №1: Равновесный состав газа в реакции водного газа: CO(г) + H2O(г) = CO2(г) + H2(г) (1) Данная реакция имеет место во многих процессах горения топлива, определяя в значительной степени состав газа в доменной печи при взаимодействиях водяного пара с коксом при мокром и сухом тушении. Равновесие реакции количественно характеризуется константой равновесия:  (2) (2)Данная система трехкомпонентная и однофазная, поэтому: C = k – f + n = 3 – 1 + 1 = 3 Значит, равновесный состав газа зависит от трех факторов: температуры Т и двух исходных концентрации. Константа равновесия реакции может быть рассчитана по эмпирическому уравнению: lgKp = 1913/T -1,75 = 1913/(t+273) – 1,75 (3) Kp=10(1913/(t+273) – 1,75) (4) Кр(550) = 10(1913/(550+273))-1,75=3,75 Кр(650) = 10(1913/(650+273))-1,75=2,10 Кр(750) = 10(1913/(750+273))-1,75=1,32 Кр(850) = 10(1913/(850+273))-1,75=0,89 Кр(950) = 10(1913/(950+273))-1,75=0,65 По условию задачи известен исходный состав газа: 23% CO, 27% H2O, 20% СО2 , 30% Н2. Значит, в 100 моль исходного газа содержалось такое же количество моль каждого компонента: ni = % i Допустим, что при некоторой температуре t°C реакция возможна в прямом направлении и к моменту достижения равновесия прореагирует Х моль СО с Х моль H2O, и появилось Х моль H2 и Х моль СО2. Тогда при равновесии количества молей газов (об.%) (25-Х) моль СО (25-Х) моль H2O (25+Х) моль СО2 (25+Х) моль H2 КР(1) = 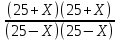 (5) (5)Решая уравнение (5) относительно Х при различных температурах, получаем два значения корня уравнения, приведенных в таблице 1. Таблица 1 Расчетные данные
Из таблицы следует, что только корень Х1 имеет физический смысл. По знаку этого корня оцениваем возможные направления реакции при каждой температуре. Отрицательные значения вызваны протеканием реакции влево. Направление процесса можно определить по известному уравнению изотермы Вант - Гоффа:  (6) (6)Пр(1) =  = =  При 550, 650, 750 °C Кр > Пр ∆G < 0 , прямая Реакция (слева направо) При 850, 950 °C Кр < Пр ∆G > 0 , обратная реакция (справа налево) Температура, при которой исходная смесь находится в равновесии: 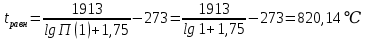 (7) (7)Таблица 1 иллюстрирует влияние температуры на равновесный состав газа. Повышение температуры вызывает увеличение концентрации исходных веществ, т.е. равновесие смещается в обратном направлении (справа налево). Это характерно для экзотермических реакций. Оценим среднее значение теплового эффекта реакции: lgKp(1) =  (8) (8)С учетом уравнения (3), получаем: ∆H = - 1913·2,3·8,31 = - 36563 Дж ∆S = - 1,75·2,3·8,31 = - 33,5 Дж/К Равновесная температура для исходной смеси может быть найдена и графически: Рис. 1. К определению равновесной температуры 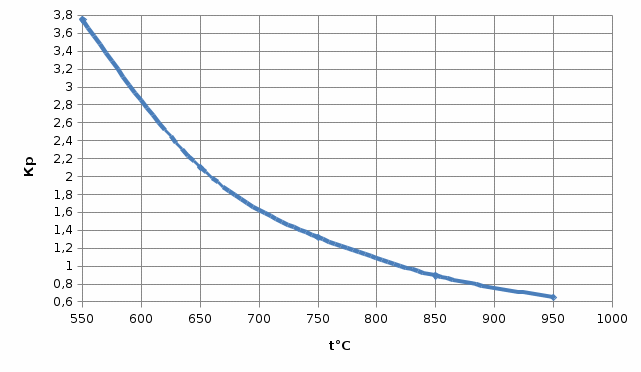 Задача №2: Равновесный состав газа в реакции: С(т) + CO2(г) = 2СО(г) (1) Данная реакция имеет место во всех процессах взаимодействия газовой фазы с твердым углеродом в коксохимическом производстве и металлургии. Поскольку система двухкомпонентная и двухфазная, то вариантность по правилу фаз Гиббса равна: C = k – f + n = 2 – 2 + 2 = 2 т.е. равновесный состав зависит от двух параметров температуры Т и давления Р. %CO равн. = φ (Т, Р) 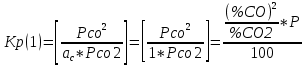 (2) (2)Уравнение зависимости константы равновесия от температуры для реакции (1) имеет вид: LgKp = -(8916/T)+9,11 Тогда LgKp = 10-(8916/T)+9,11 (3) Пусть %CO + %СO2 = 100% (4) Преобразуем уравнение (2) к стандартному виду квадратного уравнения, получим: Р · %CO² + Кр·100%СО - 100² · Кр = 0 (5) Решая это квадратное уравнение относительно %СО, находим состав газа при разных давлениях (табл. 2). Таблица 2 Равновесный состав газа
Данные расчета представлены на рис.2. 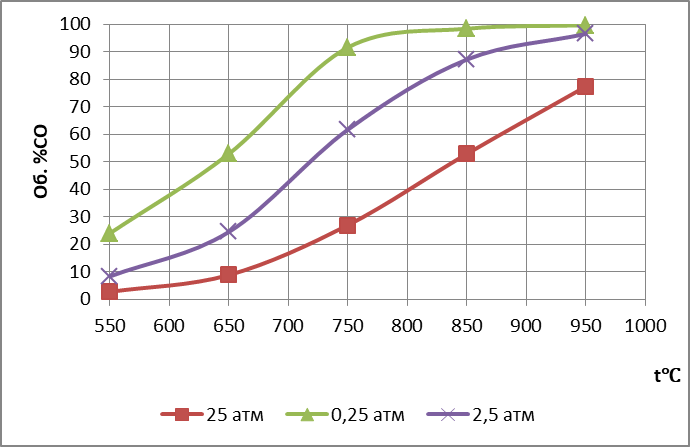 Рис. 2. Равновесный состав газа при разных давлениях Из таблицы 2 и рисунка 2 следует, что повышение температуры вызывает увеличение %СО, т.е. смещение равновесия реакции вправо, что характерно для эндотермических процессов. ∆H = + 8916·2,3·8,31 = 170411 Дж Увеличение давления смещает равновесие влево, т.к. в этом направлении уменьшается число моль газов. На рис. 2 изобары %СО = f (Т) делят поле графика на две части: левую и правую от изобары. В каждой из этих частей равновесие реакции отсутствует и возможно необратимое протекание процесса или реакции вправо (в правой части) и в левой части в обратном направлении. БИБЛИОГРАФИЧЕСКИЙ СПИСОК Рыжонков Д.И., Арсентьев П.П., Яковлев В.В. и др. Теория металлургических процессов. М.: Металлургия, 1989. 392 с. Казачков Е.А. Расчеты по теории металлургических процессов. М.: Металлургия, 1988. 288 с Попель С.И., Сотников А.И., Бороненков В.Н. Теория металлургических процессов. М.: Металлургия, 1986. 463 с. Гольдштейн Н.Л. Краткий курс физической химии металлургических процессов.Магнитогорск,2009.338 с. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
