Определение величины давления идеального и реального газа. РГЗ по термодинамике. Термодинамика
 Скачать 392.76 Kb. Скачать 392.76 Kb.
|
|
ТЕРМОДИНАМИКА Расчётно-графическое задание “Определение величины давления идеального и реального газа” Вариант № 10 Задание к расчётно-графической работе Баллон, имеющий известную ёмкость V, заполнен указанным газом. Данный газ имеет заданную температуру t. Величина давления Рэксп задана и установлена экспериментальным путём. Масса газа задана и составляет mгаз. Определить величину давления газа следующими перечисленными способами: - по уравнению состояния, считая газ идеальным (с использованием величин универсальной и удельной газовой постоянной); - расчётно-графическим методом, считая газ неидеальным (реальным). Сопоставить полученные значения с величиной Рэксп и сформулировать соответствующий вывод по работе. Значения параметров газа
Решение: Определение величины давления по уравнению состояния идеального газа а) через универсальную газовую постоянную R: В соответствии с уравнением Менделеева-Клапейрона для идеального газа имеем: 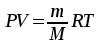 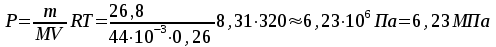 , ,где: V – объём газа в м3; (переведем литры в м3: V=260·10-3=0,26 м3); R=8,31 Дж/(моль·К) – универсальная газовая постоянная; M= 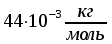 - мольная масса молекулярной формы углекислого газа (CO2); - мольная масса молекулярной формы углекислого газа (CO2);T=t+273=47+273=260 K – температура в единицах абсолютной термодинамической шкалы. Сравним полученное расчётное значение с экспериментально определённой величиной давления Рэксп: 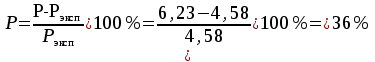 Pэксп=45,21 атм=45,21·0,10133=4,58 МПа Расхождение составляет 36%, что весьма существенно с точки зрения практики современных инженерных расчётов. б) через удельную газовую постоянную Rу: В соответствии с уравнением состояния идеального газа имеем: 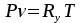 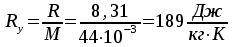 , ,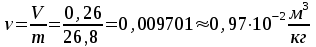 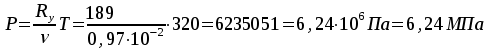 где: v – удельный объём газа в м3/кг. Сравним полученное расчётное значение с экспериментально определённой величиной давления Рэксп: 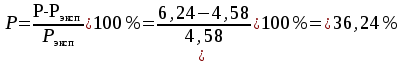 Расхождение составляет 36,24 %, что также неприемлемо с точки зрения практики современных инженерных расчётов. Определение величины давления расчётно-графическим методом Для использования Z-диаграммы определим все необходимые параметры: - значение приведенного объёма 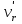 : :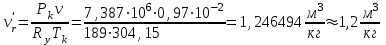 , ,где: 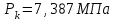 - критическое давление (справочная величина для углекислого газа, [2]); - критическое давление (справочная величина для углекислого газа, [2]);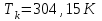 - критическая температура (справочная величина для углекислого газа, [2]); - критическая температура (справочная величина для углекислого газа, [2]);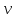 - удельный объём (м3/кг); - удельный объём (м3/кг);- значение приведенной температуры : 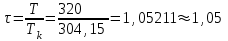 . .В соответствии с Z-диаграммой изохора 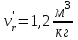 и линия, отвечающая безразмерной температуре и линия, отвечающая безразмерной температуре 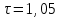 , пересекаются в точке, которой соответствует значение параметра =0,67. Тогда величина давления Р, определённая по Z-диаграмме, составит: , пересекаются в точке, которой соответствует значение параметра =0,67. Тогда величина давления Р, определённая по Z-диаграмме, составит: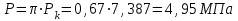 . .Сравним полученное расчётное значение с экспериментально определённой величиной давления Рэксп: 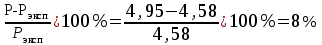 В данном случае расхождение составляет 8%, что является не вполне приемлемым с точки зрения практики современных инженерных расчётов. Вывод: таким образом, данный расчёт показывает, что при заданных условиях углекислый газ рассматривать как идеальный газ недопустимо, поскольку имеет место очень существенное расхождение расчётной величины давления с экспериментально установленным значением. В расчетах использованы справочные данные (рис. 1) и Z-диаграмма для области газа (рис.2). 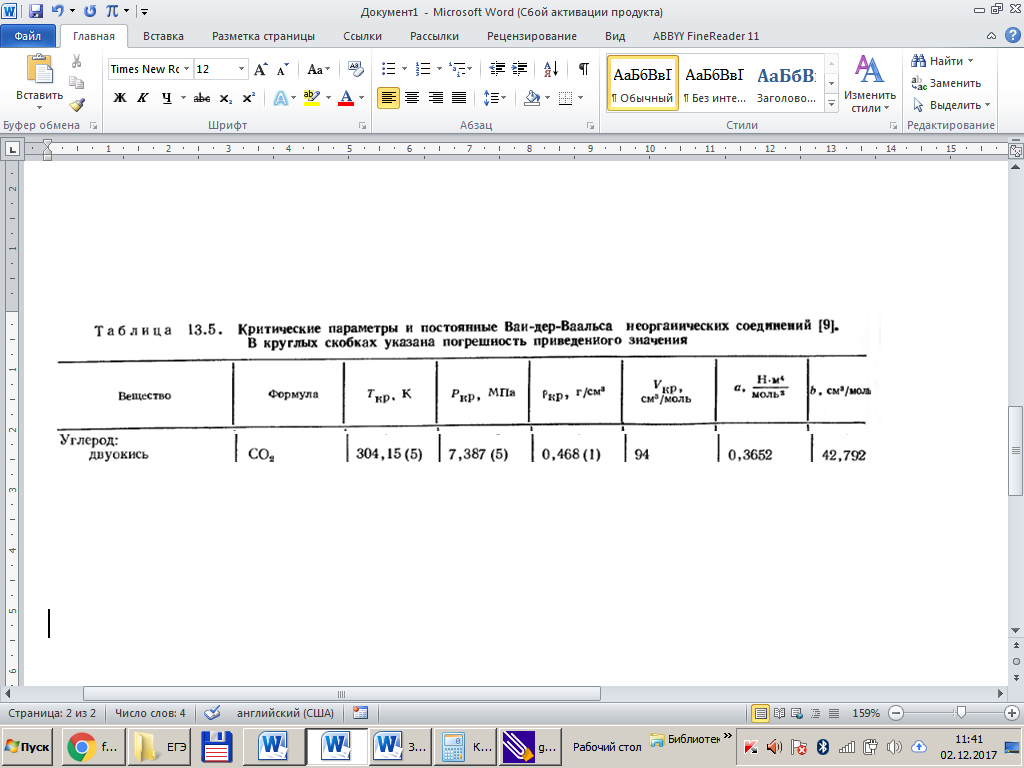 Рисунок 1. Справочные величины 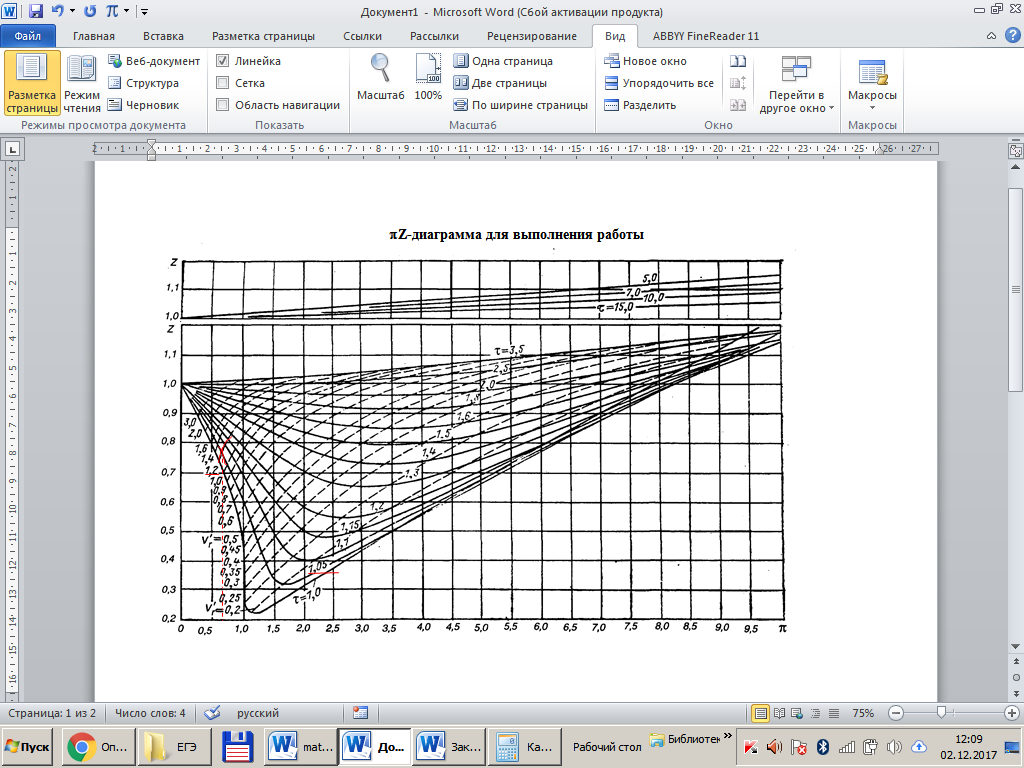 Рисунок 2. Z-диаграмма для области газа Список использованной и рекомендованной литературы 1. Луканин, В.Н. Теплотехника: Учебник для вузов / Луканин В.Н., М.Г. Шатров, Г.М. Камфер [и др.] - М.: Высшая школа, 2005. 2. Физические величины - справочник. / Под. ред. И.С. Григорьева, Е.З. Мейлихова. - М.: Энергоатомиздат, 1991. 3. Краткий справочник физико-химических величин. / Под. ред. А.А. Равделя. - Л.: Химия, 1991. 4. Кудинов, В.А. Техническая термодинамика: Учебное пособие для вузов / Кудинов В.А., Карташов Э.М. - М.: Высшая школа, 2005. 5. Юдаев, Б.Н. Техническая термодинамика. - М.: Высшая школа, 1988. |
