Физ химия рк 2. Тест 13 неделя 1 Для слабых электролитов степень диссоциации
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
|
Тест 13 неделя 1)Для слабых электролитов степень диссоциации a<1 2)Степень диссоциации- это отношение эквивалентной электропроводности и предельной электропроводности 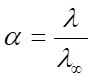 Для слабых электролитов 3)Как изменяется эквивалентная электропроводность сильных и слабых электролитов при разбавлении растворов Увеличивается При разбавлении раствора эквивалентная электропроводность как. сильных, так и слабых электролитов возрастает: для слабых электролитов. – вследствие увеличения степени диссоциации α, для сильных – в. результате повышения абсолютной скорости движения ионов. 4)Первый закон Кольрауша распространен на более концентрированные растворы сильных электролитов 5)Эквивалентная электропроводность водного раствора электролита максимальна В его насыщенном растворе 6)Какой ток используют в мостике Кольрауша Переменный 7)Для расчета чего используют постоянную кондуктометрической ячейки Удельная электропроводность   8)Преимущество кондуктометрического метода Можно исследовать окрашенные и мутные растворы 9)Степенью диссоциации называют Отношение числа молекул, диссоциирующихна ионы ,к общему числу молекул растворенного электролита 10)При повышении концентрации удельная электропроводность Увеличивается ,потом уменьшается С увеличением концентрации удельная электропроводность сильных электролитов сначала возрастает, а затем может понижаться, что приводит к появлению максимума удельной электропроводности. 11)Метод определения различных физико-химических величин на основе измерения удельной электрической проводимости при заданной температуре Прямая кондуктометрия 12)Кондуктометрия основана на Измерении электропроводности 13)Вспомогательным методом при измерениях электропроводности Косвенная кондуктометрия 14)Электролиты подразделяют на Сильные ,средние , слабые 15)Константа диссоциации слабого электролита зависит от Природы электролита и от температуры онстанта диссоциации зависит от природы электролита и от температуры, но не зависят от концентрации слабого электролита в растворе. 16) Размерность числа Фарадея КЛ/МОЛЬ 17)Индикатором в кондуктометрическом титровании является Электропроводность 18)Какова единица измерения удельной электропроводности в системе си См*м-1 В системе СИ удельная электропроводность измеряется в сименсах на метр (См/м) или в Ом−1·м−1 19)Коэффициент электропроводности- это отношение эквивалентной электропроводности и предельной электропроводности Для сильных электролитов  20)Электрическая проводимость электролита Скорости движения электролитов в растворе Так как электропроводность электролитов обусловлена перемещением ионов в растворе, то величина удельной электропроводности зависит при неизменной валентности ионов и скорости их движения, еще и от температуры. 21)Электролиты-это Проводники второго рода 22)Симменс –это Ом-1 23)Метод, основанный на измерениях электропроводности как вспомогательного метода Косвенная кондуктометрия 24)Какова единица измерения молярной электропроводности в системе СИ См*м^2*моль-1 25)В кондуктометрическом титровании ТЭ находят по графику, построенному в координатах Удельная электропроводность- объем титранта 26)Наименьшей частицей растворенного вещества в растворах электролитов является Ион 27)Электрическая проводимость электролита в сильно разбавленном растворе; 28)Эквивалентная электропроводность растворов электролитов с ростом разбавления раствора Увеличивается Эквивалентная электропроводность растворов электролитов возрастает с ростом разбавления раствора и при бесконечном разбавлении (т.е. при бесконечно малой концентрации) достигает предельного значения 0. 29)Зависит от квадратного корня концентрации Линейно 30)Для раствора сильного электролита при определении предельной эквивалентной электропроводности закон Кольрауша имеет вид  31)Чем больше константа диссоциации, тем Быстрее распадаются на ионы при растворенном виде 32)Константу кондуктометрической ячейки определяют по формуле K=I*S 33)Кондуктометрическим методом определяют Нет правильного ответа 34)Электролитом называется Электропроводное вещество 35)Для раствора сильного электролита, диссоциирующегося на два однозарядных иона уравнение закона независимости движения ионов Кольрауша имеет вид  36)Второй закон Кольрауша пригоден для концентраций 0-0,003г/экв*л 37)При бесконечном разведении эквивалентная электропроводность водного раствора равна Сумме предельных подвижностей иона 38)Кондуктометрическим титрованием можно анализировать Любые растворы электролитов 39)Примерами сильных электролитов (в водных растворах) являются NaOH .KCL 40)Что называется удельной электрической проводимостью раствора электролита Ұесли она выражена в СМ*М-1) ЭЛЕКТРОПРОВОДНОСТЬ СТОЛБИКА РАСТВОРА, ЗАКОБЧЕННОГО МЕЖДУ ЭЛЕКТРОДАМИ НА РАССТОЯНИИ 1М И ПЛОЩАДЬЮ 1М2 электропроводность объема раствора электролита, заключенного между двумя параллельными электродами площадью в 1 м2 на расстоянии 1 м. Тест 11 неделя 1)По мере увеличения количества молекул, участвующих в реакции ,квантовый выход Увеличивается 2)Какая стадия соответствует гетерогенному процессу Мтв+Nж=Dтв+Eж Диффузионный перенос N через слой твердого продукта D. Скорость определяется законами внутренней диффузии. Диффузия – это процесс проникновения молекул одного вещества между молекулами другого вещества. Основная причина диффузии: постоянное движение молекул. Стадии гетерогенных реакций Атв+Вж=Ств+Кж 1. Диффузия В к поверхности А. Скорость процесса определяется законами внешней диффузии 2. Химическая реакция между А и В, образование новых продуктов С и К. Скорость определяется законами химической кинетики. 3. Диффузионный перенос В через слой твердого продукта С. Скорость определяется законами внутренней диффузии. 3)Для гетерогенных реакций происходит образование продукта реакции На границе раздела фаз 4)Фотохимические реакци возникают под действием лучей Поглощается исходными веществами 5) Какая стадия соответствует гетерогенному процессу Мтв+Nж=Dтв+Eж Диффузия N на поверхности вещества D.Скорость процесса определяется законами внутренней диффузии 6)Скорость во времени Уменьшается 7)Основное кинетическое уравнение фотохимических реакций  8)Процесс протекает в кинетическом режиме, если лимитирующая стадия Химическая реакция 9)Градиент концентрации Отрицательный 10)Если гетерогенная химическая реакция, возникающая в растворе, протекает в кинетической области, то процесс можно перенести в зону диффузии следующим образом При постоянной температуре ,увеличение интенсивности перемешивания либо при повышении температуры 11)Скорость процесса зависит от природы твердой фазы Зависит скорость процесса зависит от природы твердой фазы и удельной поверхности А. Чем больше А, тем больше скорость гетерогенного процесса. 12)Молекула может распадаться на радикалы или прореагировать с другими молекулами 2 стадия (фотохим) 13)Чем больше удельная поверхность, тем Выше скорость гетерогенного процесса 14)Удельная скорость растворения твердой фазы определяется по уравнению Щукарева 15)Как формулируется второй закон фотохимии каждый квант света активизирует только одну молекулу 16)Закон фика определяется В диффузионном режиме 17)Какая стадия фотохимических реакций, протекающих с высоко скоростью, при которой электроны могут быстро переходить на более высокий энергетический уровень 1стадия фотохим 18)Расчеты константы скорости гетерогенной реакции определяется уравнением Щукареыв-Доливо-Добровольского 19)Молекулы переходят в активное состояние При поглощении кванта излучения 20)Уравнение имеет место   ОТВЕТ Если с1, n=1, тогда   Если с1, n=0, тогда  21)Лимитирующими могут быть Стадии, определяемые законами внешней диффузии 22)Гетерогенная химическая реакция, в стадию которой входит диффузия, протекает в диффузионной зоне, если Скорость химической реакции больше стадии диффузии при заданной температуре 23)Скорость внешней диффузии во времени Линейная зависимость 24)Скорость химической реакции Выше скорсоти диффузии 25)Какая стадия соответствует гетерогенному процессу Мтв+Nж=Dтв+Eж Химическая реакция между M и N, образование новых продуктов Dтв+Eж. Скорость определяется законами химической кинетики 26)Практический квантовый выход Больше или меньше единицы 27)Скорость внутренней диффузии во времени Уменьшаяется 28)Поглощенная энергия Превращается в теплоту 29)Теоретический квантовый выход Равен единице 30)Химическая реакция в гетерогенном процессе- это Лимитирующая стадия 31)Фотохимические реакции, протекающие под действием свободных радикалов Лучи 32)Скорость света 3*10^8 8 33)Реакции с длиной волны, протекающей под действием излучения, близкой к видимому свету Фотохимические 34)Квант света активирует одну или несколько молекул 2 закон фотохими 35)Укажите основные условия протекания фотохимической реакции Излучение с длиной волны которого близка к видимому свету (=200700 нм). 36)Квант энергии больше пороговой энергии 1 закон фотохимии 37)Концентрация реагента в зависимости от диффузионного потока Уменьшается 38)Энергия распада молекулы под действием поглощенного света Квант света 39)Поскольку энергия излучения, поглощаемая молекулами в исходных реакциях0 очень велика, как на нее влияет повышение температуры Увеличивается энергия При повышении температуры увеличивается запас внутренней энергии молекул. 40)Скорость процесса от температуры Слабо зависит Тест 10 неделя 1)Реакция B-C-D относится к Последовательной 2)Основное уравнение Аррениуса  3)Если в системе происходят последовательные реакции, то концентрация вещества максимальна во времени: tmax=lnK2-LnK1/K1-K2 4)Реакции, котороые возможны в случае протекания других реакций, если в системе происходит одновременно несколько реакций Гетерогенные 5)Предложил теорию активного столкновения Льюис 1918 6)Реакции, состоящие из нескольких стадий, следующих друг за другом, называются Последовательными 7)Вещество, играющее роль катализатора в некоторых реакциях Индукторы 8)Дифференциальное уравнение аррениуса  9)Дифференциальное кинетическое уравнение обратимой реакции первого порядка  10)Явление, при котором самопроизвольная система состоит из протекающих химических реакций, вызывающих проеткание других химических реакцций в одной и той же системе, реализуемые при отсутсвии первой Химическая индукция 11)Интегральное уравнение Аррениуса  12)Определеный запас кинетической и потенциальной энергий имеют Активные столкновения 13)Принцип детального равновесия- В момент равновесия скорость прямой реакции равна скорости обратной 14)В кинетике последовательных реакций определить скорость общую Нельзя 15)Укажите тримолекулярную реакцию (считайте что указанное уравнение является элементарной стадией) 2NO+O2=2NO2 16)Что такое лимитирующая стадия Самая медленная стадия реакции при ступенчатом протекании реакции 17)Процесс при котором концентрация индуктора не изменится Катализ 18)Концентрация промежуточного продукта В в последовательных реакциях Проходит через максимум С течением времени концентрация реагента А снижается. Концентрация промежуточного продукта С вначале увеличивается, достигает своего максимального значения, затем убывает. Концентрация продукта D увеличивается по мере протекания реакции. Величина максимальной концентрации продукта С зависит от соотношения скоростей каждой из последовательных стадий. 19)С точки зрения теории активного столкновения: Скорость химических реакций прямопорпорциональна количеству активных столкновний 20)Реакции, протекающих одновременно в двух противоположных направлениях Обратимые 21)Концентрация конечного продукта С в последовательных реакциях Возрастает 22)Укажите выражение, определяющее прямой порядок реакции аА+Bb=Mm+Nn n=a+b 23)Если скорость обратной реакции неизмеримо меньше скорости прямой реакции, то такая реакция Кинетически необратима 24)Зависимость концентрации реагентов и продукта реакции от времени при параллельных реакциях К1>k2 25)Для раздельного определения констант скоростей обратимой реакции К1 и К2 провести реакцию сначала только в прямом направлении для определения k1, а затем только в обратном – для определения k–1; 26)Скорость образования продукта реакции в последовательных реакциях dCc/dt по времени Снижается 27)Теория активного столкновения применяется Для бимолеклярных реакций 28)Вещество, которое не является самостоятельным катализатором, но повышает его активность при добавлении к катализатору Промотор 29)Правило вант гоффа  30)Какая из приведенных реакций относится к последовательным C18+H32=C6H12O6+C12H22O11= 31)По теории активного комплекса образуется Образуется промежуточный активированный комплекс 32)Реакции, в которых протекает несколько простых реакций, скорости которых независимы друг от друга Сложные 33)Принцип независимости Любая реакция сложного состава протекает независимо и к ней применяется основной постулат хим кинетики 34)Интегральное кинетическое уравнение обратимой реакции первого порядка выглядит следующим образом К1+к2=  35)Параллельные реакции Реакции, когда исходные вещества одновременно учасвтуют в двух или нескольких реакциях с образованием разных продуктов реакции 36)Принцип лимитирующей стадии Общая скорость процесса определяется скоростью самой медленной реакции, которая называется лимитирующая 37)Укажите бимолекулярную стадию H2+i2=2hi 38) 39)Применима только к бимолекулярным реакциям Теория активных столкноввений 40)В теории активного сопротивления частицы рассматриваются в виде Круглых шаров Тест 9 неделя 1)Зависимость константы скорости реакции от температуры показывает выражение  2)Что такое скорость химической реакции Изменение концентрации реагирующих веществ в единицу времени 3)Как изменится скорость реакции при увеличении температуры, если коэффициент реакции =3 25-45 Увеличится в 9 раз  Делта Т=45-25=20 20/10=2 3^2=9 4)При увеличении концентрации кислорода в два раза скорость реаакции С+О2=СО2 С (тв) + О₂ (г) = СО₂ (г) + Q В2 раза реакция идет в гетерогенной системе, в формуле скорости учитывается концентрация газообразного кислорода (но, в случае измельчения углерода и увеличения площади реакционной поверхности возрастет и скорость реакции) v₀=k[O₂] v=2k[O₂] .   5)Для реакции Aa+Bb+Cc=Mm+Nn Порядок прямой реакции равен А+б+с 6)Как изменится скорость реакции при увеличении температуры на 50 градусов если температурный коэффициент =2 Увеличится в 32 раща 50/10=5 2^5=32 7)Какое уравнение определяет зависимость скорости химической реакции от температуры Уравнение аррениуса 8)Определите порядок реакции, если выражение для скорости имеет вид  9)Какая энергия зависит от природы реагирующих веществ Энергия активации 10)Какие экспериментальные данные необходимые для определения порядка реакции данные об изменении концентрации реагирующих веществ во времени при постоянной температуре 11)Для реакции 2co+o2=2co2 W=kC^2co*Co2 12)При увеличении давления в зоне реакции в 3 раза скорость реакции 2СО+О2=СО2 Скорость прямой реакции пропорциональна первой степени парциального давления кислорода, квадрату парциального давления угарного газа, значит при увеличении давления в 3 раза скорость увеличится в 3^3=27 раз. 13)Каков физический смысл константы скорости химической реакции При равенстве концентраций реагирующих веществ константа скорости гомогенной химической реакции равна скорости реакции 14)Значение константы скорости реакции известно. Каков порядок реакции К=0,8 (моль/л)-1*с-1 0  15)Какое уравнение прямой реакции соответствует закону реагирующих масс А+В+В=АВ^2 W=K[A][B]^2 16)Что такое молекулярность реакции Указывает колиество молекул, участвующих в элементарной стадии (акте) хим реакции 17)Какой знак имеет величина скорости реакции +, если выражена через изменение концентрации продуктов реакции ,и – если выражена через изменение концентрации исходных веществ 18)Для реакции какого порядка единица измерения скорости реакции и константы реакции одинакова Нулевой 19)Для реакции Aa+Bb+cC=Mm+nN порядок обратной реакции равен М+н 20)При увеличении концентрации реагирующих веществ в 2 раза скорость реакции 2со+о2=2со2 хуй знает Увеличится в 8 р 21) Молекулярность химической реакции Всегда целое число 22)Скорость химической реакции Прямо пропорционально концентрации химических веществ 23)Выражение w=-dC / dt означает Истинная Скорость химической реакции определяемая по изменению концентрации реагирующих веществ (v= - dC/dt) или по изменению концентрации продуктов реакции (v= dC/dt), 24)Какова размерность константы скорости химической реакции для нулевого порядка Концентрация 1 , время -1 25)При увеличении концентрации СО в 2 раза скорость реакции 2со+о2=2со2 Ответ : увеличится в 4 раза.  Формула : υ(р-ции) = k * C(CO)^2 * C(O2)^1. Следует υ / υ(р-ции) = (k * (2 * C(CO))^2 * C(O2)^1) / (k * C(CO)^2 * C(O2)^1) = 4. 26)В каких случаях константа скорости химической реакции А+В+С равна скорости реакции (W=K) При равных концентрациях Са=Сб=1 Константа скорости химической реакции (k) представляет собой скорость химической реакции в условиях, когда произведение концентраций реагирующих веществ равно 1 моль/л. В этом случае v = k. 27)Если температурный коэффициент реакции = 3, тогда при понижении температуры на 40 градусов скорость реакции Уменьшится в 81 раз 28)Как читается правило Вант-Гоффа о температурной зависимости скорости реакции Повышение температуры на каждые 10 градусов увеличивает скорость гомогенных реакций в 2-4 раза 29)Механизм химической реакции Говорит о совокупности стадий химической реакции 30)Принимает ли порядок нулевое число, дробные значения, отрицательные значения Порядок реакции принимает произвольные значчния 31)Как формулируется основной постулат химической кинетики Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ различной степени 32)Какое уравнение описывает скорость реакции W=k[no2][o2] 33)КАК Количественно выражаются концентрации реагирующих веществ в скорости химическо реакции здм 34)Константа скорости реакции зависит от Температуры 35)Определите порядок реакции, если выражение для скорости имеет вид W=[M]2*[N]^-1/2 2+(-1/2)=2-0.5=1.5 36)Какие уравнения выражают реакцию второго порядка W=k*c^2 37)Определите порядок реакции, если выражение для скорости имеет вид W=[M]-2*[N]^+1/2 -2+1/2=-1,5 38)Авторы закона взаимодействующих масс Гульберг Вааге 39) Выражение w=dC / dt означает Истинная Скорость химической реакции определяемая по изменению концентрации продуктов реакции (v= dC/dt), 40)Графическая зависимость взаимодействующих веществ в единицу времени называется Кинетическая кривая |
