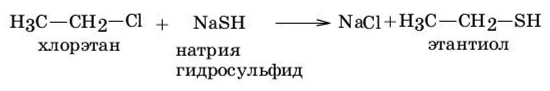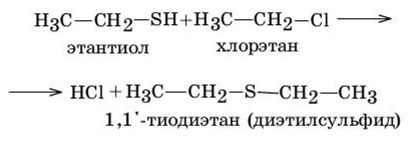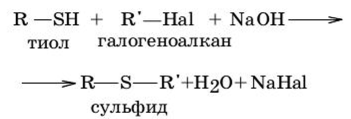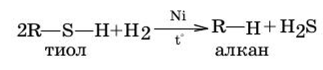|
|
Тиолы как химическая основа инкапаситирующих композиций и методы их анализа.. Тиолы как химическая основа инкапаситирующих композиций и методы. Тиолы как химическая основа инкапаситирующих композиций и методы их анализа
Тиолы как химическая основа инкапаситирующих композиций и методы их анализа.
Физико-химические свойства, способы получения и токсикологическая характеристика тиолов.
Тио́лы (меркапта́ны) — сернистые аналоги спиртов общей формулы RSH, где R — углеводородный радикал, например, метантиол (метилмеркаптан) (CH3SH), этантиол (этилмеркаптан) (C2H5SH) и т. д., в терминологии IUPAC название «меркаптаны» признано устаревшим и не рекомендуется к использованию.
Нахождение в природе
Меркаптаны образуются при гниении белков и обладают резким
отвратительным запахом (гнилой капусты), ощутимым при ничтожно малых
концентрациях меркаптанов в воздухе.
Обычно меркаптаны обнаруживают вместе с другими соединениями,
например в воздухе промыслов и заводов по добыче и переработке сернистой
нефти, в сланцеперерабатывающих цехах (очистка от серы), на химических
предприятиях (производство вискозы, меркаптофоса, содержащих серу
инсектофунгицидов, пластических масс, синтетического каучука, резинита) и
др.
Метил- и этилмеркаптаны содержатся в природных газах,
высокомолекулярные тиолы – в бензиновой и керосиновой фракциях нефтей и конденсатов.
Аминокислота цистеин HSCH2CHCOOH, содержащая меркаптогруппу,
входит в состав многих белков. Окисление цистеина с образованием
дисульфидных мостиков в ходе посттрансляционной модификации белков
является важнейшим фактором при формировании их третичной структуры,
высокая механическая прочность кератинов обусловлена в том числе и высокой степенью сшитости за счет образования большого количества дисульфидных мостиков: так, например, содержание цистеина в кератине волоса человека составляет приблизительно 14 %.
Трипептид глутатион, в состав которого также входит цистеин, является
коферментом глутатионпероксидаз и играет важную роль в окислительновосстановительных процессах в живых организмах.
Также существенное биологическое значение имеет метаболическое
нитрозирование тиолов: глутатион и цистеиновые остатки белков при
взаимодействии в активными формами азота образуют S-нитрозопроизводные, которые являются физиологическим депо оксида азота.
Физические свойства
Тиолы по свойствам довольно существенно отличаются от спиртов.
Температуры кипения тиолов ниже температур кипения соответствующих
спиртов (табл. 1), что связано с меньшей электроотрицательностью серы по
сравнению с кислородом, вследствие чего тиолы менее склонны образовывать водородные связи.
Тиолы малорастворимы в воде, но хорошо растворяются в этаноле, диэтиловом эфире и других органических растворителях.
Малая величина энергии диссоциации связи S-H способствует расщеплению S-H по свободнорадикальному механизму. 9 Угол между связями в молекулах H2S и тиолов очень близок к прямому. Это говорит о том, что связь S-H образована главным образом за счет р-орбиталей. Этим объясняется ее меньшая прочность по сравнению со связью C-H, которая образуется за счет sp a -гибридизированной орбитали.
Отличаются тиолы и запахом, причем не только от спиртов, но и от всех других соединений. Меркаптаны, особенно низшие, отвратительно пахнут даже в ничтожных количествах – они могут быть обнаружены в концентрациях до 2•10-9 мг/л: при концентрации этилмеркаптана в 0,00019 мг/л ощущается слабый запах гнилой капусты; резкий запах бутилмеркаптана обнаруживается уже при концентрации 0,0014 мг/л; пороги запаха паров этил-, пропилибутилмеркаптана равняются 0,4·10-4—0,6·10-5 мг/л. Предельно допустимая концентрация этилмеркаптана установлена в 0,001 мг/л.
https://ru.wikipedia.org/wiki/%D0%A2%D0%B8%D0%BE%D0%BB%D1%8B
Тиолы-слабые к-ты, рКа 10-11 (25 °С, вода), кислотность с удлинением и разветвлением алифатич. цепи понижается, при введении электроноакцепторных заместителей повышается. Для замещенных метантиолов RCH2SH значения рКа коррелируют с индукц. константами Тафта s*: рКа = = 10,22 - 3,50s*.
Хим. св-ва тиолов определяются наличием подвижного атома водорода и неподеленных пар электронов у атома S. Для тиолов характерна высокая нуклеофильность в сочетании с относительно низкой основностью. В качестве нуклеофилов тиолы замещают атомы или группы у насьпц. атома углерода, присоединяются к алкенам и алкинам.
Тиолы легко окисляются. При действии О2 в щелочной среде, иода, o-иодбензойной к-ты, алифатич. сульфоксидов, акти-вир. МnО2, Н2О2 и N2О4 образуются дисульфиды RSSR (в присут. металлов-Сu, Со, Ni-p-ция протекает по радикальному механизму); (СН3СОО)4Рb в спирте окисляет тиолы до сульфинатов RSOOCH3, галогены в водной среде-до сульфонилгалогенидов RSO2Hal, НКО3-до сульфокислот RSO3H.
В газовой фазе при 400 °С тиолы разлагаются на H2S и соответствующий олефин.
В пром-сти низшие тиолы получают взаимод. спиртов с H2S в присут. катализаторов при 300-350 °С; трет-алкантиолы C8-C16-взаимод. непредельных углеводородов с H2S в присут. А12О3 при 100-135 °С и давлении 3,5-7 МПа. С 1982 начато пром. выделение низших тиолов из высокосернистого прир. газа.
Низшие тиолы (С2-С3) используют в качестве одорантов топливных газов, для получения пестицидов (напр., пер-хлорметилмеркаптан CCl3SCl); метантиол-для произ-ва метионина; тиолы C8-C16-регуляторы полимеризации в произ-ве латексов, каучуков.
Тиолы, являющиеся ловушками для радикалов, используют для защиты от радиации и как антиокислители, напр. додекантиол—стабилизирующая добавка для каучуков.
Мировое произ-во тиолов 200 тыс. т/год (1986), из них CH3SH более 20 тыс. т/год, тиолов С2-С8 и выше-более 100 тыс. т/год.
https://xumuk.ru/encyklopedia/2/4447.html
Реакционная способность
Тиолами (тиоспиртами, меркаптанами) называют производные углеводородов, у которых атом водорода замещен на тиогруппу -БН: II—БН. Они являются органическими соединениями серы, поскольку содержат в своей структуре связь С-Б.
В международных названиях наличие БН-группы обозначается окончанием -тиол с цифровым указанием местоположения тиогруппы в соответствии с нумерацией родоначальной структуры. При наличии в соединении более старших функциональных групп название тиогруппы обозначается приставкой тио- (по современным правилам — сульфанил-). Применяются также и рациональные названия.
За исключением метантиола (СН3-БН), являющегося газом, тиолы при нормальных условиях представляют собой бесцветные жидкости или (реже) твердые вещества. Вследствие менее эффективного образования межмолекулярных водородных связей жидкие тиолы имеют более низкие температуры кипения по сравнению с соответствующими спиртами. Из-за меньшей полярности молекул хуже спиртов растворяются в воде. Для тиолов характерны неприятный запах и часто высокая токсичность.
СПОСОБЫ ПОЛУЧЕНИЯ ТИОЛОВ
Присоединение Н23 к алкенам (АЕиАк).

про-1-ен пропан-2-тиол

проп-1-ен пропан-2-тиол

Образующиеся тиолы также могут присоединяться к алкенам. Поэтому в качестве побочного продукта в этих реакциях образуются сульфиды:

алкен тиол сульфид

2. Алкилирование солей сероводорода.
Алкилирование возможно галогенопроизводными углеводородов, диалкилсульфатами:

хлорэтан натрия этантиол
гидросульфид
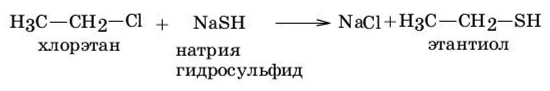
Образующиеся тиолы обладают нуклеофильными свойствами и могут далее алкилироваться с образованием сульфидов, которые будут побочным продуктом данной реакции:

этанол хлорэтан

1,1-тиодиэтан (диэтилсульфид)
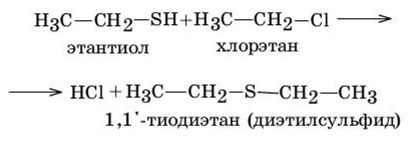
3. Восстановление сульфонилхлоридов.

4. Замена в спиртах гидроксильной группы на БН- группу.
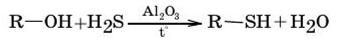
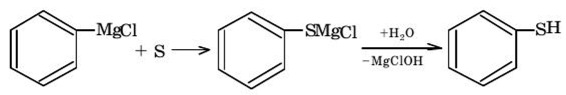
5. Синтез из магнийорганических соединений.
Химические свойства тиолов.
Как и для других органических соединений, химические свойства тиолов обусловлены особенностями их электронного строения. Тиолы по строению схожи со спиртами и имеют аналогичные реакционные центры. Различия в химическом поведении тиолов по сравнению со спиртами определяются различиями атомов в и О: атом серы по сравнению с атомом кислорода имеет больший размер и меньшую электроотрицательность. Поэтому связи С-в и в-Н имеют меньшую прочность, чем связи С-0 и О-Н соответственно.
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ТИОЛОВ
Кислотные свойства у тиолов значительно более выражены, чем у соответствующих их кислородсодержащих аналогов: спиртов и фенолов. Обусловлено это большей поляризуемостью атома в по сравнению с атомом О, что делает тиолат-анион И-Э более стабильным но сравнению с алкоксид-анионом И-О".
Образование тиолятов (меркаптидов).
В отличие от спиртов, подобные соли могут образовываться со щелочами:

Подобные соли с ионами тяжелых металлов (с их оксидами, гидроксидами, солями) очень прочны, практически нерастворимы в воде и не всасываются в желудочно- кишечном тракте. Это определило практическое применение некоторых низкомолекулярных тиолов в качестве антидотов при отравлениях соединениями тяжелых металлов (Н?, В1, Ав):

Основных свойств тиолы, в отличие от спиртов, практически не проявляют.
НУКЛЕОФИЛЬНЫЕ СВОЙСТВА ТИОЛОВ
По сравнению со спиртами нуклеофильные свойства у тиолов более выражены, что делает тиолы активными нуклеофильными реагентами, способными вступать в различные реакции нуклеофильного замещения и присоединения.
1. Реакция алкилирования тиолов. 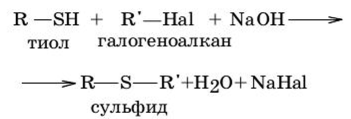
2. Реакция ацилирования тиолов.
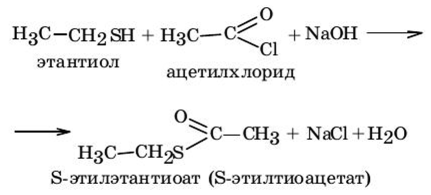
3. Присоединение тиолов к поляризованной кратной связи.
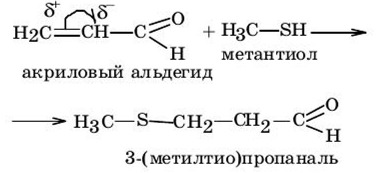
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ ТИОЛОВ
В отличие от спиртов, окисляющихся по замещенному атому углерода, тиолы окисляются по атому Б, что может быть осуществлено в значительно более мягких условиях. Легкость окисления тиолов необходимо учитывать при работе с соединениями, содержащими в своей структуре сульфгидрильную группу. В зависимости от условий могут быть получены различные продукты окисления тиолов.
1. Мягкое окисление тиолов (Н202, СиС12,12, кислород воздуха). 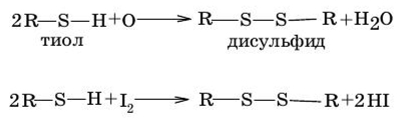
Способность йода окислять тиолы лежит в основе количественного определения тиолов с помощью йодометрического титрования. Образующиеся дисульфиды легко восстанавливаются до исходных тиолов:

Тиол-дисульфидный обмен лежит в основе функционирования ряда биологически значимых соединений (три- пептида глютатиона), важен для структурной организации белковых макромолекул.
2. Жесткое окисление (КМп04, НЖ)3, Н1,11-СОООН).

3. Реакция восстановления тиолов.
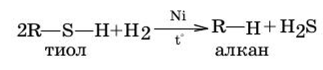
https://ozlib.com/913888/himiya/reaktsionnaya_sposobnost_sulfidov
Методы анализа, применяемые для качественного и колличественного определения тиолов.
1.3 Классификация и характеристика несмертельныйх средств поражения
1.4 Использование тиолов в качестве действующих компонентов инкапаситирующих композиций
Области применения
За счет сильного неприятного запаха тиолы, в частности этантиол,
используются для добавления во вредные газы, не имеющие запаха, для
обнаружения их утечки. Согласно правилам Ростехнадзора, запах этантиола водорированном природном газе появляется при концентрации последнего не более 20 % от нижнего предела взрываемости.
Тиолы применяют в качестве антиоксидантов. Антиоксиданты – тиолы
(меркаптаны), применяемые при многих заболеваниях, в сочетании с
витамином В12 оказывают прооксидантное действие, более того, становятся
токсичными для клеток и тканей. Однако токсический эффект можно
использовать в противоопухолевой терапии. Специалисты лаборатории
тканевой инженерии Института теоретической и экспериментальной биофизики РАН установили, что сочетание тиола и витамина В12 вызывает гибель клеток лимфолейкоза человека.
Лекарственные препараты на основе тиольных соединений: N-
ацетилцистеина и глутатиона, широко применяют в медицине для повышения результативности химио- и радиотерапии и уменьшения их побочных эффектов, при лечении заболевания бронхов и легких, диабета, атеросклероза и катаракты. Тиолы тормозят рост некоторых опухолей и стимулируют работу иммунной системы.
За счет легкого гомолитического разрыва S-H связи с образованием
малоактивных тиильных радикалов тиолы используются как ингибиторы
радикальных цепных реакций, в частности процессов автоокисления и
радикальной полимеризации.
Ртутные производные меркаптана используют для идентификации
меркаптана. Некоторые из сложных природных соединений (тиоловые
соединения), содержащих меркаптогруппу, применяют в качестве антидотов, а также при лечении лучевой болезни.
Токсичное действие меркаптанов
Токсическое действие меркаптана сходно с действием сероводорода. В
ничтожных концентрациях они вызывают головную боль, головокружение,
тошноту; возможны понос, альбуминурия, микрогематурия и цилиндрурия.
Высокие концентрации меркаптанов действуют наркотически. При тяжелых
интоксикациях наблюдаются бессознательное состояние, судороги, параличи, цианоз, парезы бронхиальной мускулатуры, коллапс. Смерть происходит от остановки дыхания.
Применение промышленного фильтрующего противогаза марки А
предохраняет работающих от отравления. Первая помощь и лечение при
отравлениях меркаптанами: немедленный перенос пострадавшего из зоны
отравления на свежий воздух, искусственное дыхание, вдыхание кислорода (с 5 % CO2); инъекции кордиамина, кардиазола, камфоры, лобелина. При
раздражении дыхательных путей — аэрозоль-ингаляции растворов щелочей,
раствора пенициллина (500 000 ЕД в 5 мл 0,5 % раствора новокаина), раствора натриевой соли сульфопиридазина (0,5 г в 5 мл стерилизованной воды).
Биологическая роль
Смесь тиолов содержится в веществе, выделяемом скунсами, а также в продуктах гниения белков.
Аминокислота цистеин HSCH2CH(NH2)COOH содержащая меркаптогруппу, входит в состав многих белков, окисление цистеина с образованием дисульфидных мостиков в ходе посттрансляционной модификации белков является важнейшим фактором при формировании их третичной структуры, высокая механическая прочность кератинов обусловлена, в том числе, и высокой степенью сшитости за счёт образования большого количества дисульфидных мостиков: так, например, содержание цистеина в кератине волоса человека, составляет 14 %.
Трипептид глутатион, в состав которого также входит цистеин, является коферментом глутатионпероксидаз и играет важную роль в окислительно-восстановительных процессах в живых организмах.
Также существенное биологическое значение имеет метаболическое нитрозирование тиолов: глутатион и цистеиновые остатки белков при взаимодействии с активными формами азота образуют S-нитрозопроизводные, которые являются физиологическим депо оксида азота.
Применение
За счёт сильного неприятного запаха тиолы, в частности, этантиол, используются для добавления во вредные газы, не имеющие запаха, для обнаружения утечки. Согласно правилам Ростехнадзора, запах этантиола в одорированном природном газе появляется при концентрации последнего не более 20 % (об.) от нижнего предела взрываемости.
За счёт лёгкого гомолитического разрыва RS-H связи с образованием малоактивных тиильных радикалов тиолы используются как ингибиторы радикальных реакций.
https://ru.wikipedia.org/wiki/%D0%A2%D0%B8%D0%BE%D0%BB%D1%8B
Тиолы-слабые к-ты, рКа 10-11 (25 °С, вода), кислотность с удлинением и разветвлением алифатич. цепи понижается, при введении электроноакцепторных заместителей повышается. Для замещенных метантиолов RCH2SH значения рКа коррелируют с индукц. константами Тафта s*: рКа = = 10,22 - 3,50s*.
Хим. св-ва тиолов определяются наличием подвижного атома водорода и неподеленных пар электронов у атома S. Для тиолов характерна высокая нуклеофильность в сочетании с относительно низкой основностью. В качестве нуклеофилов тиолы замещают атомы или группы у насьпц. атома углерода, присоединяются к алкенам и алкинам.
Тиолы легко окисляются. При действии О2 в щелочной среде, иода, o-иодбензойной к-ты, алифатич. сульфоксидов, акти-вир. МnО2, Н2О2 и N2О4 образуются дисульфиды RSSR (в присут. металлов-Сu, Со, Ni-p-ция протекает по радикальному механизму); (СН3СОО)4Рb в спирте окисляет тиолы до сульфинатов RSOOCH3, галогены в водной среде-до сульфонилгалогенидов RSO2Hal, НКО3-до сульфокислот RSO3H.
В газовой фазе при 400 °С тиолы разлагаются на H2S и соответствующий олефин.
В пром-сти низшие тиолы получают взаимод. спиртов с H2S в присут. катализаторов при 300-350 °С; трет-алкантиолы C8-C16-взаимод. непредельных углеводородов с H2S в присут. А12О3 при 100-135 °С и давлении 3,5-7 МПа. С 1982 начато пром. выделение низших тиолов из высокосернистого прир. газа.
Низшие тиолы (С2-С3) используют в качестве одорантов топливных газов, для получения пестицидов (напр., пер-хлорметилмеркаптан CCl3SCl); метантиол-для произ-ва метионина; тиолы C8-C16-регуляторы полимеризации в произ-ве латексов, каучуков.
Тиолы, являющиеся ловушками для радикалов, используют для защиты от радиации и как антиокислители, напр. додекантиол—стабилизирующая добавка для каучуков.
Мировое произ-во тиолов 200 тыс. т/год (1986), из них CH3SH более 20 тыс. т/год, тиолов С2-С8 и выше-более 100 тыс. т/год. |
|
|
 Скачать 298.26 Kb.
Скачать 298.26 Kb.