Коллоидная химия. Удельная поверхность S
 Скачать 1.28 Mb. Скачать 1.28 Mb.
|
|
Коллоидная химия – наука, изучающая физико-химические свойства гетерогенных высокодисперсных систем и ВМВ в твердом состоянии и в растворах. Коллоидные растворы – многокомпонентные микрогетерогенные системы, состоящие из дисперсной фазы (растворенного вещества) и дисперсионной среды (растворителя). Совокупность мельчайших частиц называется дисперсной фазой, а вещество, в котором происходит распределение дисперсной фазы – дисперсионной средой. 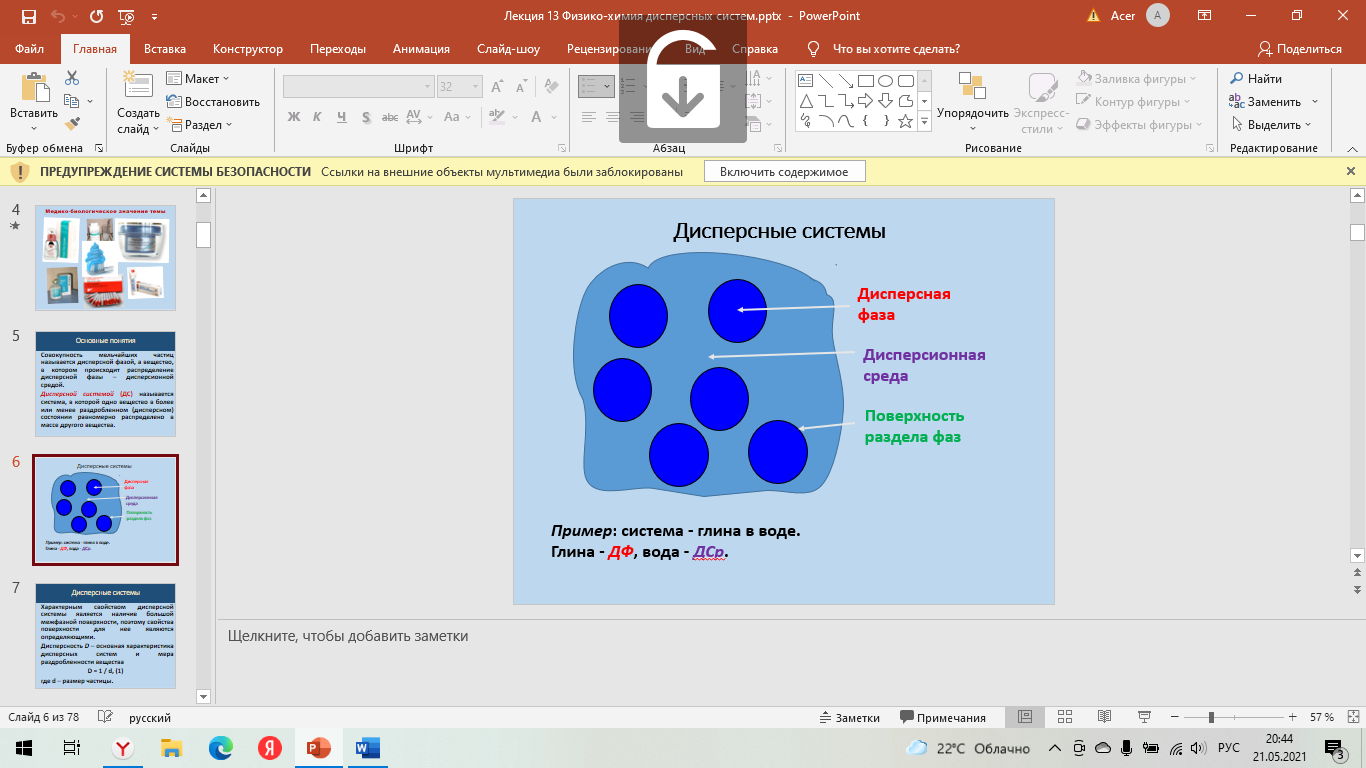 Дисперсной системой (ДС) называется система, в которой одно вещество в более или менее раздробленном (дисперсном) состоянии равномерно распределено в массе другого вещества. Дисперсной системой (ДС) называется система, в которой одно вещество в более или менее раздробленном (дисперсном) состоянии равномерно распределено в массе другого вещества.Дисперсность D – основная характеристика дисперсных систем и мера раздробленности вещества: D = 1 / d, где d – размер частицы. Удельная поверхность Sуд – характеристика степени раздробленности в расчете на единицу объема дисперсной фазы (V) или её массы (m): Sуд = S / V; Sуд = S / m. С повышением дисперсности (раздробленности) системы Syд. резко возрастает. Классификация дисперсных систем. В основе существующих классификаций лежат различные свойства дисперсных систем. Наиболее распространена классификация дисперсных систем по следующим признакам: - По размеру частиц дисперсной фазы (степени дисперсности); - По агрегатному состоянию дисперсной фазы и дисперсионной среды; - По степени взаимодействия дисперсной фазы с дисперсионной средой; - По наличию взаимодействия между частицами дисперсной фазы. Классификация систем по степени дисперсности
Классификация дисперсных систем по агрегатным состояниям
По степени взаимодействия дисперсной фазы с дисперсионной средой
Строение мицеллы Для получения мицеллы лиофобных коллоидов необходимы условия: разбавленные растворы; избыток стабилизатора Рассмотрим механизм получения коллоидного раствора системы на примере образования золя иодида серебра: AgNO3 + KI ––> AgI + KNO3 Если для реакции взять эквивалентные количества обоих веществ, то получается грубодисперсная система и AgI выпадает в осадок. Если один из реагентов, например, AgNO3, взять в избытке, то дисперсная фаза AgI образуется в виде мельчайших зародышей, которые образуют агрегат коллоидной частицы (mAgI) На поверхности ядра происходит адсорбция ионов из раствора согласно правилу Фаянса – Пескова - Панета: На поверхности ядра адсорбируются преимущественно: 1) родственные ионы, т.е. те, которые входят в состав ядра и достраивают его кристаллическую решетку; 2) изоморфные ионы, т.е. близкие по размерам к ионам ядра. 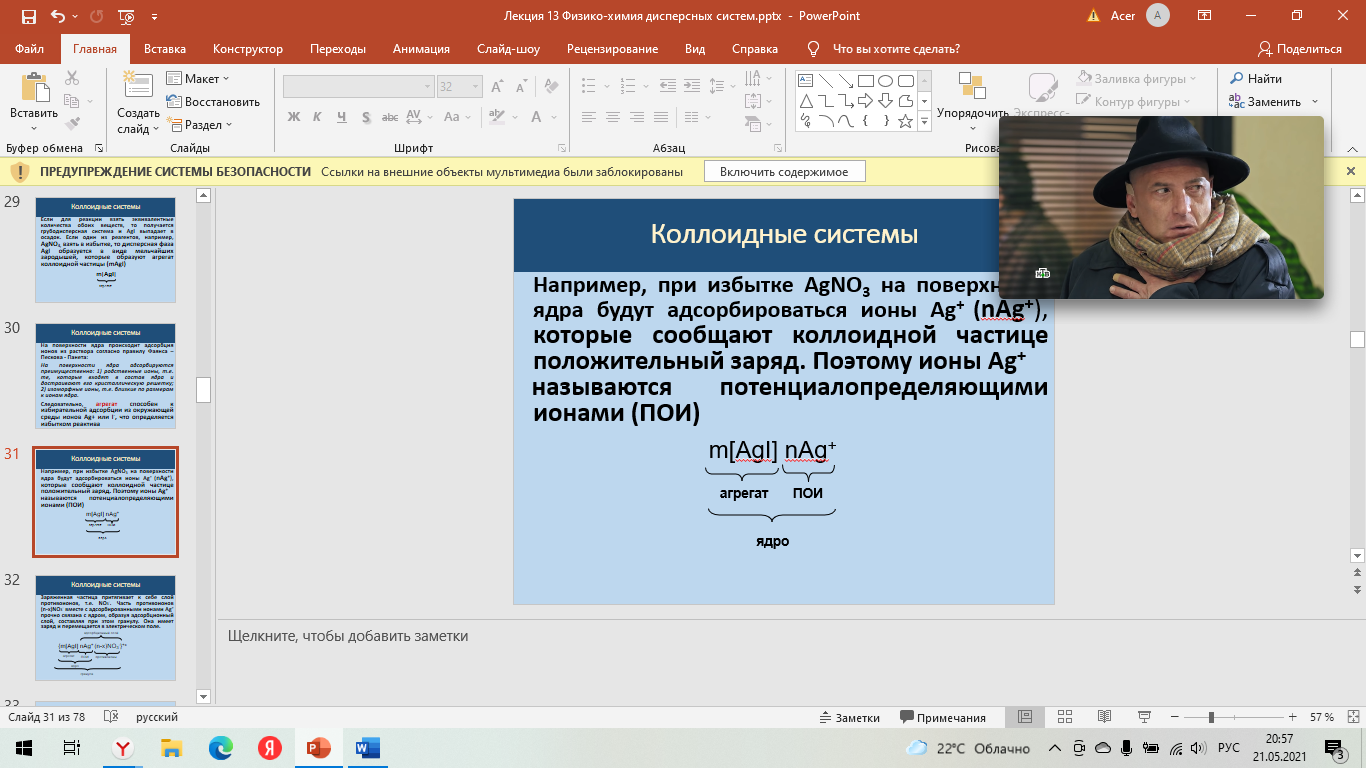 Следовательно, агрегат способен к избирательной адсорбции из окружающей среды ионов Ag+ или I-, что определяется избытком реактива: при избытке AgNO3 на поверхности ядра будут адсорбироваться ионы Ag+ (nAg+), которые сообщают коллоидной частице положительный заряд. Поэтому ионы Ag+ Следовательно, агрегат способен к избирательной адсорбции из окружающей среды ионов Ag+ или I-, что определяется избытком реактива: при избытке AgNO3 на поверхности ядра будут адсорбироваться ионы Ag+ (nAg+), которые сообщают коллоидной частице положительный заряд. Поэтому ионы Ag+ 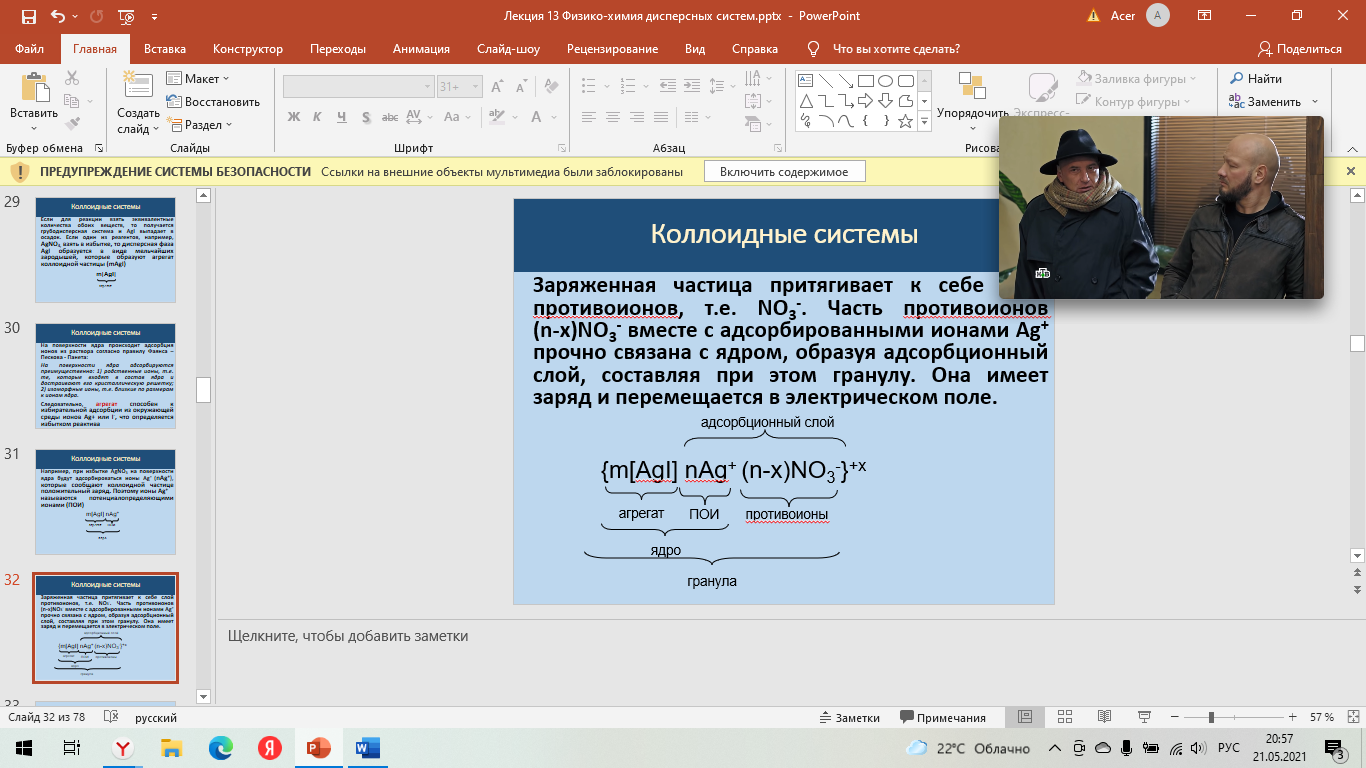 называются потенциалопределяющими ионами (ПОИ) называются потенциалопределяющими ионами (ПОИ)Заряженная частица притягивает к себе слой противоионов, т.е. NO3-. Часть противоионов (n-x)NO3- вместе с адсорбированными ионами Ag+ прочно связана с ядром, образуя адсорбционный слой, составляя при этом гранулу. Она имеет заряд и перемещается в электрическом поле. 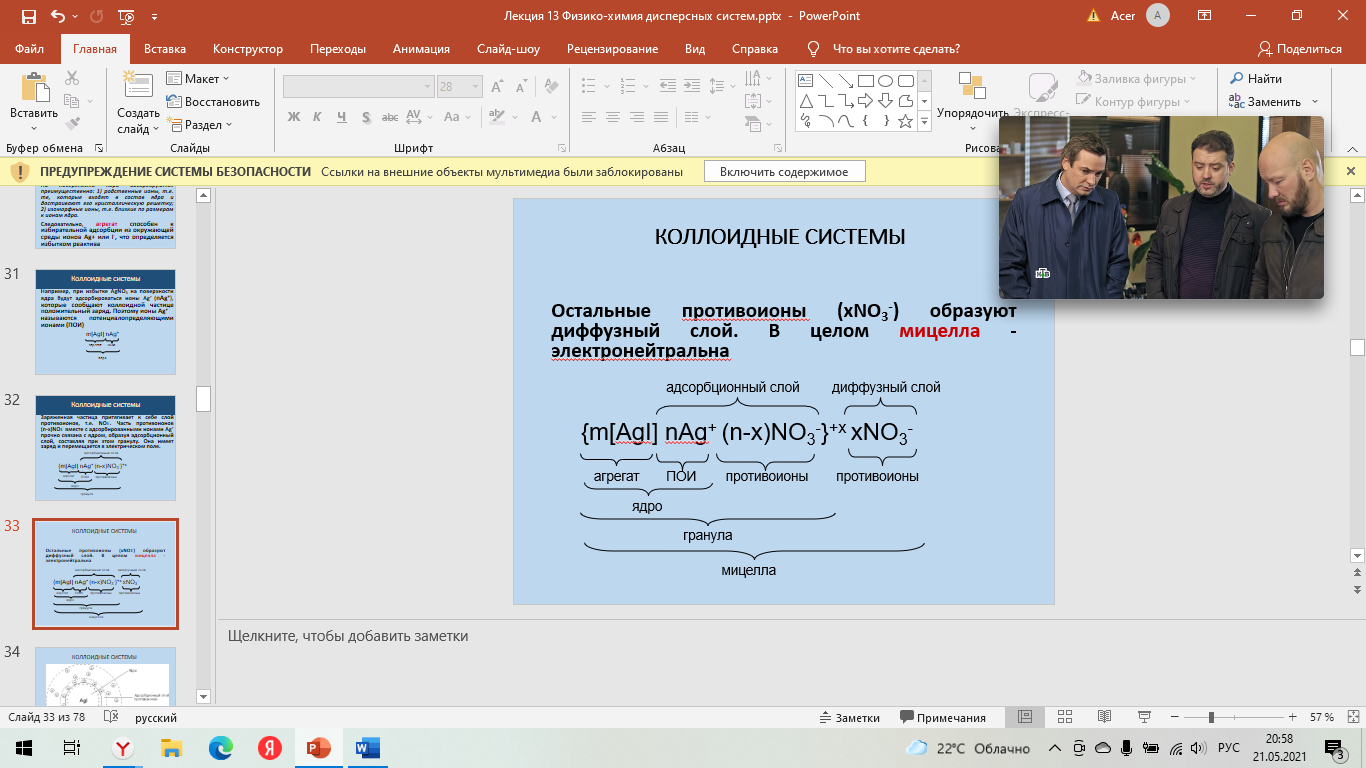 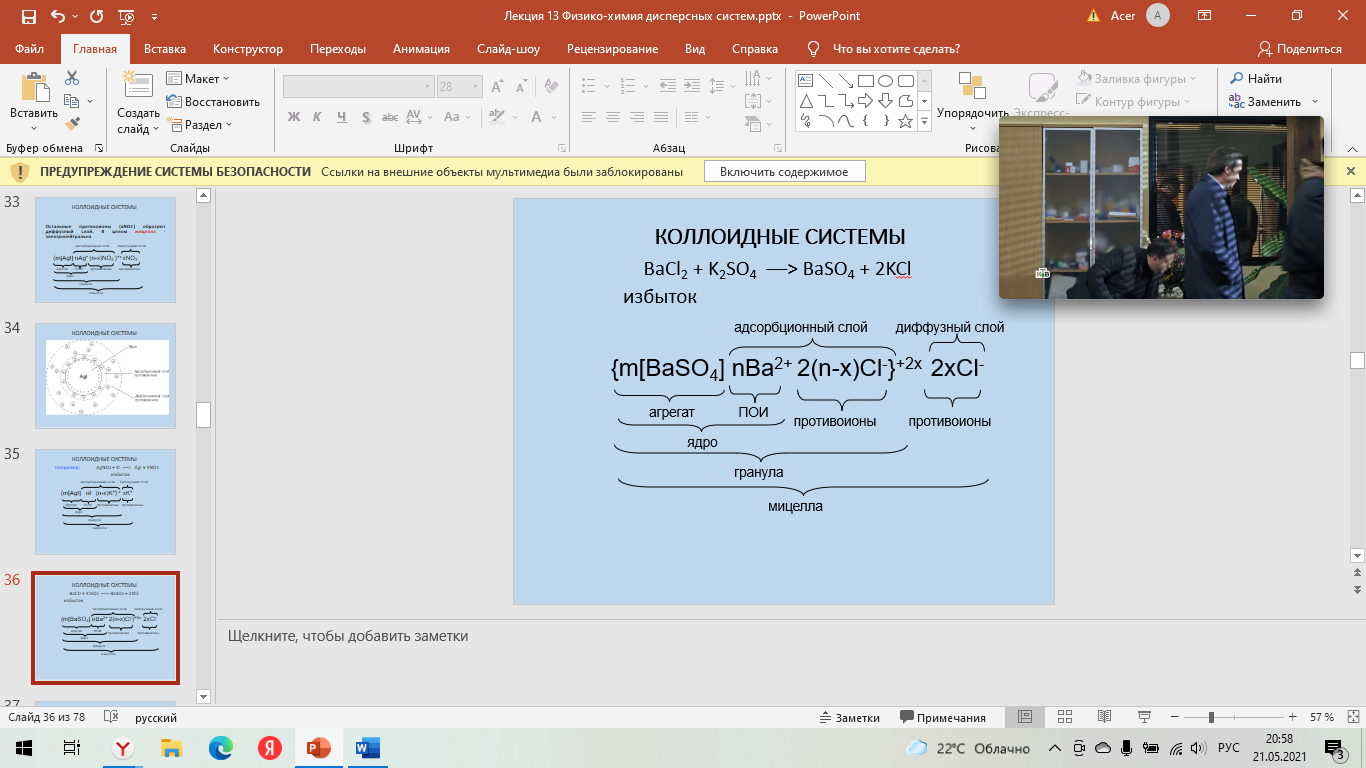 Остальные противоионы (xNO3-) образуют диффузный слой. В целом мицелла - электронейтральна Остальные противоионы (xNO3-) образуют диффузный слой. В целом мицелла - электронейтральнаЗоль – бесструктурный коллоидный раствор, в котором частицы ДФ слабо взаимодействуют между собой и свободно передвигаются друг относительно друга (например, золь серебра – колларгол). По внешнему виду золи напоминают истинные растворы. Гель – структурированный коллоидный раствор, в котором частицы ДФ связаны между собой в пространственные структуры типа каркасов. Для коагуляции золей электролитами установлен ряд эмпирических закономерностей. 1. Для начала коагуляции золя необходима некоторая минимальная концентрация электролита, называемая порогом коагуляции γ. Величина, обратная порогу коагуляции, называется коагулирующей способностью электролита: В = 1/ γ. 2. Коагулирующим действием обладает тот из ионов электролита, заряд которого противоположен заряду коллоидных частиц, причем коагулирующее действие иона тем сильнее, чем больше его заряд (правило Шульце – Гарди или правило значности). Величины порогов коагуляции двухзарядных ионов примерно на порядок, а трехзарядных – на два порядка меньше, чем для однозарядных ионов. 3. В рядах неорганических ионов с одинаковыми зарядами коагулирующее действие возрастает с уменьшением гидратируемости ионов; например, в ряду однозарядных катионов щелочных металлов коагулирующее действие возрастает от лития к рубидию: γ (Li+) > γ (Na+) > γ (К+) > γ (Rb+) Ряды, в которые сгруппированы по возрастанию либо по убыванию коагулирующего действия ионы с одинаковым зарядом, называют лиотропными рядами. 4. В осадках, получаемых при коагуляции золей электролитами, всегда присутствуют ионы, вызвавшие коагуляцию. 5. При коагуляции золей смесями электролитов сравнительно редко наблюдается их независимое (аддитивное) действие; обычно имеет место взаимное усиление либо ослабление коагулирующего действия (синергизм либо антагонизм ионов). 6. Коагуляция может происходить при смешении двух золей (взаимная коагуляция) 7. Можно коагуляцию предотвратить, т.е. повысить устойчивость золя введением так называемых защитных веществ. Добавление их к золю перед введением электролита приводит к увеличению порога коагуляции электролита. | |||||||||||||||||||||||||||||||||||||||||||||||
