аллотропы углерода. 17.Аллотропы углерода. Углерод химический элемент, обозначающийся буквой C
 Скачать 382.78 Kb. Скачать 382.78 Kb.
|
|
Углерод — химический элемент, обозначающийся буквой C и имеющий атомный номер 6. Элемент является четырехвалентным неметаллом, т. е. имеет четыре свободных электрона для формирования ковалентных химических связей. Аллотропия — существование двух и более простых веществ одного и того же химического элемента. Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы). Способность элемента к образованию аллотропных форм обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов. ГРАФИТ Графит – обладает sp2-гибридизацей. Каждый атом образует по 3 ковалентных связи с соседними атомами под углом 120° – образуется плоская сетка, состоящая из правильных шестиугольников, в вершинах которых находятся атомы С. Графит имеет слоистое строение. свойствах графита отмечается сильная межатомная связь в каждом слое и слабая связь между слоями. 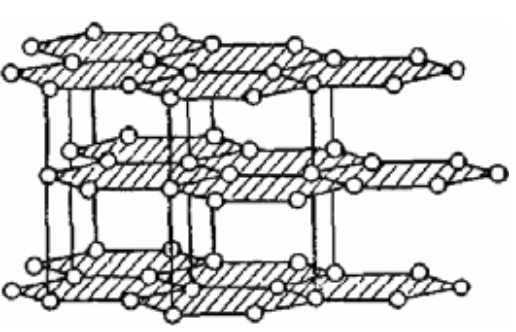 АЛМАЗ Кристалл алмаза имеет кубическую симметрию. Такая структура отвечает максимальной ковалентности связи, и все 4 электрона каждого атома углерода образуют высокопрочные связи С–С, т.е. в структуре отсутствуют электроны проводимости. Ячейка алмаза представляет собой объемноцентрированное тетраэдрическое расположение атомов, в котором любой атом углерода занимает центр тетраэдра. типичного валентного кристалла. Других связей, кроме ковалентных, в алмазе нет. 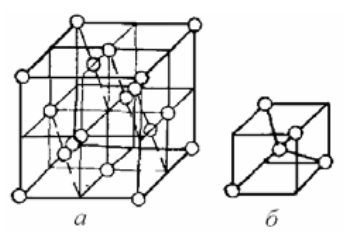 КАРБИН Карбин — аллотропная форма углерода на основе sp-гибридизации углеродных атомов Карбин представляет собой мелкокристаллический порошок чёрного цвета, обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу. Карбин — линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно либо тройными и одинарными связями (полиеновое строение), либо постоянно двойными связями (поликумуленовое строение).   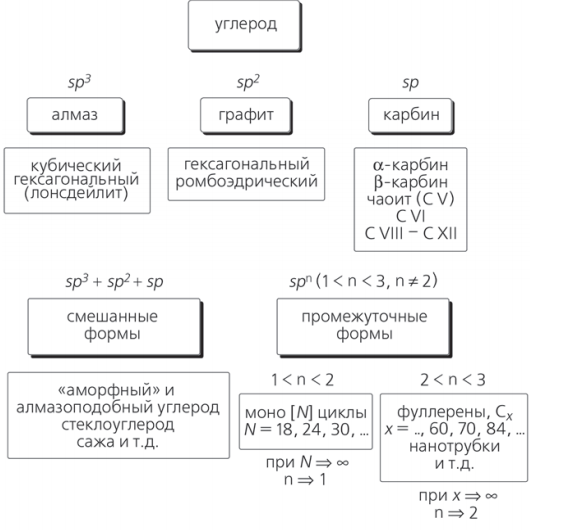 Графен — двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом. Атомы углерода находятся в sp²-гибридизации и соединены в гексагональную двумерную кристаллическую решётку. Его можно представить как одну плоскость слоистого графита, отделённую от объёмного кристалла. Применение графена По оценкам, графен обладает большой механической жёсткостью и рекордно большой теплопроводностью. Высокая подвижность носителей заряда, которая оказывается максимальной среди всех известных материалов (при той же толщине), делает его перспективным материалом для использования в самых различных приложениях, в частности, как будущую основу наноэлектроники и возможную замену кремния в интегральных микросхемах. При помощи графена можно сделать эластичные, дешёвые и прозрачные солнечные элементы, превращающие практически любую поверхность в источник электроэнергии. Экспериментов с графеном проводится масса. Потенциал этого материала невероятно широк. ВОЗМОЖНО через несколько лет графен будет использоваться в создании и различных детекторов света, и контактных линз, и вообще чего угодно. Практическое применение этого материала может ограничиваться лишь фантазией учёных ВЫВОД Аллотропные модификации углерода по своим свойствам наиболее радикально отличаются друг от друга, от мягкого к твёрдому, непрозрачного к прозрачному, недорогого к дорогому. Углерод может являться одновременно диа- и парамагнетиком; диэлектриком, полупроводником и металлом; теплоизолятором и одним из лучших проводником тепла. Применяются аллотропические модификации углерода в силу своих свойств практически во всех сферах деятельности человека.Столь уникальные свойства — причина того, что и чистый углерод, и содержащие его материалы служат объектами фундаментальных исследований и применяются в бесчисленных технических процессах. |
