Опорный конспект №2. Углеводороды, их производные, свойства этих соединений и их взаимопревращения
 Скачать 45.12 Kb. Скачать 45.12 Kb.
|
|
Органическая химия – химия соединений углерода. Органическая химия – наука, изучающая углеводороды, их производные, свойства этих соединений и их взаимопревращения. Углеводороды – это органические соединения, состоящие из двух элементов - углерода и водорода. Особенности органических веществ: В составе - углерод и водород. Горючи – при горении образуется вода и углекислый газ. Большая молекулярная масса. Все вещества можно расположить в гомологические ряды. Характерна изомерия. Гомологи – вещества сходные по строению и свойствам, но отличающиеся друг от друга на одну или несколько групп атомов - CH2. CH2 - гомологическая разность. Гомологический ряд – ряд гомологов. Изомеры – вещества, имеющие одинаковую молекулярную формулу, но различное химическое строение и обладающие, поэтому разными свойства. Причина многообразия органических веществ: Способность атомов углерода многократно соединяться между собой, при этом образуются различные углеродные цепи: 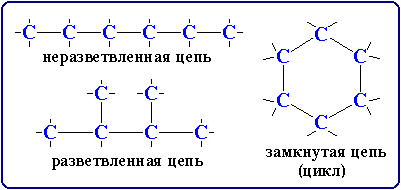 Строение атома углерода. Электронное облако - пространство вокруг ядра, в котором есть вероятность нахождения электрона. Орбиталь – пространство вокруг ядра, в котором заключено 90% электронного облака. s-орбиталь- электронное облако в форме шара. p-орбиталь- электронное облако в форме объёмной восьмерки. Валентность - способность атома присоединять или замещать определенное число других атомов с образованием химической связи. Ковалентная химическая связь - возникает за счет перекрывания электронных облаков с образованием общей электронной пары. π –связь(пи – связь) - это связь, которая образуется в результате перекрывания орбиталей вне линии соединяющей ядра двух атомов. σ-связь(сигма-связь) - это связь, которая образуется в результате перекрывания орбиталей вдоль линии соединяющей ядра двух атомов. σ-связь π –связь 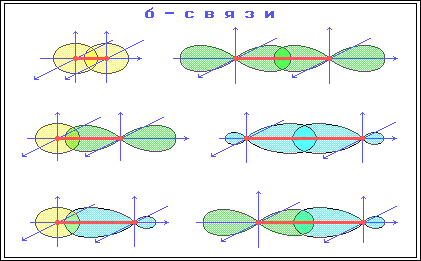 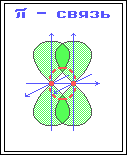 Валентный угол – угол между гибридными облаками. Длина связи – среднее расстояние между двумя ядрами атомов (измеряется в нанометрах – 1нм=10-9м) Химическая связь тем прочнее, чем меньше её длина. Энергия связи – количество энергии, которую необходимо затратить для разрыва химической связи в молекуле. Энергия связи указывает на прочность молекулы. Энергия σ-связи – 350 кДж Энергия π -связи – 270 кДж Состав и строение этана, этена, этина.
Запомните: Простая (одинарная связь) – это всегда σ-связь. Двойная связь – это одна σ-связь и одна π- связь. Тройная связь - это одна σ-связь и две π- связи. Общие формулы углеводородов: СnH2n+2 –алканы (все связи одинарные) СnH2n –алкены (одна двойная, остальные одинарные) СnH2n –циклоалканы (цикл с одинарными связями) СnH2n -2 –циклоалкены (цикл с одной двойной связью) СnH2n -2 –алкадиены (две двойные, остальные одинарные) СnH2n -2 –алкины (одна тройная, остальные одинарные) СnH2n-6 –арены (цикл из шести атомов углерода с чередующимися двойными и одинарными связями)  Запомни cуффиксы:  одинарная связь - ан двойная связь - ен две двойных - диен тройная связь - ин преффикс (приставка): цикл - цикло корень: С1 - мет С2 - эт С3 - проп С4 - бут С5 - пент С6 - гекс С7 - гепт С8 - окт С9 - нон С10 - дек CH3 – CH2 – CH3 - пропан CH2 = CH – CH3 - пропен CH2 = C = CH2 - пропадиен СH 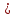 C – CH3 - пропин C – CH3 - пропин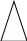 - циклопропан ИЗОМЕРИЯ 1. Изомерия углеродного скелета (для всех углеводородов) 2. Изомерия положения кратной связи (для непредельных) 3. Цис-транс-изомерия (для алкенов) 4. Межклассовая изомерия (алкены и циклоалканы; алкины, алкадиены и циклоакены) |
