урок№1химия 9 кл. Урок химии в 9 классе Тема урока Окислительно восстановительные реакции. Цели
 Скачать 42.49 Kb. Скачать 42.49 Kb.
|
|
Урок химии в 9 классе Тема урока «Окислительно- восстановительные реакции». Цели: Обучающие: познакомить учащихся с новой классификацией химических реакций по признаку изменения степеней окисления элементов- с окислительно-восстановительными реакциями(ОВР). Сформировать понятие об окислительно - восстановительных реакциях, как химических реакциях по признаку изменения степени окисления элементов. Дать понятия «Окислитель» и «восстановитель». Охарактеризовать единство и неразрывность процессов окисления и восстановления, научить учащихся расставлять коэффициенты методом электронного баланса. Развивающие: продолжить формирование умений составлять уравнения химических реакций. Способствовать расширению кругозора обучающихся, развитию умений и навыков применения полученных знаний для объяснения явлений окружающего мира. Продолжить развитие логического мышления, умений анализировать и сравнивать. Совершенствовать практические умения и навыки работы с лабораторным оборудованием и химическими реактивами; дополнить знания учащихся о правилах работы в химическом кабинете. Развивать умение наблюдать, делать выводы. Воспитательные: способствовать формированию культуры межличностного общения на примере умения слушать друг друга, задавать вопросы друг другу, анализировать ответы товарищей, прогнозировать результат работы, оценивать свою работу. Формировать научное мировоззрение учащихся, совершенствовать трудовые навыки. Тип урока: изучение нового материала. Дидактические цели: создать условия для осознания и осмысления блока новой учебной информации. Форма урока: урок - дискуссия с элементами проблемного обучения. Методы обучения: объяснительно - иллюстративный, проблемный, частично - поисковый. Ход урока Организационный момент. Путешествие в прошлое: Учитель: В III веке до н.э. на острове Родос был построен памятник в виде огромной статуи Гелиоса (у греков Бог Солнца).Грандиозный замысел и совершенство исполнения Колосса Родосского – одного из чудес света- поражали всех, кто его видел.(показ колосса на слайде).Мы не знаем точно, как выглядела статуя, но известно, что она была сделана из бронзы и достигла в высоту около 33 м. Статуя была создана скульптором Харетом, на ее строительство ушло 12 лет. Бронзовая оболочка крепилась к железному каркасу. Полую статую начали строить снизу и, по мере того как она росла, заполняли камнями, чтобы сделать ее устойчивее .Примерно через 50 лет после завершения строительства Колосс рухнул. Во время землетрясения он переломился на уровне колен. Ученые считают причиной недолговечности этого чуда стала коррозия металла, а основе процесса коррозии лежат окислительно- восстановительные реакции. Запишите в тетради тему урока: «Окислительно - восстановительные реакции». Итак, сегодня на уроке мы с вами познакомимся с окислительно - восстановительными реакциями и выясним, в чём отличие обменных реакций от окислительно - восстановительных реакций. Научимся определять в реакциях окислитель и восстановитель. Научимся составлять схемы процессов отдачи и принятия электронов. Актуализация знаний. Для начала, давайте вспомним , что такое степень окисления и как определяется степень окисления в простых и сложных веществах. Степень окисления- это условный заряд атома в соединении. Степень окисления совпадает с валентностью, но в отличие от валентности степень окисления бывает отрицательной. Правила определения степеней окисления: 1. У свободных атомов и у простых веществ степень окисления равна 0: Na, H2, N2, S, Al, F2. 2. Металлы во всех соединениях имеют положительную степень окисления (ее максимальное значение равно номеру группы): а) у металлов главной подгруппы I группы +1; б) у металлов главной подгруппы II группы +2; в) у алюминия +3. 3. В соединениях кислород имеет степень окисления -2 (исключение O+2F2 и пероксиды: H2O2-1; K2O2-1). 4. В соединениях с неметаллами у водорода степень окисления +1, а с металлами -1. 5. В соединениях сумма степеней окисления всех атомов равна 0. H+1Cl-1 H2+1S-2 H2+1S+6O4-2 +1 - 1 = 0 (2 · 1) - 2 = 0 (1 · 2) + 6 - (2 · 4) = 0 Изучение новой темы. В 8 классе вы познакомились с реакциями соединения, разложения, замещения и обмена. В основу этой классификации химических реакций положены число и состав исходных и образующихся веществ. Рассмотрим химические реакции с точки зрения окисления (отдачи электронов) и восстановления (присоединения электронов) атомов элементов. Над знаками химических элементов проставим их степени окисления. 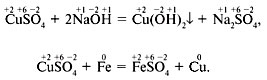 Изменились ли степени окисления элементов в этих реакциях? В первом уравнении степени окисления элементов не изменились, а во втором изменились – у меди и железа. Вторая реакция относится к окислительно-восстановительным. Реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ и продуктов реакции, называют окислительно-восстановительными реакциями (ОВР). В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов называется окисление.    H20 - 2ē 2H+ 2Br - - 2ē Br20 S-2 - 2ē S0 H20 - 2ē 2H+ 2Br - - 2ē Br20 S-2 - 2ē S0Процесс присоединения электронов называется восстановление:    Mn+4 + 2ē Mn+2 S0 + 2ē S-2 Cr+6 +3ē Cr+3 Mn+4 + 2ē Mn+2 S0 + 2ē S-2 Cr+6 +3ē Cr+3Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны - восстановителями. Составление уравнений окислительно-восстановительных реакций. Существуют два метода составления окислительно - восстановительных реакций - метод электронного баланса и метод полуреакций. Здесь мы рассмотрим метод электронногобаланса. В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Рассмотрим этот метод на примере. Алгоритм составления уравнений ОВР методом электронного баланса: Составить схему реакции. Al + HCl → AlCl3+ H2 Определить степени окисления элементов в реагентах и продуктах реакции. Al0 + H+1Cl-1 → Al+3Cl3-1 + H20 Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов. Эта реакция является ОВР Подчеркнуть элементы, степени, окисления которых изменяются. Al0 + H+1Cl-1 → Al+3Cl3-1 + H20 Определить, какой элемент окисляется, (его степень окисления повышается) и какой элемент восстанавливается (его степень окисления понижается), в процессе реакции. Al0 → Al+3 окисляется H+1→ H20 восстанавливается В левой части схемы обозначить с помощью стрелок процесс окисления (смещение электронов от атома элемента) и процесс восстановления (смещение электронов к атому элемента) Al0 – 3 ē → Al+3 процесс окисление 2H+1 + 2 ē → H20 процесс восстановление Определить восстановитель и окислитель. Al0 – 3 ē → Al+3 восстановитель 2H+1+ 2 ē → H20 окислитель Сбалансировать число электронов между окислителем и восстановителем.
Определить коэффициенты для окислителя и восстановителя, продуктов окисления и восстановления.
Расставить коэффициенты перед формулами окислителя и восстановителя. 2Al +6 HCl → 2AlCl3 + 3H2 Проверить уравнение реакции. Посчитаем количество атомов справа и слева, если их будет равное количество – уравнение мы уравняли. Закрепление. №1. Определите степень окисления атомов химических элементов по формулам их соединений: H2S, O2, NH3, HNO3, Fe, K2Cr2O7 №2. Определите, что происходит со степенью окисления серы при следующих переходах: H2S → SO2 → SO3 №3. Расставьте коэффициенты в УХР методом электронного баланса, укажите процессы окисления (восстановления), окислитель (восстановитель); запишите реакции в полном и ионном виде: А) Zn + HCl = H2+ ZnCl2 Б) Fe + CuSO4 = FeSO4 + Cu №4. Даны схемы уравнений реакций: СuS + HNO3(разбавленная) = Cu(NO3)2 + S + NO + H2O K + H2O = KOH + H2 Расставьте коэффициенты в реакциях используя метод электронного баланса. Укажите вещество - окислитель и вещество - восстановитель. Домашнее задание: п 1, упр.1, 6 стр 7. |
