моносахориды. моносахариды 10 кл. Урок по органической химии. Урок химии в 10 классе Тема урока Глюкоза, ее строение и свойства
 Скачать 122.5 Kb. Скачать 122.5 Kb.
|
|
Углеводы. Моносахариды. Глюкоза. Урок по органической химии. Урок химии в 10 классе Тема урока: « Глюкоза, ее строение и свойства ». Урок проводится по технологии деятельностного обучения с использованием эвристического, объяснительно-иллюстративного и экспериментального методов обучения. Системно- деятельностная технология обучения в химии является одной из актуальных методик развития учащихся. Поэтому на уроках очень важны способы организации самостоятельной, поисково-исследовательской деятельности учащихся. Но результативна она лишь тогда, когда обучающиеся обладают достаточными знаниями, необходимыми для построения научных предположений, а также умением выдвигать гипотезы, объясняющие противоречие, причины явлений. Правильно поставленная система деятельностного обучения позволяет рациональными педагогическими средствами целенаправленно развивать познавательную самостоятельность и творческие способности учащихся, т. к. в процессе обучения активно приобретаются не только конкретные знания по предмету, но и знания о средствах их наиболее эффективного усвоения и применения. Давно известно, что знания, добытые собственным трудом, намного прочнее и ценнее, чем знания, предложенные учителем в готовом виде. Урок построен так, чтобы обеспечить формирование познавательного интереса учащихся, продемонстрировать красоту процесса познания, почувствовать радость от результатов проведенных опытов, создать положительное эмоциональное отношение к учебе. Роль учителя при этом в том, что он - организатор этого взаимодействия, он управляет процессом познания. На уроке активно используется компьютерная среда (презентация темы, иллюстрации, задания для самообучения). Назначение этих материалов в обеспечении большей наглядности и доказательности. При составлении урока уделено внимание здоровью учащихся. В урок включены эмоциональные разрядки, игровые моменты, смена видов деятельности. Снять утомление позволяет двигательная активность, организация работы в группах. Нравственная атмосфера урока предполагает психологический комфорт, педагогическое сотрудничество. В качестве девиза можно взять слова Б. Шоу «Единственный путь, ведущий к знанию – это деятельность». Тип урока: Изучение нового материала. Вид урока: проблемно-исследовательский. Цель урока: закрепить знания о кислородсодержащих органических соединениях и их взаимосвязи. Сформировать умение предсказывать строение молекулы вещества исходя из его химических свойств (второе положение теории химического строения органических соединений А.М. Бутлерова). Задачи обучения. О. Закрепить методику решения задач на вывод молекулярной формулы вещества, умение различать и доказывать класс органических соединений по их функциональным группам. Спрогнозировать и опытным путем выявить химические свойства глюкозы как альдегидоспирта. Вывести ее структурные формулы. Записать химические уравнения реакций. В. Воспитать потребность в знаниях о тех веществах, с которыми мы соприкасаемся в жизни. Посредством химического эксперимента прививать навыки трудолюбия, бережного отношения к реактивам, аккуратность, эстетические качества при оформлении конспекта. Р. Развивать умение формировать проблему, определять цель, выдвигать и проверять гипотезу. Умение наблюдать, сравнивать изучаемые явления, выявлять причинно-следственные связи, выделять внутрипредметные и межпредметные связи. Делать выводы, развивать доказательную речь, используя химическую терминологию. Развивать коммуникативные компетентности учащихся. Методы обучения: проблемно-исследовательский, объяснительно-иллюстративный. Формы обучения: фронтальная беседа, практическая работа, обобщение. Принципы обучения: систематичность и последовательность формирования знаний, умений и навыков, самостоятельность. Оборудование урока: 1)Лабораторное оборудование: спиртовка , штатив с пробирками, пробиркодержатель, спички, стеклянные палочки; 2) Реактивы: глюкоза (тв.), раствор 40%, лакмус, раствор нашатырного спирта, нитрата серебра, сульфата меди (II), гидроксида калия или натрия, вода, уксусная кислота, карбонат натрия, фуксинсернистая кислота. 3) Технологическая карта учащегося; конспект-урок (печатная основа для самостоятельной работы учащихся на уроке); тест; презентация; мультимедийный проектор; видеоопыты. Ход урока. Мотивирование к учебной деятельности. Мы продолжаем изучение класса кислородсодержащих органических соединений, который называется - углеводы. Расширяя знания об углеводах, начнем знакомство с моносахаридами, в молекулах которых может содержаться от четырех до десяти атомов углерода. Сегодня мы на 45 минут станем исследователями. У нас работает три экспертные исследовательские группы. Цель – в ходе экспериментальной работы исследовать строение и свойства одного из важнейших углеводов. Оценка работы учащихся на уроке – самооценка – работа с оценочной таблицей. II.Актуализация знаний учащихся. Тест. 1. Расположите вещества в порядке возрастания числа атомов углерода в составе молекулы: А. Сахарозы Б. Глюкозы В. Рибозы ( ВБА ) 2. Тетрозы, пентозы, гексозы – это: А. Дисахариды Б. Моносахариды В. Полисахариды ( Б ) 3. Самый сладкий моносахарид: А. Глюкоза Б. Фруктоза В. Рибоза ( Б ) 4. Какой из моносахаридов содержится в крови человека? А. Рибоза Б. Дезоксирибоза В. Глюкоза Г. Фруктоза ( В ) 5. Углевод, который предотвращает свертывание крови: А. Рибоза Б. Фруктоза В. Гепарин ( В ) III. Определение темы, постановка задач урока. Учитель: Химия—наука, изучающая вещества. На каждом уроке мы наблюдаем, описываем различные вещества, изучаем их свойства. Поэтому и сегодня главным участником нашего занятия будет химическое вещество. Но не любое, а то, формулу которого вы вывели, решая домашнюю задачу к этому уроку: Определите формулу органического соединения, состоящего из углерода (массовая доля 40%), кислорода (массовая доля 53,33%) и водорода (массовая доля 6,67%), если относительная плотность паров этого вещества по воздуху составляет 6,207. Может ли это соединение относиться к классу углеводов? Назовите ответ домашней задачи. С6Н12О6 . Сахароза, рибоза, фруктоза, лактоза- Углеводов всех не счесть. Главная средь них – глюкоза, И о ней пойдет здесь речь. Задание группам: вспомните, чем же глюкоза вам знакома? Работа проходит в форме мозгового штурма (кто больше вспомнит!). Обсуждение результатов работы учащихся. Вопрос: А чем же она нам не знакома? (обсуждение ответов учащихся) Какова тема нашего урока? Что мы с вами должны сегодня сделать на уроке ? Каковы задачи урока? Выяснить строение глюкозы; Предсказать свойства глюкозы, исходя из ее строения; Узнать физические и химические свойства глюкозы; Расширить и систематизировать свои знания об углеводах; Совершенствовать навыки химического эксперимента. Учитель записывает на доске тему урока: «Глюкоза, ее строение и свойства». Какими источниками информации и вспомогательными средствами мы можем воспользоваться на уроке? С чего мы должны начать свою работу? IV. Постановка проблемы: Итак, глюкоза – «знакомая незнакомка», ее эмпирическая формула С6Н12О6.Вопрос: По классификации какое это соединение? А по строению? Если глюкоза - кислородосодержащее соединение, то какие функциональные группы могут содержаться в ее молекуле? Сегодня в ходе нашей исследовательской работы мы и попробуем разгадать все ее тайны. V. Построение проекта выхода из затруднения. Учащиеся выдвигают гипотезу: А) молекула глюкозы может содержать функциональные группы атомов – ОН, одну или несколько. Б) альдегидную группу -СНО В) карбоксильную группу -СООН Учащиеся с помощью учителя согласовывают тему урока, выбирают способ, строят план достижения цели и определяют средства её достижения. Принимается решение проверить гипотезу экспериментально. Учитель напоминает учащимся о соблюдении правил техники безопасности. VI. Решение проблемы. Задание для учащихся всех групп. Исследуйте физические свойства глюкозы. Внимательно рассмотрите выданный вам образец глюкозы. Определите цвет, запах, вкус глюкозы. Исследуйте растворимость ее в воде. Проверьте среду раствора. Для этого опустите индикаторную бумагу в раствор глюкозы. Данные исследования занесите в опорный конспект (печатную основу для самостоятельной работы учащихся) и кратко доложите. Задание 2 для группы №1. Исследуйте принадлежность глюкозы к многоатомным спиртам. В пробирку прилейте 0,5 мл раствора глюкозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). Что наблюдаете? Почему образовавшийся вначале осадок гидроксида меди (II) растворяется с образованием прозрачного синего раствора? Наличием каких функциональных групп в глюкозе обусловлена эта реакция? Напишите уравнения реакций : CuSO Глюкоза (раствор) + Cu(OH) Соблюдайте правила предосторожности при работе с едкими веществами – щелочами. Данные исследования занесите в опорный конспект и кратко доложите. Задание 2 для группы №2. Исследуйте принадлежность глюкозы к альдегидам с помощью реакции «серебряного зеркала».  В пробирку, содержащую 1-2 мл глюкозы, прилейте 1-2 мл аммиачного раствора оксида серебра и осторожно нагрейте пробирку. Что наблюдаете? Наличием какой функциональной группы обусловлена эта реакция? Напишите уравнение реакции: глюкоза (раствор) + Ag В пробирку, содержащую 1-2 мл глюкозы, прилейте 1-2 мл аммиачного раствора оксида серебра и осторожно нагрейте пробирку. Что наблюдаете? Наличием какой функциональной группы обусловлена эта реакция? Напишите уравнение реакции: глюкоза (раствор) + AgНагревая пробирку с жидкостью, держите ее так, чтобы открытый конец ее был направлен в сторону и от самого себя и от соседей. Данные исследования занесите в опорный конспект и кратко доложите. Задание 2 для группы №3. Проведите исследование на наличие в глюкозе альдегидной группы с помощью Cu(OH) В пробирку прилейте 0,5 мл раствора глюкозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). Что наблюдаете? К полученному раствору аккуратно добавьте 1 мл воды и нагрейте на пламени спиртовки пробирку, укрепив ее наклонно так, чтобы нагревалась только верхняя часть раствора ( см. рисунок на стр.304 учебника). Прекратите нагревание, как только начнется изменение цвета. Почему при нагревании происходит изменение цвета реакционной смеси с синего на оранжево- желтый ? Что представляет собой желто-красный осадок? Наличие какой функциональной группы в глюкозе является причиной данной реакции? Напишите уравнение реакции: CuSO  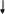 Глюкоза (раствор) + Cu(OH) Глюкоза (раствор) + Cu(OH)Данные исследования занесите в опорный конспект и кратко доложите. Делаем общий вывод: Глюкоза – это альдегид и одновременно многоатомный спирт, т.е. альдегидоспирт ( запись в опорном конспекте ). Запишите структурную формулу глюкозы: А) соедините все шесть атомов углерода последовательно друг с другом; Б) один из крайних атомов углерода образует альдегидную группу; В) к остальным пяти атомам углерода присоедините по одной гидроксогруппе; Г) добавьте к каждому атому углерода недостающие атомы водорода. Теперь, зная строение глюкозы, ее структурную формулу, мы можем спрогнозировать химические свойства глюкозы исходя из ее строения ( свойства многоатомных спиртов – взаимодействие с гидроксидом меди (II), реакции этерификации; свойства альдегидов – окисление ( реакции «серебряного» и «медного» зеркала), реакции присоединения (гидрирование) и особые, специфические, свойства глюкозы, т. к. согласно третьему положению теории химического строения органических соединений А.М. Бутлерова, атомы и группы атомов в молекулах веществ взаимно влияют друг на друга, изменяя свойства вещества в целом). Изучить новый материал предлагаем учащимся самостоятельно. В связи с этим группы учащихся получают следующие задания: Задание 3 для группы №1. Работа с учебником ( стр. 207 – 208 ). Изучите динамическое равновесие в водном растворе глюкозы, а также циклические формы глюкозы. Запишите циклические формы альфа- и бета-глюкозы в опорный конспект. Задание 3 для группы №2. Работа с учебником «Химия 10» ( авторы Рудзитис Г.Е.; Фельдман Ф.Г. ( стр. 135( в таблице) ; стр.134). Изучите нахождение глюкозы в природе и ее специфические свойства ( брожение ). Уравнения соответствующих химических реакций запишите в опорный конспект. Задание 3 для группы №3. Работа с учебником ( стр.206, 210-211 ) , а также с учебником «Химия 10»( авторы Рудзитис Г.Е.; Фельдман Ф.Г.; стр.134 ). Ознакомьтесь с получением глюкозы и ее применением. Уравнения соответствующих химических реакций запишите в опорный конспект. Представитель каждой группы докладывает о выполнении задания. Время выполнения 5 минут. Отчет о результатах выполнения задания. Выступление представителей. VII. Закрепление, контроль знаний. Тест «Проверь себя» При взаимодействии раствора глюкозы с гидроксидом меди (II): А.Образуется ярко-синий раствор Б.Выделяется газ В.Выпадает красно-бурый осадок Г.На стенках пробирки образуется серебряный налет. 2. Продукт каталитического гидрирования глюкозы: А.Ксилит Б.Сорбит В.Глюкозид Г.Динамит. 3. Какой тип брожения углеводов существует? А.Маслянокислое Б.Молочнокислое В.Спиртовое Г.Все предыдущие ответы верны. 4. При спиртовом брожении образуется А.Спирт Б.Спирт, углекислый газ В.Спирт, водород Г.Спирт, углекислый газ, водород. 5. При нагревании раствора глюкозы с аммиачным раствором оксида серебра: А.Образуется ярко-синий раствор Б.Выделяется газ В.Выпадает красно-бурый осадок Г.На стенках пробирки образуется серебряный налет. 6. Чем различаются альфа- и бетта- формы глюкозы? А.Наличием цикла Б.Размером цикла В.Расположением гидроксогруппы при первом атоме углерода Г.Числом атомов кислорода в цикле. 7. Качественной реакцией на глюкозу является реакция с: А.Cu(OH)2 Б.FeCl3 В.Br2 Г.CuO. VIII. Домашнее задание: Параграф 31; вопросы 1,2,3,5,6,8+ тест IX. Подведение итогов. Оцените свой вклад в работу группы, класса, свои достижения. Учащиеся выставляют баллы в оценочные листы и сдают их учителю.
X. Рефлексия. Учитель: -- Какая задача стояла перед вами на уроке? -- Что было сегодня необычного на уроке? -- Есть ли те, кто сделал сегодня маленькое открытие? --Что вы взяли для себя с данного урока? -- Каков результат нашего урока? Учитель комментирует работу групп на уроке, выставляет оценки и заносит их в журнал. ПРИЛОЖЕНИЕ № 1 Технологическая карта Группа №1 Тема урока: «Глюкоза, ее строение и свойства». «Единственный путь, ведущий к знанию – это деятельность» Б. Шоу Задание 1 для группы №1. Исследуйте физические свойства глюкозы. Внимательно рассмотрите выданный вам образец глюкозы. Определите цвет, запах, вкус глюкозы. Исследуйте растворимость ее в воде. Проверьте среду раствора. Для этого опустите индикаторную бумагу в раствор глюкозы. Данные исследования занесите в печатную основу для самостоятельной работы учащихся и кратко доложите. Задание 2 для группы №1. Исследуйте принадлежность глюкозы к многоатомным спиртам. В пробирку прилейте 0,5 мл раствора глюкозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). Что наблюдаете? Почему образовавшийся вначале осадок гидроксида меди (II) растворяется с образованием прозрачного синего раствора? Наличием каких функциональных групп в глюкозе обусловлена эта реакция? Напишите уравнения реакций : CuSO Глюкоза (раствор) + Cu(OH) Соблюдайте правила предосторожности при работе с едкими веществами – щелочами. Данные исследования занесите в опорный конспект и кратко доложите. Задание 3 для группы №1. Работа с учебником ( стр. 207 – 208 ). Изучите динамическое равновесие в водном растворе глюкозы, а также циклические формы глюкозы. Запишите циклические формы альфа- и бета-глюкозы в опорный конспект. 4. Домашнее задание: Параграф 31; вопросы 1,2,3,5,6,8+тест Технологическая карта Группа №2 Тема урока: «Глюкоза, ее строение и свойства». «Единственный путь, ведущий к знанию – это деятельность» Б. Шоу Задание 1 для группы №2. Исследуйте физические свойства глюкозы. Внимательно рассмотрите выданный вам образец глюкозы. Определите цвет, запах, вкус глюкозы. Исследуйте растворимость ее в воде. Проверьте среду раствора. Для этого опустите индикаторную бумагу в раствор глюкозы. Данные исследования занесите в печатную основу для самостоятельной работы учащихся и кратко доложите. Задание для группы №2. Исследуйте принадлежность глюкозы к альдегидам с помощью реакции «серебряного зеркала». В пробирку, содержащую 1-2 мл глюкозы, прилейте 1-2 мл аммиачного раствора оксида серебра и осторожно нагрейте пробирку. Что наблюдаете? Наличием какой функциональной группы обусловлена эта реакция? Напишите уравнение реакции: глюкоза (раствор) + Ag Н  агревая пробирку с жидкостью, держите ее так, чтобы открытый конец ее был направлен в сторону и от самого себя и от соседей. агревая пробирку с жидкостью, держите ее так, чтобы открытый конец ее был направлен в сторону и от самого себя и от соседей.Данные исследования занесите в опорный конспект и кратко доложите. Задание 3 для группы №2. Работа с учебником «Химия 10» ( авторы Рудзитис Г.Е.; Фельдман Ф.Г. ( стр. 135( в таблице) ; стр.134). Изучите нахождение глюкозы в природе и ее специфические свойства ( брожение ). Уравнения соответствующих химических реакций запишите в опорный конспект. 4. Домашнее задание: Параграф 31; вопросы 1,2,3,5,6,8+тест Технологическая карта Группа №3 Тема урока: «Глюкоза, ее строение и свойства». «Единственный путь, ведущий к знанию – это деятельность» Б. Шоу Задание 1 для группы №3. Исследуйте физические свойства глюкозы. Внимательно рассмотрите выданный вам образец глюкозы. Определите цвет, запах, вкус глюкозы. Исследуйте растворимость ее в воде. Проверьте среду раствора. Для этого опустите индикаторную бумагу в раствор глюкозы. Данные исследования занесите в печатную основу для самостоятельной работы учащихся и кратко доложите. Задание 2 для группы №3. Проведите исследование на наличие в глюкозе альдегидной группы с помощью Cu(OH) В пробирку прилейте 0,5 мл раствора глюкозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). Что наблюдаете? К полученному раствору аккуратно добавьте 1 мл воды и нагрейте на пламени спиртовки пробирку, укрепив ее наклонно так , чтобы нагревалась только верхняя часть раствора ( см. рисунок на стр.304 учебника). Прекратите нагревание, как только начнется изменение цвета . Почему при нагревании происходит изменение цвета реакционной смеси с синего на оранжево- желтый? Что представляет собой желто-красный осадок? Наличие какой функциональной группы в глюкозе является причиной данной реакции? Напишите уравнение реакции: CuSO  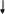 Глюкоза (раствор) + Cu(OH) Глюкоза (раствор) + Cu(OH)Данные исследования занесите в опорный конспект и кратко доложите. Задание 3 для группы №3. Работа с учебником ( стр.206, 210-211 ) , а также с учебником «Химия 10»( авторы Рудзитис Г.Е.; Фельдман Ф.Г.; стр.134 ). Ознакомьтесь с получением глюкозы и ее применением. Уравнения соответствующих химических реакций запишите в опорный конспект. 4. Домашнее задание: Параграф 31; вопросы 1,2,3,5,6,8+тест ПРИЛОЖЕНИЕ № 2 Таблица группового оценивания.
Примечание: Данная таблица должна быть увеличена и зафиксирована на доске. Учитель во время ответов учащихся ставит плюсы группам, согласно критериям; к концу урока определяется группа, набравшая наибольшее количество плюсов. Тест. 1. Расположите вещества в порядке возрастания числа атомов углерода в составе молекулы: А. Сахарозы Б. Глюкозы В. Рибозы 2. Тетрозы, пентозы, гексозы – это: А. Дисахариды Б. Моносахариды В. Полисахариды 3. Самый сладкий моносахарид: А. Глюкоза Б. Фруктоза В. Рибоза 4. Какой из моносахаридов содержится в крови человека? А. Рибоза Б. Дезоксирибоза В. Глюкоза Г. Фруктоза 5. Углевод, который предотвращает свертывание крови: А. Рибоза Б. Фруктоза В. Гепарин Тест При взаимодействии раствора глюкозы с гидроксидом меди (II): А.Образуется ярко-синий раствор Б.Выделяется газ В.Выпадает красно-бурый осадок Г.На стенках пробирки образуется серебряный налет. 2. Продукт каталитического гидрирования глюкозы: А.Ксилит Б.Сорбит В.Глюкозид Г.Динамит. 3. Какой тип брожения углеводов существует? А.Маслянокислое Б.Молочнокислое В.Спиртовое Г.Все предыдущие ответы верны. 4. При спиртовом брожении образуется А.Спирт Б.Спирт, углекислый газ В.Спирт, водород Г.Спирт, углекислый газ, водород. 5. При нагревании раствора глюкозы с аммиачным раствором оксида серебра: А.Образуется ярко-синий раствор Б.Выделяется газ В.Выпадает красно-бурый осадок Г.На стенках пробирки образуется серебряный налет. 6. Чем различаются альфа- и бетта- формы глюкозы? А.Наличием цикла Б.Размером цикла В.Расположением гидроксогруппы при первом атоме углерода Г.Числом атомов кислорода в цикле. 7. Качественной реакцией на глюкозу является реакция с: А.Cu(OH)2 Б.FeCl3 В.Br2 Г.CuO. |
