стандартизация. В чем отличие сертификации от стандартизации Стандартизация
 Скачать 0.87 Mb. Скачать 0.87 Mb.
|
|
В чем отличие сертификации от стандартизации? Стандартизация -деятельность, направленная на установление правил и норм в отношении: единства измерений; качества продукции и услуг, их соответствия с современным уровнем развития науки, техники, информационных технологий и т. д. стандартизация ФАКТИЧЕСКИ - это совокупность правил ГОСТ, СНиП и т. д., необходимых для осуществления контроля над всеми сферами деятельности. Сертификация основывается на основе существующих стандартов, разработанных и утвержденных в государстве. Сертификация – это процесс, направленный на подтверждение соответствия продукции установленным нормам и стандартам. Сертификат-документ о качестве товара, выдаваемый государственными инспекциями и другими уполномоченными организациями.  Стандарт (англ. standart) - нормативно-технический документ, устанавливающий комплекс норм, правил, требований к объекту стандартизации. Виды нормативной производственно-технологической документация в области стандартизации лекарственных препаратов ГОСТ — это государственный стандарт, который формулирует требования государства к качеству продукции, работ и услуг, имеющих межотраслевое значение. ГОСТ – это аббревиатура от термина «государственный общесоюзный стандарт». Важно: ГОСТ, как определенная система стандартизации, принята только в странах СНГ. В РФ все ГОСТы утверждаются на федеральном уровне С помощью ГОСТ государство формулирует комплекс требований, предъявляемых к стандартизируемому объекту. Если говорить в двух словах, то соблюдение ГОСТ при производстве продукции, выполнении работ и предоставлении услуг – для потребителя является гарантией качества, а для производителя – одним из условий успешного ведения бизнеса.  ОСТ — это стандарт, устанавливающий требования к качеству продукции в какой-либо конкретной отрасли. ТУ – это аббревиатура от термина «Технические условия». ТУ могут разрабатываться непосредственно производителями, они как бы дополняют ГОСТ на конкретную продукцию или услугу (если таковой имеется) или же являются единственными условиями для производства продукции или услуги (если на данный объект ГОСТа нет). ТУ регламентируют нормы, правила и требования к конкретным моделям, артикулам и типам продукции. Фармакопея-Сборник обязательных национальных или региональных стандартов и положений, нормирующих качество лекарственных средств Фармакопея государственная-включает в себя общие фармакопейные статьи и фармакопейные статьи. Издается Минздравом и подлежит переизданию каждые 5 лет. Фармакопейная статья-Государственный стандарт лекарственного средства, содержащий перечень показателей и методов контроля качества лекарственного средства. Фармакопейная статья общая-Государственный стандарт качества лекарственного средства для конкретной лекарственной формы, содержащий основные требования к лекарственной форме и/или описание стандартных методов контроля лекарственных средств (физических, физико-химических, химических, биохимических, биологических, микробиологических методов анализа, а также требования к используемым реактивам, титрованным растворам, индикаторам). Фармакопейная статья предприятия Стандарт качества лекарственного средства на лекарственное средство под торговым названием, содержащий перечень показателей и методов контроля качества лекарственного средства производства конкретного предприятия. Санитарные (санитарно-эпидемиологические) правила (СП), нормы (СН), правила и нормы (СанПиН) ИСО Международная неправительственная организация по стандартизации (International Organization for Standardization, ISO). Стандарты ИСО серии 9000 Широко признанные в мире стандарты Международной организации по стандартизации в отношении систем качества. Сертификат ИСО 9001 — российская адаптация международного стандарта ISO 9001. Он подтверждает, что деятельность компании в области организации системы менеджмента качества соответствует национальным стандартам. Декларация о соответствии — документ, в котором производитель удостоверяет, что поставляемая им продукция соответствует требованиям нормативных документов.знак Отраслевые стандарты серии GxP (GLP/GCP/GMP) GxP (Good … Practice, Надлежащая … практика) — признанная во всем мире система обеспечения качества лекарственных средств. Система GxP охватывает все этапы жизненного цикла лекарственного средства, от фармацевтической разработки, испытаний, изготовления, хранения до использования конечным потребителем, а именно: Доклинические (лабораторные) исследования, которые регулируются правилами GLP (Good Laboratory Practice, Надлежащая лабораторная практика), Клинические испытания, которые регулируются правилами GCP (Good Clinical Practice, Надлежащая клиническая практика), Производство, которое регулируется правилами GMP (Good Manufacturing Practice, Надлежащая производственная практика), Хранение, которое регулируется правилами GSP (Good Service Practice, Надлежащая практика обслуживания, хранения), Оптовая торговля, которая регулируется правилами GDP (Good Distribution Practice, Надлежащая практика оптовой продажи), Розничная торговля, которая регулируется правилами GPP (Good Participatory Practice, Надлежащая практика розничной продажи). GLP. Надлежащая лабораторная практика – система качества, охватывающая организационный процесс и условия, при которых выполняются неклинические исследования лекарственных средств, связанные со здоровьем и экологической безопасностью. Правила GLP включают в себя: требования к организации испытаний; требования к личному составу исследователей; требования к помещениям, в которых проводятся испытания и содержатся животные; требования к качеству животных, к условиям их содержания и кормления; требования к лабораторному оборудованию и к его калибровке; требования к испытуемому и контрольному веществу; требования к составлению и проведению подробной стандартной методики экспериментальных работ и к порядку проведения испытаний; требования к регистрации данных и оформлению отчета; требования к службе контроля за качеством испытаний; стандартные методики экспериментальных работ. GCP (Good Clinical Practice, Надлежащая клиническая практика) — международный этический и научный стандарт планирования и проведения исследований с участием человека в качестве субъекта, а также документального оформления и представления результатов таких исследований. GMP (Good Manufacturing Practice, Надлежащая производственная практика) – международный стандарт, который устанавливает требования к производству и контролю качества лекарственных средств для человека и животных, а также специальные требования к производству активных фармацевтических субстанций и отдельных видов лекарственных средств. Стандарт GMP регулирует и оценивает параметры производства и лабораторной проверки. Показатели качества в стандартизации инъекционных препаратов стерильность (производством лекарственных препаратов в условиях асептики и последующей стерилизацией) пирогенность значение рН, внешний вид, прозрачность цветность раствора. Одним из важнейших показателей качества ампулированных растворов является показатель «механические включения». подсчет количества частиц может проводиться тремя методами: а) визуальным; б) счетно-фотометрическим; в) микроскопическим. Качество лекарственных средств- Соответствие лекарственных средств государственному стандарту качества лекарственных средств. СОДЕРЖАНИЕ ФАРМАКОПЕЙНЫХ СТАТЕЙ НА: Лекарственные формы для инъекций (растворы для инъекций) 1. Название препарата на русском языке 2. МНН на русском языке 3. Состав 4. Описание 5. Подлинность 6. Прозрачность 7. Цветность 8. рН или Кислотность, или Щелочность 9. Механические включения 10.Плотность 11.Вязкость 12.Посторонние примеси (родственные соединения) 13.Номинальный объем 14.Пирогенность или Бактериальные эндотоксины (ЛАЛ тест) 15.Токсичность 16.Содержание веществ гистаминоподобного действия 17.Стерильность 18.Количественное определение 19.Упаковка 20.Маркировка 21.Транспортирование 22.Хранение 23.Срок годности 24.Фармакологическая группа 25.Меры предосторожности Показатели качества в стандартизации твердых лекарственных форм Определение качества таблеток начинается с оценки их внешнего вида (органолептических свойств), на которые влияют следующие факторы: условия прессования; адгезионные и когезионные свойства таблетируемой массы, ее влажность; гранулометрический состав; поверхность и точность пресс-инструмента; способ покрытия и др. К физическим показателям качества относятся: геометрические (форма таблетки, геометрический вид поверхности, отношение толщины таблетки к ее диаметру и т.д.) собственные физические показатели (масса таблетки, отклонения от заданной величины массы, показатели прочности, пористости, объемной плотности, показатели внешнего вида – окрашенность, пятнистость, целостность, наличие знаков или надписей, отсутствие металлических включений и т.д.). К химическим показателям : распадаемость, растворимость постоянство химического состава, активность лекарственного вещества, срок годности таблеток, стабильность при хранении и т.д. К бактериологическим показателям качества: обсемененность таблеток микроорганизмами, спорами и бактериями непатогенного характера с содержанием не более установленного количества. Контроль качества готовых таблеток проводят согласно требованиям фармакопейной статьи «Таблетки», а также частным фармакопейным статьям по следующим показателям: органолептические свойства – ГФ ХI изд., вып. 2, с. 154-155; механическая прочность – ГФ ХI изд., вып. 2, с. 157-158; распадаемость – ГФ ХI изд., вып. 2, с. 158-159; растворение – ГФ ХI изд., вып. 2, с. 159-160; средняя масса таблеток и отклонение в массе отдельных таблеток – ГФ ХI изд., вып. 2, с. 156; содержание лекарственных веществ в таблетках – ГФ ХI изд., вып. 2, с. 156; однородность дозирования – ГФ ХI изд., вып. 2, с. 156-157; определение талька, аэросила – ГФ ХI изд., вып. 2, с. 157. Некоторые дополнительные требования по качеству таблеток изложены в частных фармакопейных статьях.  Порядок разработки и утверждения фармакопейных статей ФС разрабатывает производитель или производитель совместно с разработчиком. Разработка ФС частными лицами не допускаетсЯ. Организацию и проведение экспертизы проектов ФС осуществляет уполномоченный Минздравом орган – Республиканское унитарное предприятие «Центр экспертиз и испытаний в здравоохранении» (далее – УП «ЦЭИЗ»). Проекты ФС представляются в УП «ЦЭИЗ» вместе с комплектом документов в соответствии с разделом 10 и направляются на экспертизу. ФС утверждается приказом Минздрава с указанием срока действия и даты введения. ФС утверждают на срок не более 5 лет. При необходимости срок действия ФС может быть продлен на срок не более 6 месяцев. Валидация фармакопейных методов Валидация (аттестация) метода анализа Валидация метода (Method validation) это подтверждение обоснованности выбора метода для определения показателей и норм качества ЛС по каждому разделу НД. Цель: оценить соответствие специфических показателей качества ЛС в данной лаборатории при их сопоставлении с другими методами и в других лабораториях. Протокол валидации Должен включать следующие вопросы: Описание метода, который должен быть валидирован. Программу проведения валидации. Параметры, подлежащие оценке. Параметры окружающей среды. Рабочие параметры. Необходимые тесты. Контроль оборудования и его работы. Описание или ссылку на методы, которые должны использоваться для измерения каждого параметра. Формы сбора данных или стандартные формы отчетов Предельные диапазоны оцениваемых параметров. Обязанности по выполнению задач валидации с указанием (если возможно) сроков исполнения. К протоколу прилагаются результаты испытаний и отчеты о валидации. Современное состояние и путисовершенствованиястандартизациилекарственныхсредств: Раскрыть тему относительно Значение контроля качества лекарственных средств Контролькачествалекарственныхсредств представляет собой комплекс строго регламентированных процедур по отбору проб и проведению исследований медикаментов на соответствие их установленным стандартам. Государственный надзор за качеством лекарственных средств • Понятие стандарта. Виды стандартов. • Основные направления стандартизации  Приобретение опыта разработки фармакопейных статей Гармонизация фармакопей с ведущими фармакопеями мира Система государственного контроля качества лекарственных средств: Оценка эффективности безопасности и качества ЛС при регистрации (на опытно-промышленных или премышленных образцах) Экспертиза качества ЛС,находящихся вгражданском обороте (проводится выборочно) Мониторинг качества,эффективности и безопасности лекарственных средств, находящихся в обращении Инспекционный контроль Инструментами данной системы, являются: территориальные управления МЗ; испытательные лаборатории; единая информационная система; система качества в организациях-производителях лекарственных средств,розничных и оптовых фармацевтических организациях.  Фарм.анализ- наука о хим.характеристике и изменении БАВ на всех этапах производства.Способы аналализа нуждаются в постоянном совершенствовании .Если ранее превалировали хим.реакции в фармакопее, то на данном этапе используются преимущественно фихико-химические и химические методы анализа Биофармацевтический анализ-разновидность фармацевтического анализа Включает: извлечение Концентрирование Определение ЛВ и их метаболитов(продуктов разложения )в биоматериале 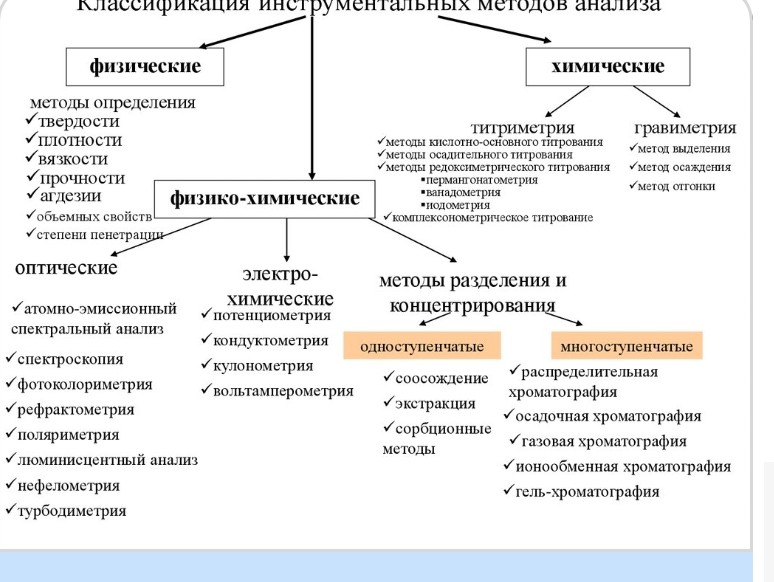   Терминология : БЕЗОПАСНОСТЬ ПРОДУКЦИИ — свойство продукции, обеспечивающее безопасное для жизни, здоровья или имущества граждан использование приобретенной продукции или ее хранение в течение установленного срока годности. Декларирование соответствия – это форма обязательного подтверждения качества продукции на соответствие всем установленным нормам и требованиям безопасности. Знак соответствия (для сертификации) указывающий, что данная продукция, процесс или услуга соответствует конкретному стандарту или другому нормативному документу. Идентификация продукции – это способ, метод определения соответствия продукции заявленным характеристикам, критериям, параметрам. Этот процесс всегда предшествует непосредственной процедуре сертификации или декларирования и проводит его эксперт по сертификации продукции в рамках своей компетенции. Международный стандарт — стандарт, принятый международной организацией. Стандартом называется документ, в котором устанавливаются характеристики продукции, эксплуатации, хранения, перевозки, реализации и утилизации, выполнения работ или оказания услуг. Национальный (государственный) стандарт - стандарт, принятый национальным органом по стандартизации любого государства и доступный широкому кругу пользователей Сертификация – это процесс, направленный на подтверждение соответствия продукции установленным нормам и стандартам Техническое регулирование — правовое регулирование отношений в трех областях в области установления, применения и исполнения обязательных требований к продукции или к продукции и связанным с требованиями к продукции процессам проектирования (включая изыскания), производства, строительства, монтажа, наладки, эксплуатации, хранения, перевозки, реализации и утилизации; в области применения на добровольной основе требований к продукции, процессам проектирования (включая изыскания), производства, строительства, монтажа, наладки, эксплуатации, хранения, перевозки, реализации и утилизации, выполнению работ или оказанию услуг (в рамках Евразийского экономического союза эта область отсутствует[3]); в области оценки соответствия. Технический регламент (англ. technical regulation — документ, содержащий технические требования либо непосредственно, либо путем ссылки на стандарт или технические условия, либо путем включения в себя содержания этих документов Сертификат-документ о качестве товара, выдаваемый государственными инспекциями и другими уполномоченными организациями. Фальсифицированные лекарственные средства – лекарственные средства, изготовленные с нарушением их состава, а равно сопровождаемые ложной маркировкой (информацией) о его составе и (или) производителе; Недоброкачественное лекарственное средство – лекарственное средство, пришедшее в негодность, и (или) лекарственное средство с истекшим сроком годности, и (или) не соответствующее государственным стандартам, действующим на территории Приднестровской Молдавской Республики; Безопасность лекарственных средств – характеристика лекарственных средств, основанная на сравнительном анализе их эффективности и оценки риска причинения вреда здоровью; |
