17 группа пн. 23.05. Важнейшие химические свойства оксидов, гидроксидов и солей, проявляющиеся в процессах агротехнического комплекса
 Скачать 152.7 Kb. Скачать 152.7 Kb.
|
|
23.05.22 г. 17 группа Тема урока: Важнейшие химические свойства оксидов, гидроксидов и солей, проявляющиеся в процессах агротехнического комплекса Домашнее задание: изучить лекцию, сделать краткий конспект, письменно выполнить задания для самостоятельной работы, ответ прислать на адрес электронной почты: oksanamakaseeva19769@gmail.com подписать фамилию, имя, группу, предмет. Оксиды 1. Важнейшее свойство оксидов — их взаимодействие с гидроксидами. 1.1. Кислотные оксиды реагируют с щелочами. В условиях агротехнического комплекса наиболее важными кислотными оксидами являются углекислый, сернистый и нитрозные газы. Эти вещества получаются как в природных условиях, так и в производственной деятельности человека. Углекислый газ образуется при окислении органических веществ, диоксид серы — при окуривании семян сжиганием серы, нитрозные газы — в процессе производства азотной кислоты, при грозовых разрядах и др. Образовавшиеся газы реагируют с щелочами, образуя соли. Рассмотрим примеры некоторых реакций, протекающих в средах, характерных для сельского хозяйства; гидроксид натрия встречается в природной среде: 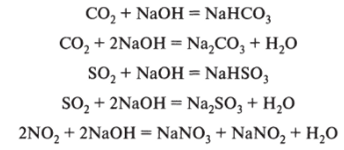 1.2. Основные оксиды реагируют с кислотами: 2. Оксиды, которым соответствуют растворимые гидроксиды, реагируют с водой. Это свойство важно для сельского хозяйства, так как оно является причиной кислотных дождей. Кислотные дожди приводят к изменению реакции среды почвенных растворов и, кроме этого, отрицательно воздействуют на организмы растений и животных: 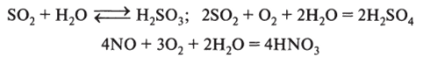 3. Кислотные оксиды, которым соответствуют многоосновные кислоты, реагируют с водными смесями собственных солей, образуя кислые соли. В природных условиях это характерно для углекислого газа: Возможны и другие химические процессы в сельском хозяйстве с участием оксидов. Гидроксиды В 1.8.1 рассмотрены некоторые свойства гидроксидов в реакциях, протекающих в сфере агротехнического комплекса. Рассмотрим и некоторые другие свойства. 1. Гидроксиды проявляют как основные, так и кислотные свойства. Кислотные гидроксиды взаимодействуют с основаниями или амфотерными гидроксидами, образуя различные соли, что применяется при получении удобрений. Примером такой реакции является получение гидрофосфата кальция (основа преципитата): 2. Большой интерес для сельского хозяйства представляет способность кислот реагировать с аммиаком и аминами с образованием солей: 3. Кислоты реагируют с металлами; это свойство используется в агротехническом комплексе при изготовлении сельскохозяйственной техники и оборудования, например при «травлении» металлов: Химические свойства гидроксидов весьма многообразны. Ограничимся рассмотренными примерами. Соли Рассмотрим некоторые свойства солей, широко применяющихся в сельском хозяйстве. 1. Соли взаимодействуют с кислотами. Это свойство многогранно. Следует помнить, что в большинстве своем с солями реагируют только те кислоты, которые сильнее той, соль которой взята в реакцию. Интересным для сельскохозяйственного производства является взаимодействие фосфатов с серной кислотой. Реакцию можно проводить в избытке серной кислоты, тогда образуется фосфорная кислота, которая в дальнейшем применяется для получения фосфорных удобрений: Большой интерес для сельского хозяйства представляет способность многоосновных кислот взаимодействовать с собственными солями, образуя кислые соли. Эти реакции лежат в основе получения некоторых удобрений, например двойного суперфосфата: 2. Водные суспензии солей многоосновных кислот реагируют с соответствующими кислотными оксидами, образуя кислые соли, что имеет большое значение в почвообразовательных процессах, например, взаимодействие карбоната кальция с водным раствором углекислого газа: 3. В природных условиях соли разлагаются, что является вкладом в реализацию круговорота веществ: 4. Соли подвергаются гидролизу. Задания для самостоятельной работы 1. Проставьте в уравнениях реакций степени окисления и уравняйте левую и правую стороны: Пример: 2H+1 NO3 -1 + Zn+2(OH)2-1 = Zn+2(NO3)2-1+ 2H2 +1O-2 PO5 + KOH = K3PO4 + H2O NaO + H2O = NaOH KO + HPO4 = KPO4 + H2O AlO + HCl = AlCl3 + H2O HNO3 + CuO = CuNO3+ H2O FeCl3 + Ba(OH)2 = BaCl2 + Fe(OH)3 Cu + AgNO3 = CuNO3 + Ag BаOH + HNO3 = BaNO3 + H2O СaCl + NaCO3 = CaCO3 + NaCl Al(OH)3 + HSO4 = Al(SO4)3 + H2O |
