ВАН. Вандерваальс тедеуі
 Скачать 21.46 Kb. Скачать 21.46 Kb.
|
|
ВАН–ДЕР–ВААЛЬС ТЕҢДЕУІ. Орта мектеп курсынан белгілі газ күйінің теңдеуін қорытқанда газ молекуласның сызықтық мөлшерін (радиус, диаметр, т.б.) және олардың бір–бірімен әсерлесу күштерін ескермедік, молекулаларды нүктедей деп қарастырдық. Көптеген тәжірбиелердің нәтижесінде бұл заңдардың салыстырмалы арнайы шарттар сақталғанға дейін қолданылатындығы белгілі болды, яғни қысымды арттырып, температураны төмендетсе газ заңдарының ешқайсысы да орындалмайды. Олай болса идеал газдың Клапейрон – Менделеев теңдеуі нақты газға қолданылмайды. Қасиеті молекулаларының әсерлесуіне тәуелді газды нақты газ деп атайды. Клапейрон – Менделеев теңдеуін нақты газдарға қолдану үшін оған түзулер енгізу қажет. Сол түзетуді алғаш 1873 жылы енгізген голландия физигі Ван–дер–Ваальс (1837–1923ж.ж.) болды. 1.Бірінші түзетуі – ол молекулалардың өздерінің көлемі. Газды қысқанда ол қысыға кері пропорционал кемитін барлық көлем емес молекулалар арасындағы бос кеңістіктің көлемі болғандықтан, Клапейрон – Менделеев формуласындағы V көлем орнына (V–6) шамасын енгізеді. Мұнда 6 – газдың қысылмаған бөлігінің көлемі, яғни молекулалардың көлемі, ол Ван–дер–Ваальстің есептеуінше барлық молекулалардың 4 еселенген көлеміне тең. Молекулалардың центрі бір – біріне яғни бір молекуланың көлемінен ( 2. Нақты газ молекулаларының арасындағы тартылыс күші қосымша қысым немесе ішкі қысым туғызады.Бұл Ван–дер–Ваальстің енгізген екінші түзетуін Р' арқылы белгілейік. Молекулалардың бір – біріне тартылыс күші газды қысу үшін сыртқы қысым күшімен қосылады. Олай болса, Клапейрон – Менделеев формуласындағы сыртқы қысым Р орнына екі қысымның қосындысын жазамыз: (P+P’) ішкі немесе молекулалық қысым, ол Бұл Ван–дер–Ваальстің есептеуінше газ көлемінің квадратынаткері пропорционал, яғни а – газдың табиғатына байланысты Ван–дер–Ваальс тұрақтысы. Осы түзетулерді Клапейрон – Менделеев формуласына қойсақ Бұл 1 моль газ үшін шыарылған нақты газ күйінің теңдеуі немесе Ван–дер–Ваальс теңдеуі. Кез кеген массалы (m) газ үшін (11-2) өрнекті төмендегіше жазамыз: 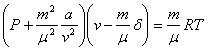 , (3,1) , (3,1)Төменгі қысымда, жоғары температурада көлем V артады да, |
