Вариант 11. Вариант 11 пз 1. Строение вещества
 Скачать 201.04 Kb. Скачать 201.04 Kb.
|
1 2
6.1. Определить тип окислительно-восстановительной реакции, степень окисления окислителя и восстановителя (табл. 6.3). Т а б л и ц а 6.3
Рассмотрите ОВР, схема которой: NH4NO3 ⟶ N2O + 2H2O N-3 - 4ē ⟶ N+ |1 восстановитель (окисление) N+5 + 4ē ⟶ N+ 4 |1 окислитель (восстановление) NH4NO3 является восстановителем, NH4NO3 является окислителем (конпропорционирования). 6.2. Используя метод ионно-электронного баланса, подберите коэффициенты в уравнении окислительно-восстановительной реакции. Рассчитайте термодинамическую вероятность процесса, укажите направление реакции (табл. 6.4). Т а б л и ц а 6.4
Решение: 2O-1 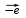 O20 2 | окислитель восстановление O20 2 | окислитель восстановление Pb4+ 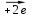 Pb2+ 1 | восстановитель окисление Pb2+ 1 | восстановитель окислениеМетодом полуреакций: 1 H2O2 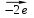 O2 +2H+ O2 +2H+ 1 PbO2 +4H+ 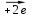 Pb2++ 2H2O Pb2++ 2H2O PbO2 +4H+ +2H2O = H2O2+2H+ + Pb2++ 2H2O H2O2+PbO2 +2CH3COOH → O2 + Pb(CH3COO)2 + 2H2О Рассчитываем Е0298 и ∆G0298 данной реакции: Е 0298 = φ 0окислителя - φ 0 восстановителя = (-1,455) –0,682 =- 2,137 В. ∆G 0298 = - zF Е298 = - 2 · 96500 · -2,137 · 10-3 = +412,4 кДж/моль . 6.3. Рассчитайте электродвижущую силу гальванического элемента по стандартным значениям энергии Гиббса (∆G 0298 для реакции. Напишите реакции, происходящие на электродах, составьте схему гальванического элемента (табл. 6.5). 1 H2O2 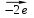 O2 +2H+ O2 +2H+ 1 PbO2 +4H+ 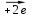 Pb2++ 2H2O Pb2++ 2H2O PbO2 +4H+ +2H2O = H2O2+2H+ + Pb2++ 2H2O H2O2+PbO2 +2CH3COOH → O2 + Pb(CH3COO)2 + 2H2О Рассчитываем Е0298 и ∆G0298 данной реакции: Е 0298 = φ 0окислителя - φ 0 восстановителя = (-1,455) –0,682 =- 2,137 В. ∆G 0298 = - zF Е298 = - 2 · 96500 · -2,137 · 10-3 = +412,4 кДж/моль . Схема гальванического элемента примет следующий вид (–) O2 ,2H+ | H2O2 || PbO2 | Pb2+, 2H2O (+). При наличии внешней цепи на электродах протекают следующие реакции
6.4. Составьте схему работы гальванического элемента, образованного двумя данными металлами, погруженными в растворы солей с известными концентрациями ионов, рассчитайте ЭДС этого элемента (табл. 6.6). Т а б л и ц а 6.6
Р е ш е н и е Равновесие для первого электрода Pd | PdSO4 (0,1 M). Токообразующая реакция Pd2+ + 2 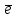 = Pd0. = Pd0.φ 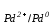 = φ = φ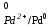 + + 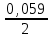 lg lg 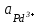 = 0,987+ = 0,987+ 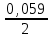 lg0,1 = 0,958 B. lg0,1 = 0,958 B.Аналогично, для второго электрода Cd | CdI2 (0,03 M). Токообразующая реакция Cd2+ + 2 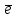 = Cd0. = Cd0. φ 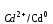 = φ = φ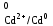 + + 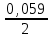 lg lg 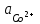 = –0,403+ = –0,403+ 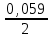 lg 0,03 = –0,448 B. lg 0,03 = –0,448 B.При составлении гальванического элемента более отрицательным электродом будет система Co | Co2+, более положительным – Pd |Pd2+. Схема гальванического элемента примет следующий вид (–) Cd | CdI2(0,03 M) || PdCl2(0,1 M) | Pd (+). При наличии внешней цепи на электродах протекают следующие реакции
  Реакция в элементе в целом Cd0 + Pd2+ = Cd2+ + Pd0. Реакция в элементе в целом Cd0 + Pd2+ = Cd2+ + Pd0. 2  Электродвижущая сила этого элемента может быть рассчитана как по ранее определенным электродным потенциалам, так и непосредственно. E298 = φ 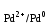 – φ – φ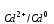 = ( 0,958 – (–0,448)) =1,406 B. = ( 0,958 – (–0,448)) =1,406 B.6.5. При электролизе раствора данной соли металла током I, А, масса катода возросла на mг. Учитывая, что выход металла по току Bi, %, рассчитайте, какое количество электричества и в течение какого времени пропущено. Составьте схему электролиза c растворимым и нерастворимым анодом (табл. 6.7). Т а б л и ц а 6.7
Р е ш е н и е Составляем схему электролиза с нерастворимым анодом. Электрохимическая система имеет следующий вид (- ) Fe | SbF3, H2O | Ti (+). В качестве покрываемого металла выбрано железо; нерастворимого анода – титан. В растворе присутствуют следующие ионы и молекулы SbF3 ←→ Sb2+ + 3F− (электролитическая диссоциация); SbF3 + 3H2O = Sb(OH)3 + 3HF (гидролиз); Sb3+ + 3Н2О = Sb(ОН)3↓ + 3Н+, рН < 7, среда кислая. Следовательно, при составлении схемы электролиза надо учитывать ионы Sb3+, F− , Н+, молекулы Sb(OH)3, H2O. Реакции на электродах А: 2Н2О = О2 + 4Н+ + 4е ; К: Sb3+ + 3е = Sb0 2Н+ + 2е = Н2. Из-за выделения водорода на катоде совместно с восстановлением ионов Sb(III) выход по току металла меньше 100 %. Схема электролиза водного раствора SbF3с нерастворимым анодом: (–) Катод (+) Анод (нерастворимый) ← Sb3+ → H2O ← H+ → F  Sb3+ + 3 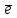 = Sb0 = Sb02H+ + 2 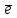 = H2 2H2O - 4 = H2 2H2O - 4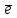 = O2 + 4H+. = O2 + 4H+.Далее составляем схему электролиза с растворимым анодом. Электрохимическая система: (-) Fe | SbF3, H2O | Sb (+). Реакции на электродах: А: Sb0 = Sb3+ + 3е. К: Mn3+ + 3е = Mn0, 2Н+ + 2е = Н2. Схема электролиза водного раствора SbF3 c растворимым анодом: (–) Катод (+) Анод ← Sb3+ → H2O ← H+ → F  → Fe0 Sb3+ + 3 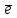 = Sb0 2F- - -2e=F2 = Sb0 2F- - -2e=F22H+ + 2 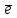 = H2 2Fe0 - 4 = H2 2Fe0 - 4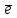 = 2Fe2+. = 2Fe2+. Количество электричества по закону Фарадея составит Q=It=mzF/ABi=0,77·3·96500/122·0,71=2573,48 Кл Оно пропущено в течении времени t=Q/I=2573,48 /0,99·3600=0,72 ч 1 2 |
