|
|
Выделение полисахаридов. Реферат Веденеев П.А.. Выделение микробных полисахаридов. Получение среднемолекулярной фракции декстрана
Министерство высшего образования и науки Российской Федерации
ФГАОУ ВО «Уральский федеральный университет
имени первого Президента России Б.Н.Ельцина»
Химико-технологический институт
Кафедра технологии органического синтеза
РЕФЕРАТ
Тема: «Выделение микробных полисахаридов. Получение среднемолекулярной фракции декстрана»
Студент
гр. Х-370008 Веденеев П. А.
Проверяющий
доцент, к.х.н. Берсенева В. С.
Екатеринбург
2020
Оглавление
1.Общие сведения о полисахаридах 3
2.Полисахариды микроорганизмов 5
3.Выделение полисахаридов 6
3.1. Фракционное осаждение и экстракция 9
3.2. Фильтрование, ультрафильтрование, диализ 11
3.3. Ферментативная очистка 13
2.4. Хроматографические методы 14
2.5. Электрофорез 19
2.6. Ультрацентрифугирование 20
Получение среднемолекулярной фракции декстрана 21
Список литературы 22
Общие сведения о полисахаридах
Среди большого многообразия соединений природного происхождения особое место занимают углеводы и их производные. Они составляют основную массу органических веществ на Земле.
Углеводы делятся на три больших класса: моносахариды, олигосахариды и полисахариды. Природные полисахариды – высокомолекулярные углеводы, макромолекулы которых построены из моносахаридных звеньев, связанных друг с другом гликозидными связями. Они выполняют в живых организмах четыре важнейших типа биологических функций, выступая в роли энергетического резерва, структурных компонентов клеток и тканей, защитных веществ, а также специфических молекул–маркеров.
Структурные полисахариды (целлюлоза, хитин, пектины, альгинаты, хондроитинсульфаты, полиуроновые кислоты и др.) придают клеткам, oрганам и целым организмам механическую прочность. Нерастворимые в воде структурные полисахариды образуют волокнистые структуры и служат армирующим материалом клеточной стенки, водорастворимые – предохраняют клетки и ткани от высыхания. Гелеобразующие водорастворимые полисахариды обеспечивают эластичность клеточных стенок (выстилают трущиеся поверхности: кости в суставах, стенки кровеносных сосудов и т.п.) и адгезию клеток в тканях.
Резервные полисахариды (амилоза, амилопектин, гликоген, декстран, ксантан, гепарин и др.) являются энергетическим запасом и накапливаются в клетках в больших количествах. При их распаде образуются низкомолекулярные углеводы (моно-, ди- и олигосахариды), обеспечивающие организм энергией.
Защитную функцию полисахариды проявляют в ответ на повреждение тканей, образуя защитную капсулу или модифицируя свойства среды обитания клеток. К защитным полисахаридам относят камеди и слизи (смесь полисахаридов сложного состава и строения) растений, животных и микроорганизмов.
Особое значение имеет специфическая функция полисахаридов – участие в образовании комплексных макромолекул, а именно гликопротеинов и гликолипидов. Так гликопротеины служат маркерами в процессах узнавания молекулами и клетками друг друга, определяют антигенную специфичность, обуславливают различия групп крови, выполняют рецепторную, каталитическую и др. функции.
Полисахариды микроорганизмов
Полисахариды микроорганизмов в соответствии с локализацией делятся на внутриклеточные и внеклеточные. К внутриклеточным относят обычно полисахариды цитоплазмы, мембран и клеточных стенок, а к внеклеточным – полисахариды капсул, чехлов (пристеночные структуры) и свободной слизи, не прилегающей к клеточной стенке. Иногда к внеклеточным относят также полисахариды, локализованные снаружи от цитоплазматической мембраны. В этом случае в группу внеклеточных попадают и полисахариды клеточных стенок. У ряда микроорганизмов действительно трудно различить границу между капсулой и клеточной стенкой.
Нередко по локализации выделяют три группы полисахариддов: внутриклеточные (цитоплазмы, мембран, периплазмы), полисахариды клеточных стенок и внеклеточные (капсул, чехлов и свободной слизи). Термин «экзогликаны» применяют в основном к полисахаридам свободной слизи. Иногда экзогликанами называют также капсульные полисахариды.
Микробные полисахариды объединяют в группы и по функциям: резервные, участвующие в активном транспорте, опорные, участвующие во взаимодействии между клетками, защитные и др.
Некоторые исследователи классифицируют полисахариды, учитывая их топологию и функции. В соответствии с этим клеточные полисахариды подразделяются на две группы. Одна включает резервно-энергетические и модификаторы (внутриклеточные), вторая – структурные и структурнометаболические (в клеточной стенке). К внеклеточным относятся выделяющиеся при гиперпродукции структурно-метаболические гликаны и собственно экзогликаны.
Выделение полисахаридов
Природные полисахариды присутствуют в составе растительных и животных тканей в виде сложно-построенных систем. В зависимости от локализации применяют различные методы выделения. Если необходимо извлечь внутриклеточные полисахариды, то предварительно нужно разрушить клетки и разделить их содержимое. Если полисахариды находятся в культуральной жидкости, то необходимо отделить клетки и получить нативный раствор, их которого в дальнейшем будут выделяться полисахариды.
Классические методы выделения и очистки низкомолекулярных органических соединений, такие как осаждение, перекристаллизация, перегонка и т.д., для выделения полисахаридов не применимы. При перегонке макромолекулы разрушаются, а при осаждении могут изменять конфигурацию, даже если процесс проводят в сравнительно мягких условиях (комнатной температуре, нормальном атмосферном давлении). Разрушение и деструкция макромолекулярных структур происходит даже при измельчении или размалывании исходного сырья.
Хотя методы выделения полисахаридов из природного сырья разнообразны, и невозможно описать стандартную процедуру, существует ряд общих требований и подходов. Выбранный способ выделения должен удовлетворять двум основным требованиям.
Во-первых, процесс должен быть максимально эффективным, сопровождаться незначительными потерями на всех этапах получения.
Во-вторых, в процессе выделения полисахарид не должен подвергаться изменениям.
При этом необходимо учитывать как деструкцию под действием применяемых химических реагентов, так и возможное воздействие ферментов, присутствующих в источнике. При выделении природных полисахаридов необходимо решать три задачи различной степени сложности:
Отделение низкомолекулярных веществ – наиболее простая;
Отделение биополимеров неуглеводной природы;
Разделение смесей полисахаридов - наиболее сложная.
Эти три задачи редко являются последовательными этапами выделения. Чаще применяемый метод выделения позволяет решить сразу две, а иногда и все три задачи.
При выборе оптимальных условий для выделения полисахарида необходимо учитывать лабильность макромолекул, содержащих гликозидные связи фураноз, 3,6-ангидрогексоз и др., в кислых средах, а содержащих сложноэфирные группировки, гликозиды β-окси-αаминокислот, восстанавливающие концевые моносахариды с заместителем в положении С3 и др., в щелочных средах.
В щелочной среде может также происходить деструкция макроцепи вследствие окисления кислородом воздуха. Расщепление химических связей возможно и при некоторых методах очистки, связанных с превращением полисахаридов в их производные.
Реальную опасность при выделении полисахаридов представляет деструкция под действием ферментов. Ферменты, содержащиеся в источнике, из которого выделяют полисахарид, обычно инактивируют нагреванием, кипячением с метанолом, замораживанием и т.п.
Растворы полисахаридов могут служить средой для роста микроорганизмов, попадающих туда из воздуха лаборатории. Для предотвращения расщепления полисахаридов ферментами микроорганизмов к растворам прибавляют толуол, тимол или хранят их при низкой температуре.
Современные методы установления строения полисахаридов применимы лишь к индивидуальным веществам. Полисахарид обычно считается индивидуальным, если не менее двух разных способов очистки не изменяют его мономерный состав и физико-химические свойства (например, удельное оптическое вращение растворов, среднее значение молекулярной массы), а общепринятые аналитические методы не выявляют наличия примесей (гомогенность по данным хроматографии, электрофореза, ультрацентрифугирования и др.). Работа с неочищенными полисахаридными препаратами может привести к не верным выводам о строении.
Еще сложнее решить вопрос о нативности выделенного полисахарида. Только в случае биологически активных полисахаридов, например, обладающих антигенными, антибактериальными и др. свойствами, можно в какой-то мере контролировать нативность реакциями с соответствующими специфическими антисыворотками, бактериями и т.д. Поэтому выделение остается одной из сложнейших проблем, специфичной для каждого полисахарида и каждого биологического источника.
3.1. Фракционное осаждение и экстракция
Фракционное осаждение и экстракция применяются для выделения и очистки практически всех природных полисахаридов. Экстракция является первоначальной стадией почти каждого процесса выделения. Экстракция используется для:
растворения полисахарида и ряда сопутствующих веществ (многочисленные примеси остаются нерастворенными в исходном сырье);
удаления сопутствующих веществ (извлекаемый полисахарид представляет собой остаток после экстракции).
Экстракция. Растворителем, применяемым для экстракции выделяемого полисахарида прямым растворением, в подавляющем большинстве случаев является вода. Повышение растворимости может быть достигнуто повышением температуры, изменением рН среды. Так, многие кислые полисахариды, находящиеся в природном сырье в солевой форме, хорошо растворяются в разбавленных минеральных кислотах. Растворимость нейтральных полисахаридов, наоборот, повышается в щелочной среде. Иногда при экстракции полисахаридов используют растворы солей, например растворы тиоцианата лития, или растворы комплексообразователей, например солей борной кислоты. В специальных случаях полисахариды извлекают другими растворителями – водным спиртом, диметилсульфоксидом, диметилформамидом. С помощью этих растворителей часто удается избирательно экстрагировать полисахариды со сравнительно невысокой молекулярной массой или с большим количеством малополярных заместителей, например ацетатных групп.
Экстракция полисахарида сопровождается растворением полярных низкомолекулярных соединений – неорганических солей, сахаров, гликозидов, а также ряда белков, нуклеиновых кислот и т.д. Поэтому дальнейшая обработка экстракта проводится с целью удаления этих сопутствующих веществ.
Осаждение. Некоторые полисахариды растворимы в горячей воде значительно лучше, чем в холодной, и их отделяют после охлаждения экстрактов. Дальнейшая очистка таких полисахаридов аналогична перекристаллизации.
Другим приемом выделения полисахаридов из водных растворов является осаждение смешивающимся с водой органическим растворителем, например этиловым спиртом. В 80%-ном спирте растворимы многие низкомолекулярные вещества, экстрагируемые из биологических объектов вместе с полисахаридами, например, моно- и олигосахариды. Полисахариды при такой концентрации спирта, как правило, выпадают в осадок. В качестве осадителей применяют также метанол, ацетон, уксусную кислоту и некоторые другие.
Фракционное осаждение. Простое осаждение не приводит к разделению смесей полисахаридов. Чтобы отделить полисахариды друг от друга, проводят фракционное осаждение, т.е. получают серию фракций осаждаемых веществ, соответствующих разным концентрациям осадителя в растворе, и исследуют их состав или свойства. При фракционном осаждении полисахаридов используются следующие осадители: неорганические соли (соли аммония, кальция, бария, калия, рубидия, цезия), кислоты, щелочи, органические спирты (этанол, н-бутанол), кетоны (ацетон) и др. Осадитель медленно добавляют в разбавленный раствор полимера при перемешивании. При недостаточной степени очистки проводят повторное растворение полисахарида и переосаждение. Так, кислые полисахариды могут быть выделены из растворов и отделены от нейтральных полисахаридов в виде нерастворимых солей.
Вместо фракционного осаждения можно использовать также обратный прием – фракционное растворение осадка.
Для осаждения и фракционирования полисахаридов используют также низко- и высокомолекулярные комплексообразователи.
3.2. Фильтрование, ультрафильтрование, диализ
Фильтрование – механическое просеивание раствора полисахарида через фильтр для удаления грубодисперсных частиц (размером более 1 мк). Для фильтрования используют бумажную ткань, фильтровальную бумагу, стеклянную вату, туфовые стеклянные фильтры. Первичные экстракты полисахаридов, как правило, загрязненыне углеводными примесями: неорганическими солями, белком и др. Для их удаления применяют ультрафильтрование, диализ и аналогичные методы.
Ультрафильтрование – фильтрование растворов через полупроницаемые мембраны с известной величиной пор (0.01-1 мк). Традиционными материалами для ультрафильтрования являются целлофан и нитроцеллюлоза. Пример промышленного аппарата для ультрафильтрации приведен на рис.1.
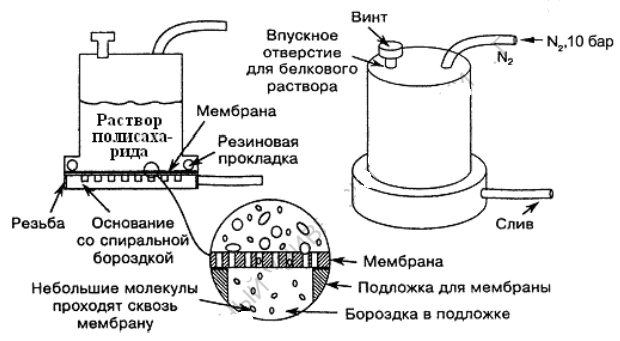
Рис.1. Аппарат для ультрафильтрации (поставляется фирмой Amicon Inc,
Beverly, MA). Под давлением азота из баллона раствор полисахарида
фильтруется через мембрану. Небольшие молекулы проходят через мембрану
и собираются на выходе. Крупные молекулы остаются в камере.
Ультрафильтрование позволяет удалить низкомолекулярные примеси, сконцентрировать раствор полимера, а в отдельных случаях получить фракции полисахаридов, различающиеся молекулярной массой.
Ультрафильтрация является исключительно эффективным способом подготовки образцов для дальнейших исследований, например, для последующей хроматографии.
Диализ. Диализ применяется для отделения низкомолекулярных примесей: электролитов (ионов натрия, сульфата, аммония, хлорида и др.) и микромолекулярных неэлектролитов (сахара, мочевины, спирта и др.). Для изготовления диализных полупроницаемых мембран используют целлофан.
Растворы полисахаридов, требующие очистки, помещают в целлофановые сосуды, которые погружают в воду. При этом низкомолекулярные примеси диффундируют через поры целлофановой мембраны в водную среду. Процесс диффузии ускоряется при перемешивании диализуемого раствора и диализе против проточной воды.
Для удаления катионов из растворов кислых полисахаридов диализ проводят в подкисленных растворах. Для быстрого удаления электролитов может быть применен электродиализ, при котором диффузия ионов ускоряется под действием электрического поля (рис.2).
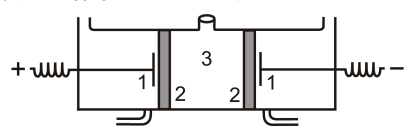
Рис.2. Электродиализер: электроды (1); мембрана (2); отделение,
содержащие очищаемый раствор полисахарида (3).
Постоянный ток пропускают через раствор полисахарида,
отделенный от воды полупроницаемой мембраной.
3.3. Ферментативная очистка
Высокомолекулярные примеси, неудаляемые диализом, обычно осаждаются впоследствии вместе с выделяемым полисахаридом. В ряде случаев можно провести их предварительное разрушение действием соответствующих ферментов. Так, для отделения белка широко применяют протеолиз.
Удаление нуклеиновых кислот достигают обработкой соответствующими нуклеазами.
Многочисленные препараты полисахаридов очищают от примесей крахмала или гликогена действием амилаз.
Однако при ферментативных воздействиях всегда приходится учитывать, что препарат фермента может обладать неизвестной активностью, способной изменить структуру и, соответственно, свойства выделяемого полисахарида.
Удаление белка после ферментативной обработки достигается обычно одним из методов денатурирования. К ним относятся нагревание, обработка щелочью, хлороформом с амиловым спиртом, трифтортрихлорэтаном, трихлоруксусной или фосфовольфрамовой кислотой и др. Можно использовать также избирательную сорбцию белков на геле фосфата кальция, бентоните или каолине. Эти же методы могут применяться и для удаления неферментных белков, загрязняющих растворы полисахаридов.
2.4. Хроматографические методы
Хроматография полимеров представляет собой специфическую область, развитие которой связано с определенными трудностями.
С одной стороны, даже молекулы однородного полимера, различающиеся молекулярной массой, могут обладать разной хроматографической подвижностью.
С другой стороны, различие в растворимости или способности сорбироваться на используемом носителе между разными полимерами может быть недостаточным для хроматографического разделения.
Поэтому до настоящего времени не нашли широкого распространения в области полисахаридов такие виды хроматографии, как распределительная, адсорбционная и аффинная.
Более успешным оказалось применение ионообменной и размерно-эксклюзионной (гель фильтрация) хроматографии. Ионообменная хроматография. Вследствие своей превосходной разрешающей способности ионообменная хроматография является наиболее важным типом хроматографических методов выделения и очистки препаратов природных полисахаридов.
Ионообменная хроматография. В ионообменной хроматографии неподвижная твердая фаза обычно состоит из сорбента «смолы» с ковалентно связанными анионами или катионами. Противоположно заряженные ионы растворенного вещества в жидкой подвижной фазе электростатическими силами притягиваются к ионам сорбента.
Адсорбированные компоненты образца затем элюируют с применением растворов солей или буферных растворов разной концентрации, которые постепенно десорбирует молекулы образца в порядке увеличения электростатического взаимодействия с ионами в колонке. Ионы соли ослабляют электростатическое взаимодействие между ионами образца и ионами сорбента (молекулы образца с различными электростатическими свойствами элюируются при различных концентрациях соли).
Наиболее часто используемым анионообменником является диэтиламиноэтил (ДЭАЭ, рКа = 9.5), катионообменником – карбоксиметил (КМ, рКа = 4.0). Положительные заряды ДЭАЭсорбента (например, ДЭАЭ-целлюлозы) притягивают отрицательно заряженные макромолекулы, КМ-сорбента – положительно заряженные макромолекулы.
Методом ионообменной хроматографии с применением анионообменной смолы разделяют смеси кислых и нейтральных полисахаридов, например, пектиновую кислоту от сопутствующего арабинана или сульфированные полисахариды водорослей от крахмалоподобных примесей. В ряде случаев при таком способе разделения удается освободиться от примесей белка.
Р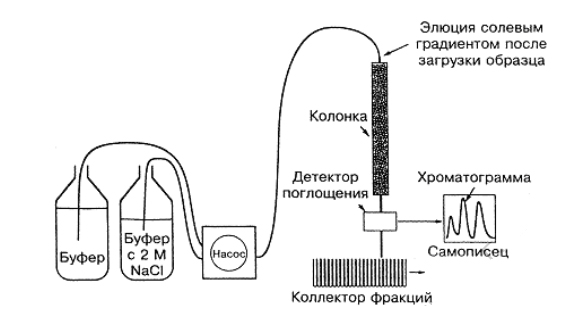
азрешающая способность хроматографического разделения и очистки зависит преимущественно от типа исследуемых макромолекулярных систем, типа и качества сорбента, ионной силы солевого градиента при элюции, температуры и геометрии колонки. Типичная установка ионообменной высокоэффективной жидкостной хроматографии (ВЭЖК) приведена на рис.3.
Рис.3. Типичная установка ионообменной высокоэффективной
жидкостной хроматографии (ВЭЖХ) для очистки полисахаридов. После загрузки образца (с помощью шприца) насос создает солевой градиент для элюции очищенного образца полимера.
Экспериментальная установка состоит из бутыли с буферным раствором, бутыли с раствором соли в буферном растворе, программируемой помпы (перистальтического насоса), детектора поглощения, самописца и коллектора фракций.
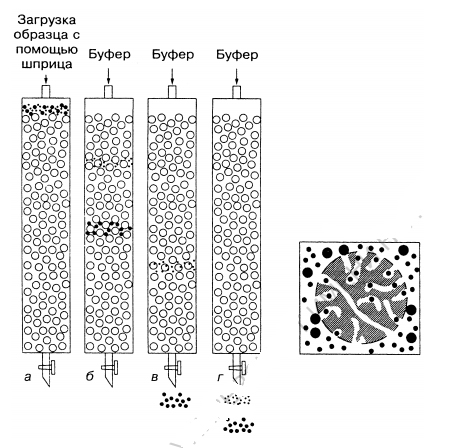 Гель-фильтрация. Этот тип хроматографии является вариантом размерно-эксклюзионной хроматографии, т.е. основанной на исключении по размеру. В ней отсутствует притяжение между неподвижной фазой (гелем) и растворенным веществом. При прохождении раствора образца сквозь пористый гель разделение молекул происходит по их размеру. Чем молекулы меньше, тем легче они проникают через поры внутрь гранул геля и поэтому дольше задерживаются там. Путь прохождения ими через колонку получается более длинным, чем у более крупных молекул. Крупные макромолекулы не могут проходить в поры геля и не задерживаются в гранулах, а протекают между ними. Путь и время прохождения через колонку большими молекулами гораздо короче (рис.4). Гель-фильтрация. Этот тип хроматографии является вариантом размерно-эксклюзионной хроматографии, т.е. основанной на исключении по размеру. В ней отсутствует притяжение между неподвижной фазой (гелем) и растворенным веществом. При прохождении раствора образца сквозь пористый гель разделение молекул происходит по их размеру. Чем молекулы меньше, тем легче они проникают через поры внутрь гранул геля и поэтому дольше задерживаются там. Путь прохождения ими через колонку получается более длинным, чем у более крупных молекул. Крупные макромолекулы не могут проходить в поры геля и не задерживаются в гранулах, а протекают между ними. Путь и время прохождения через колонку большими молекулами гораздо короче (рис.4).
Рис.4. Гель-фильтрационная хроматография. Малые молекулы в образце
могут проникать внутрь гранул, вследствие этого они протекают через
колонку медленнее. Крупные молекулы, которые не могут проникнуть в
гранулы через поры, проходят сквозь колонку быстрее, чем более мелкие.
Правильный размер пор и свойства растворителя являются решающими для
хорошего разделения.
Наиболее широкое распространение имеет гель-фильтрация на сефадексах. Сефадекс представляет собой полусинтетический сорбент полисахаридной природы, гранулы которого обладают порами определенного размера, так что диффузия внутрь этих гранул возможна только для молекул, величина которых не превышает величину пор. Поэтому сефадекс работает как своего рода «молекулярное сито», задерживающее проникающие внутрь гранул низкомолекулярные вещества и не задерживающее полимеры. Существует набор сефадексов, различающихся величиной пор. Перспективно использование сефадексов для разделения высоко и низкомолекулярных осколков, образующихся при расщеплении макромолекул различными реагентами, а также для выделения полисахаридов из различных природных источников.
Хроматография на модифицированных сефадексах, обладающих ионообменными свойствами, например на ДЭАЭ-сефадексе, может служить эффективным приемом фракционирования полисахаридов. Гель фильтрационная хроматография является так же вспомогательным методом оценки молекулярной массы молекул (рис.5).
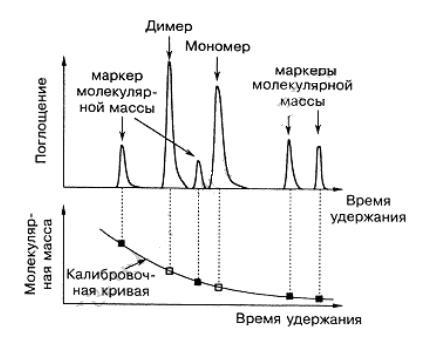
Рис.5. Использование гель-фильтрации для определения молекулярной
массы молекул. Молекулы с известной молекулярной массой дают
возможность оценить молекулярную массу неизвестной молекулы. В данном
примере для исследуемой молекулы наблюдаются два пика, что указывает на
равновесие мономер-димер.
Несмотря на то, что для определения молекулярной массы полимеров существуют гораздо более точные методы, например массспектроскопия, гель-фильтрация оказывается чрезвычайно информативной для определения молекулярной массы и молекулярномассового распределения олиго- и полисахаридов, а также полезной для измерения равновесий мономер-димер при микромолекулярных (мкМ) концентрациях биомолекул.
2.5. Электрофорез
Электрофорез является важным методом разделения смесей полисахаридов, хотя широкому его использованию препятствует трудность подбора условий эффективного разделения.
Для анализа смесей кислых полисахаридов применяется электрофорез в аппарате Тизелиуса. Таким путем, например, отделяют сульфатированные полисахариды водорослей от полиуронидов.
Разделение нейтральных полисахаридов проводят в боратном буфере в условиях, при которых полисахариды различаются способностью образовывать комплексы с борной кислотой. Таким способом удалось отделить маннан от глюкана. Боратный буфер используют и для электрофореза полисахаридов на бумаге. Однако в этом случае возникают трудности, связанные с обнаружением полисахаридов и их взаимодействием с целлюлозой. Для преодоления этих трудностей в качестве носителя может быть использована бумага из стекловолокна. В качестве электролита в данном случае используют 2 Н раствор едкого натра.
Для обнаружения полисахаридов используют реактив Молиша или щелочной раствор перманганата калия. Данным методом была установлена гетерогенность многих препаратов полисахаридов, например, ряда галакто- и глюкоманнанов, пентозанов.
2.6. Ультрацентрифугирование
Как и электрофорез, ультрацентрифугирование сравнительно редко используется для препаративного выделения индивидуальных полисахаридов. Наиболее часто используют аналитический вариант ультрацентрифугирования.
Седиментационная кривая для смеси полимеров в общем случае представляет собой серию пиков, каждый из которых соответствует концентрационному скачку в центрифужной ячейке, т. е. границе оседания присутствующего вещества. По числу пиков судят о числе компонентов исследуемой смеси. В случае одного пика его несимметричность может указывать на наличие примесей; ширина пика определяется степенью полидисперсности вещества. Данные ультрацентрифугирования могут использоваться не только для оценки гомогенности исследуемого препарата, но и для определения молекулярной массы полимера.
Получение среднемолекулярной фракции декстрана
Для выделения нужно предварительно избавиться от других компонентов раствора. Если интересующий полисахарид находиться во внеклеточном пространстве, то необходимо избавится от клеток, сделать это можно при помощи центрифугирования; если полисахарид находиться внутри клеток, то необходимо разрушить клетки и очистить раствор от ненужных клеточных компонентов, необходимо инактивировать ферменты, опасные для продукта, а также разрушить нуклеиновые кислоты для этих целей можно применить ферментативные. От крупных компонентов можно избавиться путем центрифугирования.
Для выделения среднемолекулярной фракции декстрана можно воспользоваться фракционным осаждением как наиболее популярным и простым методом для выделения среднемолекулярной фракции декстрана. Для это к растворенной смеси полисахаридов порционно приливают осадитель. В результате высокомолекулярные полисахариды выпадают в осадок первыми, затем выпадают среднемолекулярные соединения, а после низкомолекулярные. Проблема данного метода в том, что каждая фракция соответствует определенному объему растворителя. Для того, что выделить определенную фракцию необходимо точно знать нужный объем осадителя. Для выделения среднемолекулярной фракции нужно предварительно отделить высокомолекулярную фракцию при помощи осаждения и центрифугирования. Далее можно также при помощи центрифугирование, чтобы отделить среднемолекулярную фракцию. Обычно подобной очистки недостаточно для выделения индивидуального вещества, обязательно в среднемолекулярной фракции будут примеси.
После фракционного осаждения можно применить более тонкие методы разделения, например, хроматографические методы. В частности, можно использовать гель-фильтрацию, чтобы выделить индивидуальные вещество без примесей.
Список литературы
1. Шиповская А.Б. Методы выделения и физико-химические свойства природных полисахаридов: Учебно-методич. пособие. – Саратов: Саратовск. госуниверситет, 2015. – 64 с.: ил.
2. Новиков Д.А. Выделение и очистка продуктов биотехнолгии. Методическое пособие. – Минск.: БГУ, 2014. – 256 с |
|
|
 Скачать 465.32 Kb.
Скачать 465.32 Kb.




