Билет 13. Виды хроматографии классифицируют по особенностям процесса разделения
 Скачать 22.38 Kb. Скачать 22.38 Kb.
|
0.5 масс.-% примесей. Хроматография, история открытия, виды. Бумажная хроматография. Колоночная, ионообменная хроматография. Тонкослойная хроматография. Газовая и газо-жидкостная хроматография. агрегатное состояние неподвижной (сорбент) и подвижной (элюент) фазы: газовая, жидкостная, флюидная, полифазная; природа взаимодействия сорбента (удерживающее вещество) и сорбата, сорбтива (удерживаемое вещество): адсорбционная, ионообменная, распределительная, осадочная; способ введения элюента: фронтальная, вытеснительная, проявительная; техника проведения (капиллярная, колоночная, на бумаге); цели хроматографирования (аналитическая, препаративная, промышленная). Газовая хроматография — это вид хроматографического анализа, где в качестве элюента выступает газообразное вещество или пар. На сегодняшний день выделяют следующие категории: Газоадсорбционная. В этом случае в качестве неподвижной фазы выступает твердое вещество. Газожидкостная. В роли неподвижной фазы выступает жидкость. Хроматографический анализ проводится при помощи газового хроматографа. Поступление газа-носителя осуществляется из баллона повышенного давления в блок носителя (здесь же происходит дополнительная очистка газа). От исследуемой смеси отбирают пробу, которая при повышенной температуре вводится в газовый поток через резиновую мембрану. Введение пробы возможно также и посредством автоматических систем ввода — самплеров. Далее происходит испарение жидкой пробы и перенесение ее в колонку хроматографа потоком газа. Разделение осуществляется при температуре 200–400 градусов, но в ряде случаев возможно дифференцирование при более низких температурных показателях. Разделенные в потоке газа компоненты поступают в дифференциальные детекторы, регистратор фиксирует изменения во времени, и на основании полученных данных, вырисовывается хроматограмма. На примере равновесия в системе «раствор – осадок» показать условия образования осадка, познакомиться с видами осадков, а также факторами, влияющие на полноту осаждения. Образование осадков является сложным физико-химическим процессом, закономерности протекания которого раскрыты не полностью. Образование незагрязненных крупнокристаллических осадков является необходимым условием получения точных результатов в гравиметрическом анализе. Крупнокристаллические осадки получаются более чистыми, чем мелкокристаллические или аморфные, так как имеют менее развитую поверхность и поэтому адсорбируют меньше примесей и, кроме того, крупнокристаллические осадки могут забивать поры фильтра и тогда скорость фильтрования падает практически до нуля. К форме осаждения предъявляются следующие основные требования: - осадок должен быть малорастворим, т.е. осаждение должно быть достаточно полным; - полученный осадок должен бить чистым и легко фильтрующимся. Необходимо также, чтобы из формы осаждения легко получалась гравиметрическая форма. Решающее влияние на полноту осаждения и свойства осадков оказывают следующие условия: - концентрация (количество) осадителя; - температура; - концентрация посторонних солей. Определить содержание оксида железа (III) в образце, если его навеска массой 1,0000 г после растворения и восстановления железа оттитрована 38,4 мл раствора KMnO4 с Т(KMnO4 /Fe)=0,0001100 г/мл. оксид железа (III) - 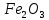 5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O MnO4- + 8H+ + 5e → Mn2+ + 4H2O => 1/5,KMnO4 Fe2+ - e → Fe 3+ => 1/1,Fe2+ Это уравнение и баланс. (1/5*KMnO4)=T*1000/M(1/5*KMnO4)=0,0001100*1000/(158,03/5)=0,003480 m(Fe2+)=C(1/5*KMnО4)*V(KMnO4)*M(1/1*Fe2+)/1000=0,003480*38,4*55,85/1000=0,007464 г Пересчет на Fe2O3 m(Fe2O3)=0,007464*159,7 / (2*55,85)=0,01067 г w=0,01067*100/1=1.07% Конец формы |
