Внутреннее строение и свойства металлов и сплавов
 Скачать 5.7 Mb. Скачать 5.7 Mb.
|
Филиал “НАЦИОНАЛЬНОГО ИССЛЕДОВАТЕЛЬСКОГО УНВЕРСИТЕТА”“МЭИ” в Г.Ташкенте “Э “Конституционное материаловедение” Тема” Внутреннее строение и свойства металлов и сплавов” лектротехническое материаловедение” На тему СТРОЕНИЕ И СВОЙСТВА МЕТАЛЛОВ И СПЛАВОВ Выполнил: студент “гр 4-21ЭЭ”Проверила Иванова В.ПСодержание Введение 1. Общие сведения о металлах. Металлическое состояние вещества. Атомно-кристаллическое строение металлов . Строение реальных металлов . Методы исследования металлов . Свойства металлов . Плавление и кристаллизация металлов .1 Энергетические условия процесса кристаллизации .2 Механизмы процесса кристаллизации . Форма кристаллов. Строение металлического слитка . Строение сплавов . Диаграммы состояния сплавов .1 Диаграмма состояния сплавов, компоненты которых практически нерастворимы в твердом состоянии (диаграмма 1го рода) .2 Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (2 города) .3 Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (3 города) .4 Диаграмма состояния сплавов, компоненты которых образуют химическое соединение (диаграмма 4-го рода) .5 Диаграммы состояния сплавов, претерпевающих превращения в твердом состоянии .6 Связь между свойствами сплавов и типом диаграммы состояния . Железоуглеродистые сплавы .1 Компоненты и фазы железоуглеродистых сплавов .2 Диаграмма состояния «железо-цементит» Литература Введение Металлы - наиболее распространенные и широко используемые материалы в производстве и в быту человека. Особенно велико значение металлов в наше время, когда большое их количество используют в машиностроительной промышленности, на транспорте, в промышленном, жилищном и дорожном строительстве, а также в других отраслях народного хозяйства. Термин «металл» произошёл от греческого слова metallon (от metallйuф - выкапываю, добываю из земли), которое означало первоначально копи, рудники (в этом смысле оно встречается у Геродота, 5 в. до н. э.). То, что добывалось в рудниках, Платон называл metalleia. В древности и в средние века считалось, что существует только 7 металлов: золото, серебро, медь, олово, свинец, железо, ртуть. По алхимическим представлениям, металлы зарождались в земных недрах под влиянием лучей планет и постепенно крайне медленно совершенствовались, превращаясь в серебро и золото 1. Общие сведения о металлах. Металлическое состояние вещества. Атомно-кристаллическое строение металлов Металлы представляют собой однокомпонентную систему. Сплавы представляют собой систему, состоящую из двух и более компонентов. Из всех элементов системы Менделеева 82 элемента относятся к металлам, кроме того, некоторые элементы представляют собой промежуточные вещества между металлами и неметаллами. Например, Si, As, Te. Металлы обладают рядом характерных особенностей: . Металлический блеск. . Непрозрачность. . Высокие тепло- и электропроводность. . Способность к термоэлектронной эмиссии. . Положительный коэффициент электросопротивления и т.п. Это определяет металлические свойства вещества. Металлические сплавы обладают теми же свойствами, что и металл. Металлическое состояние обусловлено особенностями атомно-кристаллического строения металлов. По современным представлениям, атом представляет сложную систему, состоящую из положительно заряженного ядра, вокруг которого на разном расстоянии вращаются отрицательно заряженные электроны. Их количество определяется числом заряда ядра. Электроны на внешней оболочке - валентные. Они наиболее слабо связаны с ядром. У металлов валентных электронов от 1 до 3. Характерна весьма слабая связь валентных электронов металлов с ядром, значительно меньше, чем у неметаллов. Вследствие слабой связи валентных электронов с ядром электроны могут достаточно легко переходить с внешней оболочки одного атома на внешнюю оболочку другого атома. Такие электроны не принадлежат одному конкретному атому и получили название коллективизированных электронов. Совокупность атомов металла можно представить положительными ионами, которые совершают колебания относительно некоторых устойчивых центров, и перемещающимися между ними коллективизированными электронами. По свойствам эти электроны подобны частицам в газе, поэтому их часто называют электронным газом. Количество коллективизированных электронов у различных металлов различно. Это и определяет различные свойства металлов. Между коллективизированными электронами и ионами металла существуют электростатические силы взаимодействия. Эти силы не носят направленного характера. Это определяет особый тип связи - металлический. Металл в твёрдом состоянии характеризуется определённой закономерностью расположения атомов (ионов) в пространстве, то есть для металла характерно в твёрдом состоянии кристаллическое строение - наличие пространственной кристаллической решетки, в узлах которой располагаются атомы (ионы). Кристаллическая решетка состоит из ряда параллельных кристаллографических плоскостей, расположенных на определённом расстоянии друг от друга. Наименьший комплекс атомов, который при многократном повторении в пространстве образует кристаллическую пространственную решетку, называется элементарной кристаллической ячейкой и определяет тип кристаллической решётки. Для металлов характерны 3 основных типа решётки: Кубическая объемно-центрированная решётка (О.Ц.К.). Содержит 9 атомов. Такую решётку имеют: Li, Na, K, Ba, Cr, Mo, W, V, Fe > при температуре выше 1392 0С и ниже 911 0С. Кубическая гранецентрированная решётка (Г.Ц.К.). Содержит 14 атомов. Такую решётку имеют: Ag, Au, Pt, Cu, Al,, Fe > при температуре 911…1392 0С. Гексагональная плотноупакованная решётка (Г.П.У.). Содержит 17 атомов. Такую решётку имеют: Mg, Ti, Zn, Y, Be, La. Размеры элементарных ячеек характеризуются расстояниями между центрами соседних атомов, которые называют параметрами или периодами решеток: для О.Ц.К. и Г.Ц.К. решёток это длина ребра а; для Г.П.У. это длины рёбер с и а Кристаллическая решётка характеризуется рядом величин: . Базис решётки - определяется числом целых атомов, принадлежащих только одной ячейке: Для О.Ц.К. решётки базис равен 2, Г.Ц.К. - 4, Г.П.У. - 6. . Координационное число - определяется числом атомов, находящихся на равном ближайшем расстоянии от одного атома. Координационное число О.Ц.К. решётки равно 8, Г.Ц.К. - 12, Г.П.У. - 12. 3. Плотность упаковки решётки - это отношение объёма, занятого атомами, к объёму элементарной ячейки: для О.Ц.К. решётки плотность упаковки равна 0,68; Г.Ц.К. и Г.П.У. - 0,74. . Индексы плоскостей. Плоскости решётки обозначаются рациональными числами, являющимися обратными от длины отрезков, отсекаемых на осях координат. . Индексы направлений в плоскостях - обозначаются координатами любой точки на прямой, проходящей через начало координат, параллельно данному направлению. Для кристаллических тел характерно явление анизотропии - неравномерности свойств в различных направлениях. Связано это с различным числом атомов в различных направлениях. Явление анизотропии чётко проявляется в пределах монокристалла, но т.к. металл - поликристаллическое вещество, то для них свойственно состояние квазиизотропности (условной однородности свойств). Для некоторых металлов характерно также явление аллотропии - явление изменения типа кристаллической решётки в зависимости от внешних условий (температуры и давления), но для металла большее значение имеет температура. Температурные формы кристаллической решётки называются аллотропическими модификациями и обозначаются буквами греческого алфавита: a, b, g, d. Например железа: Fe (жидкое) при t=1539 0С ® Fed (твёрд.) (О.Ц.К.) при t=1392 0С ®Feg (Г.Ц.К.) при t=9110С®Feb (О.Ц.К.) при t=768 0С ® Fea(О.Ц.К.) металл кристаллизация сплав железоуглеродистый 2. Строение реальных металлов Металлы, как и любое кристаллическое тело, имеют дальний порядок расположения атомов, т.е. закономерность расположения атомов сохраняется в любом объёме металла. Детальное рассмотрение реальных металлов показывает, что эта закономерность может нарушаться, т.е. кристаллические решётки реальных металлов имеют дефекты (несовершенства). Дефекты решёток могут быть трёх типов: точечные, линейные, поверхностные. К точечным дефектам относятся вакансии (отсутствие атома в узле решётки - дислоцированные атомы (атомы, перешедшие в межузловое пространство) и примесные атомы (атомы, внедрённые в решётку металла и которые отличаются по размерам от атомов данного металла. Эти дефекты приводят к нарушениям (искажениям) решётки. Образование точечных дефектов связано с тепловым движением атомов. Источником вакансий может служить испарение атомов с поверхности металла. К линейным дефектам относятся дислокации краевые и винтовые. Возникновение дислокации можно представить, например, в результате частичного сдвига при деформировании кристалла. При этом образуется прерванная кристаллографическая плоскость (экстраплоскость), край которой представляет краевую дислокацию АВ. В области дислокации нарушается порядок расположения атомов. Количество дислокаций в металле значительно увеличивается при пластической деформации. Поверхностные дефекты имеют заметные размеры в двух направлениях. К ним относятся границы кристаллов, фрагментов, блоков (части кристаллов, имеющие различную ориентировку), а также поверхность тела. 3. Методы исследования металлов Существует несколько групп методов исследования металлов. . Химические методы исследования (определение химического состава). . Структурные методы исследования. Структура - внутреннее строение металла или сплава: форма, размеры, расположение кристаллов. Различают макроструктуру и микроструктуру. Макроструктура металла - строение металла, видимое невооружённым глазом или при небольшом увеличении в 20…40 раз. Микроструктура наблюдается при увеличении в 50…100000 раз. Макроструктура изучается с помощью макроструктурного анализа на макрошлифах. С помощью макроанализа можно определить характер излома, размеры, форму, расположение кристаллов металла, поверхностные дефекты (раковины, трещины), химическую неоднородность (ликвацию). Микроструктурный анализ служит для изучения микроструктуры. При увеличении в 50…2000 раз с помощью оптического микроскопа можно изучать элементы структуры размером до 0,2 мкм: отдельные зёрна, фазы, неметаллические включения. Для изучения более мелких структурных составляющих применяется электронный микроскоп, который позволяет исследовать структуру при увеличении до 100000 раз. Электронный микроскоп позволяет изучать дефекты кристаллического строения: дислокации, скопление вакансий и т.д. Рентгеноструктурный анализ позволяет исследовать атомно-кристаллическую структуру металла: степень несовершенства кристаллов (плотность дислокаций), тип и параметры решёток, величину микронапряжений. . Физические методы исследования. Термический анализ - определение тепловых эффектов фазовых превращений. Дилатометрический анализ - регистрация линейных и объёмных изменений, связанных с внутренними превращениями металла. Электрические и магнитные методы анализа - измерение электрических и магнитных величин, связанных с превращениями в металлах. 2. Механические методы исследования (испытания). Состоят в нагружении металла различными силами. По характеру нагрузки они бывают статические (нагрузка постоянная или медленно возрастающая), динамические (нагрузка изменяется по величине с большой скоростью), знакопеременные (нагрузка с определённым циклом изменяется по величине и направлению). Механические испытания служат для определения механических свойств. 4. Свойства металлов Различают следующие свойства металлов: Физические - температура плавления, тепло- и электропроводность, электросопротивление, плотность, коэффициенты объемного и линейного расширения и сжатия. Химические - химическая активность, способность взаимодействовать с различными средами, устойчивость к коррозии. Технологические - литейные свойства, ковкость, свариваемость, обрабатываемость. Эксплуатационные - теплостойкость, жаропрочность, износостойкость и др. Механические - прочность, пластичность, вязкость, твёрдость, выносливость. Механические свойства определяются в результате механических испытаний металла различными нагрузками. Наиболее распространены испытания металла на растяжение статическими нагрузками. При действии на тело внешней силы в теле возникают напряжения, величина которых является мерой сопротивления металла действию силы. По роду действия внутренние напряжения могут быть трёх видов: . Напряжения первого рода (макронапряжения), которые действуют в объёме всего металла. . Напряжения второго рода (микронапряжения), действующие в объёме кристалла. . Напряжения третьего рода (субмикроскопические), действующие в пределах решётки. Под действием напряжений в теле возникают деформации - изменение размеров и формы тела. Деформации бывают: . Упругие - которые после исчезновения нагрузки исчезают. . Пластические (остаточные) - которые сохраняются после исчезновения нагрузки. При статических испытаниях металла на растяжение определяются характеристики прочности и пластичности металлов. Прочность - способность металла сопротивляться деформации и разрушению под действием силы. Сопротивление тела действию на него силы определяется величиной напряжения, поэтому напряжение является характеристикой прочности металла. Пластичность - способность металла к необратимому изменению размеров и формы под действием внутренних или внешних сил без разрушения. Характеристикой пластичности металла является величина деформации. При испытаниях металла на растяжение разрывная машина рисует диаграмму растяжения металла в координатах «нагрузка - удлинение». При нагрузке, соответствующей начальной части диаграммы, материал испытывает только упругую деформацию. До точки а (прямолинейный участок) эта деформация пропорциональна нагрузке или действующему напряжению, которое определяется как s=Р/F0, МПа, где Р - нагрузка, Н; F0 - начальная площадь поперечного сечения образца, мм2. Прямолинейную зависимость между напряжением и деформацией выражает закон Гука: s = Еε, где Е - модуль упругости, МПа (характеристика материала); ε=(Δl/l0)×100% - относительная деформация; Δl - абсолютное удлинение, мм; l0 - начальная длина образца, мм. Участок а-с соответствует появлению в металле пластической деформации (отклонение от прямой линии). Горизонтальный участок c-d - площадка текучести, при этом деформация растёт при постоянной нагрузке. Предел текучести (первая характеристика прочности) - наименьшее напряжение, при котором образец деформируется без заметного увеличения нагрузки: sт=РТ/F0, МПа, где РТ - нагрузка, соответствующая площадке текучести. Дальнейшее повышение нагрузки вызывает рост пластической деформации во всём объёме металла (участок d-б). В точке б нагрузка достигает максимального значения. Предел прочности (вторая характеристика прочности) - напряжение, соответствующее максимальной нагрузке, предшествующей разрушению: sВ=РВ/F0, МПа, где РВ - наибольшая нагрузка, которую выдерживает образец до разрушения. На участке б-к в наиболее слабом месте начинается образование сужения поперечного сечения - шейки, деформация сосредоточивается на одном участке - из равномерной переходит в местную. В связи с этим нагрузка падает, и в точке к при нагрузке РК происходит разрушение образца. При испытании на растяжение определяются также характеристики пластичности. К ним относятся относительное удлинение и относительное сужение. Относительное удлинение:  , , где l0 и l1 - базовая длина образца до и после испытаний. Относительное сужение:  , , где F0 - начальная площадь поперечного сечения образца; 1 - площадь сечения образца в месте разрушения. Существуют также динамические испытания металла на ударный изгиб, с помощью которых оценивается прочность при динамических нагрузках. Наиболее часто испытывают образцы с надрезом. Характеристикой прочности при динамических нагрузках служит величина ударной вязкости: КС=А/FН, МДж/м 2, где А- работа, затрачиваемая на разрушение образца, МДж; Н - площадь сечения образца в месте надреза, м2. Твердость - способность материала сопротивляться проникновению в него другого тела, не получающего остаточной деформации. Существует три основных способа определения твердости: По Бринеллю. Заключается во внедрении в испытуемое тело стального закаленного шарика. 2 По Роквеллу. Основан на вдавливании стального закаленного шарика или алмазного конуса. 3 По Виккерсу. Заключается во вдавливании в испытуемую поверхность алмазной пирамиды. . Плавление и кристаллизация металлов При нагреве или охлаждении металла переход из одного состояния в другое происходит с возникновением или разрушением кристаллической решётки и сопровождается тепловым эффектом. Вследствие этого металлы переходят из одного состояния в другое при постоянных температурах, и на кривых охлаждения или нагрева наблюдаются температурные остановки (см. рис.1). Тпл - температура плавления металла; Ткр - температура кристаллизации металла. Участки 1-2 и 4-5 - переход металла из одного состояния в другое. В т.1 происходит разрушение кристаллической решётки. На участке 1-2 вся тепловая энергия идёт на её разрушение. Металл переходит из твёрдого состояния в жидкое - процесс плавления. При этом увеличивается объём металла на 2…6% за счёт увеличения расстояния между атомами, силы взаимодействия при этом между атомами гораздо меньше, чем в твёрдом металле. 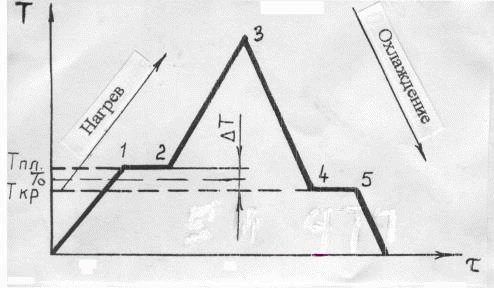 Рисунок 1 Для жидкости характерен ближний порядок, когда упорядоченное расположение атомов распространяется на небольшое расстояние. Этот порядок неустойчив. При температурах, близких к температуре плавления, в жидком металле наблюдаются области, в которых расположение атомов, близко к расположению атомов в твёрдом кристаллическом теле. Эти области называются фазовыми флуктуациями. Наиболее крупные флуктуации при определённых условиях могут стать зародышами кристаллов (центрами кристаллизации). Чтобы начался процесс кристаллизации необходимо переохладить металл ниже температуры плавления. ∆Т= Тпл -Ткр - тепловой гистерезис (несовпадение температуры плавления и температуры кристаллизации). Величина переохлаждения определяется природой металла, наличием примесей в металле, скоростью охлаждения (рис. 2). Если примесей мало, то металл надо значительно охладить. 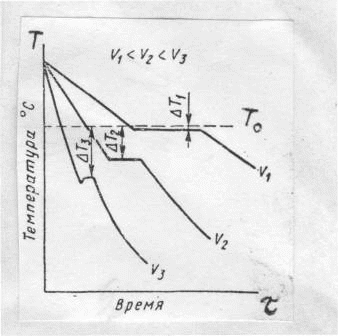 Рисунок 2 Переход металла из жидкого состояния в твёрдое (процесс кристаллизации) связан с возникновением кристаллической решётки. Этот процесс происходит при постоянной температуре, что обусловлено выделением скрытой теплоты кристаллизации (участок 4-5 на рис. 1). .1 Энергетические условия процесса кристаллизации В природе все процессы идут в сторону уменьшения энергии системы. Состояние системы определяется особой функцией - свободной энергией. F = U - TS, где F - свободная энергия системы;- внутренняя энергия системы; Т - температура;- энтропия. С увеличением температуры свободная энергия жидкого Fж и твёрдого Fтв тела уменьшается (рис. 3). 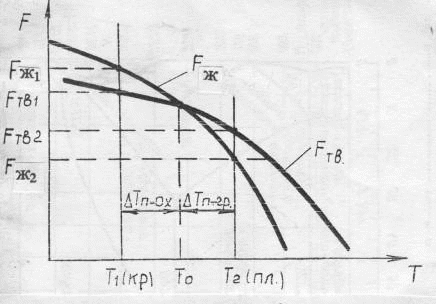 Рисунок 3 При Т0 Fтв = Fж - энергетически равноценны твёрдое и жидкое состояние вещества. Поэтому процессы плавления и кристаллизации происходить не будут (динамическое равновесие). При Т1 Fтв1 < Fж1 - энергетически выгодно твердое состояние. При Т2 Fж2 < Fтв2 - энергетически выгодно жидкое состояние. Для начала кристаллизации вещество необходимо охладить ниже Т0, а для плавления нагреть выше Т0. ∆ Тпереохлажд.=Т0-Т1 - степень переохлаждения, ∆ Тперегрева.=Т2-Т0 - степень перегрева. .2 Механизмы процесса кристаллизации Возникновение кристаллов на базе крупных фазовых флуктуаций в жидкостях называется самопроизвольным (спонтанным) процессом кристаллизации. Он состоит из двух элементарных процессов. . Возникновение зародышей кристаллов (центров кристаллизации). . Рост кристаллов из центров кристаллизации. . Вокруг образовавшихся центров начинают расти кристаллы [6, рис. 9]. Растут кристаллы послойно, при свободном росте они имеют правильную геометрическую форму с плоскими гранями. При соприкосновении кристаллов правильная форма нарушается. Кристаллы неправильной формы называются зёрнами. В процессе кристаллизации возникают зародыши различной величины. Не любой зародыш способен к росту. Рост зародыша возможен только при условии, что он достиг определённой величины. Зародыш будет расти, если это приведёт к уменьшению свободной энергии системы. Изменение свободной энергии тела в зависимости от размера образовавшегося кристаллического зародыша приведено на рис.4. 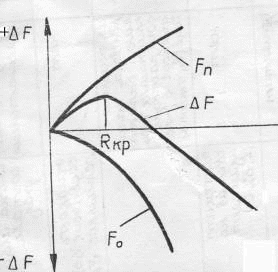 Рисунок 4 Свободная энергия системы при образовании зародыша, с одной стороны, уменьшается на величину F0 (объёмная энергия) вследствие перехода некоторого объёма жидкого металла в твёрдый, а с другой - возрастает на величину Fn (поверхностная энергия) в результате образования поверхности раздела. Суммарное изменение свободной энергии DF представляет кривую с максимумом при некотором определённом значении размера зародыша R=RКР. Минимальный размер зародыша, способного к росту, RКР называется критическим размером зародыша, а такой зародыш - устойчивым. Величина критического зародыша зависит от величины переохлаждения. Чем больше величина переохлаждения, тем меньше размер устойчивого зародыша. Величина переохлаждения влияет на скорость зарождения кристаллов, а также и на скорость роста кристаллов (рис. 5). 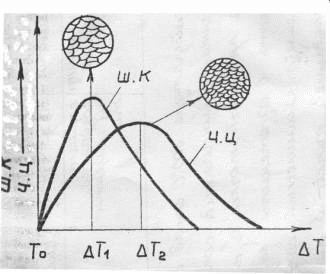 Рисунок 5 С.К. - скорость роста кристаллов; Ч.Ц. - число центров кристаллизации. При увеличении переохлаждения до ∆Т1 наблюдается преимущественно увеличение скорости роста кристаллов, это приводит к возникновению крупных по величине кристаллов. Дальнейшее увеличение степени переохлаждения до ∆Т2 приводит к увеличению числа центров кристаллизации. Получение мелкозернистой структуры металла достигается на практике увеличением скорости охлаждения металла. Самопроизвольное зарождение кристаллов в жидком металле весьма затруднительно. В реальных условиях в металле находится значительное количество примесей в виде не растворившихся частиц (оксиды, карбиды, нитриды). Эти частицы примесей при определённых условиях могут служить готовыми зародышами кристаллов. Для этого они должны быть изоморфны, т.е. иметь тип и параметры кристаллической решётки и размеры атомов, близкие к характеристикам металла. Для получения мелкозернистой структуры металла примеси (модификаторы) могут специально вводиться в металл. Различают модификаторы двух видов: 6. Форма кристаллов. Строение металлического слитка Как правило, возникший в жидкости кристалл растёт в первую очередь в направлении минимального расстояния между атомами. Таким образом, в первую очередь вырастают оси первого порядка. Одновременно под определённым углом к оси первого порядка начинают расти оси второго порядка, от которых растут оси третьего порядка и т.д. В итоге вырастают кристаллы древовидной формы, получившие название дендритов. В зависимости от скорости охлаждения и условий теплоотвода их размеры и форма могут быть различны (могут быть равноосными или столбчатыми). Металлический слиток образуется при кристаллизации металла в изложнице. Как правило, структура литого слитка состоит из трёх основных зон. - поверхностный слой равноосных кристаллов, образованных в условиях высокой скорости охлаждения металла при соприкосновении жидкого металла с холодными стенками изложницы. - зона столбчатых кристаллов с развитой осью первого порядка (транскристаллитов), образованных в условиях пониженной скорости охлаждения и перпендикулярном стенкам изложницы теплоотводе. - зона крупных неориентированных равноосных кристаллов, образованных в условиях наименьшей скорости охлаждения и ненаправленного теплоотвода. В верхней части слитка расположена концентрированная усадочная раковина - полость, не заполненная металлом, образованная вследствие объёмной усадки металла при кристаллизации 4. Также вследствие объёмной усадки по оси слитка образуется рыхлость. В слитке под усадочной раковиной и в донной части наблюдается заметное повышение содержания примесей: C, S, Р (ликвирующих). Это приводит к падению механических свойств. 7. Строение сплавов В технике чаще применяются не металлы, а металлические сплавы, так как они имеют лучший комплекс свойств по сравнению с металлом. Сплавы получают сплавлением элементов, спеканием (порошковая металлургия), диффузией. Металлический сплав - сложная система на основе металла. Сплавы содержат два и более компонентов. Фазой сплава называется однородная часть сплава, отделенная от других границей раздела, при переходе через которую состав или структура резко изменяются. Меняются и свойства. Металл в жидком состоянии представляет собой однородную фазу. То же касается и сплавов. При кристаллизации металла образуется новая твердая фаза. При этом металл находится в двухфазном состоянии - в жидком и твердом. В сплаве твердой фазой могут быть зерна чистого металла, твердого раствора, химического соединения. В расплавленном состоянии многие металлы неограниченно растворимы друг в друге. При кристаллизации компоненты сплава могут иметь различный тип взаимодействия, что определяет образование различных видов сплавов. Различают три основных вида сплавов, образующихся при кристаллизации двух компонентов. 1 Механические смеси 2 Твердые растворы Химические соединения Механические смеси образуются, если компоненты растворимы в жидком и практически нерастворимы в твердом состоянии. Строение этих сплавов неоднородное - двухфазное. Такой сплав имеет два типа кристаллической решетки: решетку компонента А и решетку компонента В. Такие сплавы образуют элементы, значительно отличающиеся по свойствам. Твердые растворы образуются в случае взаимной растворимости компонентов как в жидком так и в твердом состоянии. При этом один компонент (которого больше) сохраняет свою кристаллическую решетку, второй компонент в виде отдельных атомов располагается в решетке первого. Первый компонент называется растворителем, второй - растворимым. Твердые растворы имеют однородное (однофазное) строение с решеткой растворителя. Различают твердые растворы внедрения и замещения. В первом случае атомы растворимого проникают в межузельное пространство решетки растворителя. Эти сплавы образуют металл с неметаллами, имеющими малые атомные радиусы (H, N, C, B). Эти элементы образуют ограниченные растворы, не превышающие 1…2%. В твердых растворах замещения атомы растворимого располагаются в узлах решетки растворителя, замещая его атомы. Эти растворы могут быть как неограниченной растворимости, так и ограниченной. Неограниченные твёрдые растворы образуют изоморфные компоненты (имеющие близкие по типу и параметрам кристаллические решётки), атомные радиусы которых отличаются не более чем на 8…15%. Растворимое занимает, как правило, произвольные места в узлах решетки растворителя, образуя неупорядоченные твердые растворы. В то же время при снижении температуры может наблюдаться перераспределение атомов растворимого с образованием упорядоченных твердых растворов. Структура таких растворов называется сверхструктурой, и они рассматриваются как промежуточные между твердыми растворами и химическими соединениями. Химические соединения образуются в случае химического взаимодействия компонентов при кристаллизации. При этом строго определенное число атомов компонента А взаимодействует химически с определенным числом атомов компонента В, образуя одно химическое соединение типа A nB m. Химические соединения имеют ряд особенностей: соединение имеет свой тип кристаллической решетки, отличной от решеток компонентов; свойства соединений отличны от свойств компонентов; разложение соединения (диссоциация) происходит при постоянной температуре. Кроме названных типов сплавов, существуют еще множество промежуточных фаз сплавов, которые не могут быть полностью отнесены ни к одному из названных типов. Исследование сплавов производится на основе диаграмм состояния сплавов. 8. Диаграммы состояния сплавов Диаграмма состояния - это графическое изображение равновесных состояний сплавов рассматриваемой системы в зависимости от температуры и состава. Диаграммы состояния строятся на основе термического анализа сплавов. При этом берутся отдельные сплавы рассматриваемой системы, медленно охлаждаются, и определяется скорость охлаждения (фиксируются температура и время). На основе этого анализа строят кривые охлаждения сплавов. На кривых охлаждения фиксируются температуры превращений сплава - критические точки сплава. Критические точки переносятся в систему координат температура - концентрация, где получают точки пересечения с линиями рассматриваемых сплавов в данной системе координат. Линия сплава - вертикальная линия, проходящая через точку на оси концентрации, соответствующую составу сплава. Линии диаграммы состояния представляют собой геометрическое место критических точек сплавов. Линия АСВ - линия, определяющая геометрическое место точек (температур) начала кристаллизации сплавов - линия ликвидус. Линия DCF - линия, определяющая геометрическое место точек (температур) конца кристаллизации сплавов - линия солидус. Все превращения в сплавах подчиняются общему закону равновесия - правилу фаз, которое выражается следующей зависимостью: С=К-Ф+2, где С - число степеней свободы системы (вариантность) - определяет условие равновесного существования сплава; К - число компонентов сплава; Ф - число фаз, находящихся в равновесии; - внешние параметры, влияющие на систему (температура, давление). С=К-Ф+1, при Р = const. С=0 - равновесие нонвариантное, то есть безвариантное (превращение происходит при постоянной температуре). Это соответствует температурной остановке на кривой охлаждения сплава, кривая охлаждения I - участок 1-1’ - C=1-2+1=0 - кристаллизация металла). С=1 - моновариантное равновесие (превращение происходит в диапазоне температур). Это соответствует перегибу на кривой охлаждения (участок 1-2 на кривой охлаждения II - С=2-2+1=1 - кристаллизация сплава). С=2 - бивариантное равновесие, т.е. равновесие сохраняется при определённом изменении температуры и давления (например, участок 0-1 на кривой охлаждения II - С=2-1+1=2 - охлаждение сплава до начала кристаллизации). .1 Диаграмма состояния сплавов, компоненты которых практически нерастворимы в твердом состоянии (диаграмма 1го рода) Фазы в сплавах:1) жидкость (L); 2) кристаллы А; 3) кристаллы В. Линия АСВ - линия ликвидус - начало кристаллизации сплавов, DCE - линия солидус - конец кристаллизации сплавов. При охлаждении сплавов на линии АС из жидкости начинают выделяться кристаллы А, а на линии СВ - кристаллы В. На линии DCE из жидкости одновременно выделяются кристаллы А и В. В диапазоне между линиями АСВ и DCE (температурный интервал 1-2) сплавы находятся в двухфазном состоянии: жидкость - кристаллы (L+A или L+B). Для двухфазной области диаграммы состояния химический состав существующих фаз при данной температуре и их количество (по массе) можно определить с помощью правила отрезков: если для определенной температуры сплава провести линию, параллельную оси концентрации (коноду) до пересечения с линиями, ограничивающими данную область, то проекции точек пересечения коноды покажут химический состав существующих фаз (точка в’ определяет состав жидкости, а точка q’ - состав кристаллов). При охлаждении сплава данной системы состав жидкости двухфазной области будет изменяться по линии ликвидус от точки 1 до точки С. В диапазоне кристаллизации сплавы данной системы будут иметь постоянный состав твердой фазы (100% В или 100% А); количество каждой из существующих при данной температуре фаз определяется с помощью второго положения правила отрезков (правило рычага). Количество (масса) существующих фаз обратно пропорционально длине отрезков, отсекаемых конодой. Qж - количество жидкости при данной температуре (отрезок aq). кр - количество кристаллов при данной температуре (отрезок ва).сп - количество сплава при данной температуре (отрезок вq). 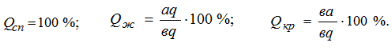 Таким образом, используя правило фаз и правило отрезков, можно выявить особенности кристаллизации любого сплава данной системы. Например, в сплавах I и III кристаллизация начинается в точке 1 и заканчивается в точке 2. В процессе кристаллизации образуются кристаллы А (или В). Интервал 1-2 представляет температурный интервал кристаллизации сплавов, т.е. кристаллизация этих сплавов происходит при уменьшении температуры. Это подтверждается правилом фаз: С1-2 = 2-2+1=1, что соответствует перегибу на кривой охлаждения сплава в точке 1. Состав жидкости при кристаллизации сплавов, согласно правилу отрезков, будет изменяться по линии 1-С. Таким образом, можно заключить, что по достижении температуры, соответствующей линии DCE (точка 2), все сплавы данной системы будут иметь одинаковый состав жидкости (точки С). Линия DCE - линия эвтектического превращения. При этой температуре все сплавы данной системы будут претерпевать эвтектическое превращение, которое заключается в том, что жидкость состава точки С будет кристаллизоваться с образованием двух твердых фаз: кристаллов А и кристаллов В (Ж С ®АD + ВЕ). Образовавшиеся твёрдые фазы составляют мелкодисперсную механическую смесь - эвтектику. Согласно правилу фаз С2-2’ = 2-3+1=0, эвтектическое превращение происходит при постоянной температуре (температурная остановка 2-2’ на кривой охлаждения сплавов). На рисунке [6, рис.13] схематически дано также строение (структура) кристаллизующихся и закристаллизовавшихся сплавов I и III. Показаны первичные выделения кристаллов из жидкости и образование механической смеси кристаллов А + В. Сплав II будет находиться в жидком состоянии до температуры, соответствующей линии DCE. При достижении этой температуры в сплаве будет происходить нонвариантная эвтектическая кристаллизация с образованием эвтектики. Сплав I называется доэвтектическим, сплав II - эвтектическим, а сплав III - заэвтектическим. 8.2 Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (2-го рода) Диаграмма состояния сплавов данной системы изображена на рисунке 1. В этих сплавах возможно существование только двух фаз - жидкого раствора L и твёрдого раствора a. Выше линии ликвидус (AmB) сплавы находятся в жидком состоянии (L), ниже линии солидус (AnB) - в твёрдом (a), между линиями - в двухфазном (L+a). Кристаллизация любого сплава данной системы проходит одинаково: начинается в точке 1 выделением из жидкости кристаллов твёрдого раствора a и заканчивается в точке 2. Диапазон 1-2 - температурный интервал кристаллизации (С1-2=2-2+1=1 - моновариантное превращение). В диапазоне кристаллизации сплавы имеют переменный состав жидкости и кристаллов. Состав жидкости меняется по линии ликвидус от точки 1 до точки i, состав кристаллов меняется по линии солидус от точки S до точки 2. При росте кристалла его состав будет изменяться. Явление неоднородности химического состава кристалла называется внутрикристаллической ликвацией. Ликвация тем больше, чем больше температурный интервал кристаллизации сплава. .3 Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (3-го рода) Различают две разновидности указанных диаграмм: 1 Диаграмма с эвтектикой 2 Диаграмма с перитектикой Рассмотрим первую разновидность. Фазы в сплавах: Жидкость (L). 1 a-твёрдый раствор компонента В в решётке компонента А. 2 b-твёрдый раствор компонента А в решётке компонента В. Линия ECF - линия ликвидус, EDKF - линия солидус, DCK - линия эвтектического превращения, DM и KN - линии предельной растворимости одного компонента в решётке другого. Сплавы между точками D и K будут кристаллизоваться аналогично сплавам первого рода с образованием эвтектики. Сплавы левее точки D и правее точки К кристаллизуются аналогично сплавам второго рода с образованием твёрдого раствора a или b. В диаграмме с перитектикой: CPE - линия ликвидус, CFKE - линия солидус, FKP - линия перитектического превращения, FN и KM - линии предельной растворимости. Сплавы левее т.F и правее т.P кристаллизуются аналогично сплавам второго рода. Сплавы, лежащие между точками F и P, будут претерпевать перитектическое превращение: ЖР + aF ® bК (кристаллы a-твёрдого раствора взаимодействуют с жидкостью, образуя новую фазу - твёрдый раствор b). Для сплавов, лежащих левее т.К, будем иметь избыток a-твёрдого раствора: Ж + a ® b +a изб. Для сплавов, лежащих правее т.К, будем иметь избыток жидкости: Ж + a ® b +Ж изб. Перитектическое превращение происходит при постоянной температуре (С2-2’= 2-3+1=0 - температурная остановка 2-2’ на кривой охлаждения). 8.4 Диаграмма состояния сплавов, компоненты которых образуют химическое соединение (диаграмма 4-го рода) Химическое соединение может быть устойчивым, т.е. не разлагаться до плавления, и неустойчивым, которое разлагается при определённой температуре. В сплавах с химическим соединением фазами являются: 1 Жидкость 2 Компонент А (чистый) Компонент В (чистый) Соединение Аn Вm Устойчивое соединение рассматривается как компонент в диаграмме состояния, поэтому диаграмма состояния с устойчивым химическим соединением рассматривается как сложная, состоящая из двух: А-Аn Вm и В-А n Вm. Устойчивое соединение может по-разному взаимодействовать с компонентами сплавов, образуя различные виды сплавов. В месте соединения двух диаграмм получается точка перелома (точка С) на линии ликвидус, указывающая на образование устойчивого химического соединения при определённой концентрации компонентов А и В. .5 Диаграммы состояния сплавов, претерпевающих превращения в твердом состоянии Существуют следующие виды превращений: Изменение растворимости компонента. Линия FM - линия изменения растворимости компонента В в компоненте А. Из решетки компонента А при охлаждении будет выделяться компонент В в результате уменьшения его растворимости. Аллотропическое превращение одного или двух компонентов (изменение типа решетки). Упорядочение твердых растворов. .6 Связь между свойствами сплавов и типом диаграммы состояния Связь между свойствами сплава его составом и структурой установил академик Курнаков и представил в виде диаграмм «состав - свойства». У сплавов первого рода свойства изменяются линейно. У сплавов второго рода свойства изменяются нелинейно. У сплавов третьего рода свойства в интервале концентраций, отвечающему однофазному состоянию, изменяются по криволинейному, а в двухфазной области диаграммы - по прямолинейному закону. У сплавов четвертого рода наблюдается резкое изменение свойств при образовании химических соединений. 9. Железоуглеродистые сплавы Сплавы железа с углеродом (стали и чугуны) являются наиболее распространёнными металлическими материалами. .1 Компоненты и фазы железоуглеродистых сплавов Железоуглеродистые сплавы образуются двумя компонентами: Железо - температура плавления 1539 0С (±5 0С), ρ=7,85 г/см3, Feδ при Т>1392 0C (ОЦК), Feγ при Т = 1392…911oC (ГЦК), Feα при Т<911oC (ОЦК), σв = 250 МПа, σ т = 120 МПа, δ = 50%, ψ = 80%, НВ=800 МПа. Углерод (графит) - ρ=2,25 г/см3, σ в = 20 МПа, при Т=25000C, σв= 40 МПа, при Т = 3150 0C графит переходит в газообразное состояние. Фазы: 1) жидкость (Ж); 2) феррит (Ф); 3) аустенит (А), цементит (Ц). Феррит - твердый раствор внедрения углерода в решетку Fed или Fea - Фd и Фa. Максимальная растворимость в решетке Feδ при Т = 1499 0C - 0,1% С. Максимальная растворимость в решетке Feα при Т = 727 0C - 0,02% С, при Т = 20 0C составляет 0,006% С. По свойствам феррит близок к техническому железу. Аустенит - твёрдый раствор внедрения углерода в решётку Feγ. Максимальная растворимость при 1147 0С составляет 2,14%С, минимальная растворимость - 0,8% С при 727 0С. Аустенит немагнитен, имеет низкую прочность и высокую пластичность. Цементит - карбид железа Fe3C, образующийся при содержании углерода 6,67% (устойчивое химическое соединение), очень твёрдый и хрупкий (НВ = 8000 МПа). 9.2 Диаграмма состояния «железо-цементит» Железоуглеродистые сплавы изучаются на основании диаграммы состояния железо - углерод. Практическое значение имеет левая часть диаграммы до содержания 6,67% С, при котором образуется устойчивое химическое соединение железа и углерода - цементит (Fe3C). Поэтому на практике принято рассматривать левую часть диаграммы Fe-C диаграмму состояния железо-цементит (рис.2). Сплавы, лежащие правее 6,67% С, очень хрупкие и практически не применяются.- линия ликвидус.- линия солидус. На линии АВ начинается кристаллизация феррита - δ, на линии ВС - аустенита, на линии CD - цементита. Линия HJB (T=1499 0C) - линия перитектического превращения: ФН+ЖВ®АJ. Для сплавов, лежащих левее точки J, после перитектического превращения будет оставаться избыток феррита. Для сплавов, лежащих правее точки J, после перитектического превращения будет избыток жидкой фазы. Линия ECF (Т=1147 0С) - линия эвтектического превращения: ЖС®АЕ+ЦF. Образующаяся эвтектика называется - ледебурит. Железоуглеродистые сплавы, лежащие левее точки Е, называются сталями. Ниже линии солидус после окончания кристаллизации эти сплавы находятся в однофазном состоянии - аустенит. Стали имеют хорошее сочетание прочности, пластичности, вязкости. Точка Е определяет максимальную растворимость углерода в железе (2,14%). Сплавы, лежащие правее точки Е, называются чугунами, и после кристаллизации имеют двухфазную структуру (А+Ц). Это определяет низкую пластичность чугунов, (обрабатывать давлением нельзя) и хорошие литейные свойства. Железоуглеродистые сплавы испытывают превращения и после окончания процесса кристаллизации в твёрдом состоянии. Аллотропические превращения: линии NH и NJ - линии начала и конца превращения Фd®А, т.е. Fed(ОЦК) ® Feg (ГЦК); линии GS и GP - линии начала и конца превращения А® Фa, т.е. Feg (ГЦК) ® Fea(ОЦК). Изменение растворимости углерода в железе: ES - линия изменения растворимости углерода в аустените (решётке Feg). С понижением температуры избыточный углерод выделяется из аустенита и образует с железом так называемый вторичный цементит (ЦII).- линия изменения растворимости углерода в феррите (решётке Fea). С понижением температуры углерод выделяется и образует цементит третичный (ЦIII). Эвтектоидное превращение происходит по линии PSK (727 0С) при этом аустенит состава точки S (0,8% С) распадается с образованием двух новых фаз - феррита состава точки Р (0,02% С) и цементита состава точки К (6,67% С): АS®ФР+ЦК. Образовавшаяся мелкодисперсная механическая смесь феррита и цементита (эвтектоид) называется перлит (П). Эвтектоидное превращение испытывает и аустенит, входящий в состав ледебурита (в сплавах правее точки Е - чугунах): ниже 727 0С ледебурит состоит из механической смеси перлита и цементита, иногда его называют ледебуритом превращенным (Лп). Температуры превращений сплавов в твёрдом состоянии (критические точки) имеют условное обозначение: А1 - линия PSK соответствует превращению А→ П; А2 - линия МО (768 0С) магнитное превращение железа (выше этой линии железо немагнитно, ниже - магнитно); А3 - линия GS - превращение А↔Фa А4 - линия HJ - превращение Фd↔А Аcm - линия SE - начало выделения ЦII. Сплавы состава точки S называются эвтектоидными сталями и имеют структуру перлита. Стали левее точки S называются доэвтектоидными и при нормальной температуре имеют структуру феррито-перлитную. Стали правее точки S называются заэвтектоидными и при нормальной температуре имеют структуру перлит + цементит вторичный. Чугуны отличаются от сталей наличием в структуре ледебурита. Чугуны левее точки С называются доэвтектическими, правее точки С - заэвтектическими. Углерод в диаграмме Fe-C может выделяться наряду с цементитом в виде графитовых включений. Этот процесс называется графитизацией и может наблюдаться при кристаллизации чугунов. Поэтому чугуны по микроструктуре делятся на белые - углерод находится в виде химического соединения и серые - углерод находится в виде графита. Литература 1 Лахтин Ю.М. Материаловедение/ Ю.М. Лахтин, В.П. Леонтьева. - М.: Машиностроение, 2010. - 528с. 2 Фетисов Г.П. Материаловедение и технология металлов. - М.: Высшая школа, 2011. - 640 с. 3 Дальский А.М. Технология конструкционных материалов/ А.М. Дальский. - М.: Машиностроение, 1985. - 448с. 4 Кнорозов В.В. Технология металлов/ В.В. Кнорозов. - М.: Металлургия, 1979. - 904с. Прейс Г.А. Технология конструкционных материалов: Учебник для вузов./ Г.А. Прейс, Н.А.Сологуб,. И.А. Рожнецкий - К.: Выща школа, 2011. - 390с. 6 Сборник иллюстрационного материала к лекциям по дисциплине “Технология конструкционных материалов” /Сост.: В.И. Кабацкий, А.Я. Шашко. - Краматорск: ДГМА, 2011. - 55 с. |
