Гидрогеохимия. Вода основа природных растворов
 Скачать 42.01 Kb. Скачать 42.01 Kb.
|
|
ВОДА — ОСНОВА ПРИРОДНЫХ РАСТВОРОВ [Изотопный состав природным вод. Структура воды и природных растворов, физико–химические аномалии воды. Влияние температуры, давления, электромагнитных полей и химических компонентов на структуру воды] Из предыдущей лекции вытекает, что объектом гидрогеохимии являются подземные воды. Однако, строго говоря, это не совсем так. Ведь подземными водами обычно называют свободные жидкие воды, передвигающиеся в пустотах горных пород, или несколько иначе, к подземным водам относится капельно–жидкая вода, заполняющая пустоты и поры в горных породах и способная к перемещению в них и вытеканию из них. А как быть с водяным паром? Как быть со льдом, который широко распространён под землёй на просторах Северной Евразии? Как быть с прочно физически связанной водой в глинах, которая отпрессовывается из них при значительном давлении? Как быть с химически связанной водой, которая входит в состав минералов в виде кристаллизационной воды (например, гипс — СаSO4·2Н2О) или конституционной (например, каолинит — А12Si2O5(ОН)4)? Совершенно ясно, что понять природу капельно–жидкой, собственно подземной, воды можно лишь в том случае, если иметь в виду, что в природе существуют сложные и многочисленные взаимопереходы между жидкой водой, паром и льдом, между свободной, физически и химически связанными разновидностями воды. Таким образом, строго говоря, объектом гидрогеохимии является или должна являться вся подземная гидросфера, т.е. материальная система, охватывающая все внутриземные молекулы Н2О. Мы произнесли “молекулы Н2О”. А знаем ли мы, из чего они состоят, как они построены, как связаны между собой в объёме воды? Прежде чем начать разбирать подземные растворы, рассмотрим их основу — воду, рассмотрим воду в физическом смысле. Молекула воды состоит из одного атома кислорода и двух атомов водорода. Напомню, что атомы могут иметь различные массовые числа и различаться по своим физико–химическим свойствам, но иметь одинаковый электрический заряд ядер. Такие разновидности атомов занимают в периодической системе элементов одно и то же место и называются изотопами. У кислорода известны пять изотопов: 14О, 15О, 160, 17О и 18О. Первые два радиоактивны и очень короткоживущие. Остальные три стабильные. Из них наибольшую распространённость на Земле (в воздухе) имеет 16О: на его долю приходится почти 99,8 %. На долю 18О приходится 0,2 %, на долю 17О — менее 0,04 %. У водорода такие изотопы: 1Н (протий), 2Н (дейтерий), 3Н (тритий), 4Н и 5Н. Протий и дейтерий — стабильные (протия в 6700 раз больше, чем дейтерия), тритий — радиоактивный с периодом полураспада 12 лет, 4Н и 5Н — радиоактивные и очень короткоживущие. Тритий возникает в природе в результате космических процессов, он может поступать в атмосферу, а из неё — в подземные воды. Тритий используется как индикатор абсолютного возраста молодых подземных вод. Стабильные изотопы кислорода (16О и 18О) и водорода (протий и дейтерий) используются в гидрогеохимии для установления генезиса подземных вод. Изотопный состав кислорода и водорода принято выражать следующим образом: для кислорода 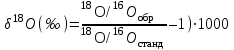 , ,для водорода 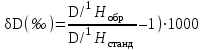 . .Здесь: 18O/16Oобр, D/1Hобр и 18О/16Останд, D/1Hстанд — соотношения концентраций изотопов в исследуемом образце воды и стандарте. За международный стандарт для воды SМОW (Standard Mean Ocean Water) принята средняя проба тщательно перемешанной воды, отобранной из центральных частей Тихого, Атлантического и Индийского океанов. Основными природными процессами, контролирующими фракционирование водорода и кислорода, являются испарение и конденсация: водяной пар по изотопному составу облегчается, так как при испарении с поверхности воды отрываются в первую очередь более лёгкие молекулы, а остальная вода утяжеляется. Вода, получающаяся при конденсации пара, также как пар, характеризуется облегченным изотопным составом водорода и кислорода. Посмотрим на примере изотопного состава кислорода, как эти процессы отражены в цифрам. 18O морской воды близко к нулю (–0,9±1,2 ‰). Атмосферные осадки характеризуются обычно отрицательными величинами 18O (–24 ÷ –5 ‰). В морской воде, подвергшейся испарению, δ18О может составить +7 ÷ +11 ‰. Таким образом, на основании изотопных показателей, определённых для подземной воды, можно судить, произошла ли она от нормально морской или связана с инфильтрацией в недра атмосферной воды. Перейдём теперь к рассмотрению структуры воды, т.е. к строению её молекулы и к взаимосвязи молекул в объёме воды. Но прежде обратим внимание на то, что вода — одно из наиболее распространённых соединений на Земле, является едва ли не самым аномальным среди них по своим физическим свойствам. В чём же заключается эта аномальность? 1. В известном смысле аномальными являются уже главные физические параметры воды (температура кипения и плавления), если сравнивать их с соответствующими параметрами для гидридов элементов второй группы таблицы Менделеева: Н2Тe, Н2Se и Н2S. Значения температур кипения и плавления для этих гидридов ложатся на одну прямую, и если эту прямую продолжить в сторону Н2О, то окажется, что температура плавления льда или замерзания воды должна быть не выше –100 °С, а температура кипения воды должна быть где–то между –70 и –10 °С. А фактически температура замерзания чистой воды при нормальном давлении 0 °С, а кипения — 400 °С. [При повышении давления или при растворении в воде химических соединений температура кипения растёт, а температура замерзания падает. Раз мы заговорили об основных физических точках воды, то надо отметить, что критической точкой чистой воды является 374 °С (для растворов она выше). При более высоких температурах в условиях любых давлений пар не может перейти в жидкость, а при давлениях свыше 218 атм. для физического состояния воды характерно отсутствие различия между жидкостью и газом. Такая субстанция, называемая надкритическим флюидом, присутствует в земной коре на глубинах свыше15–20 км]. 2. Общеизвестно, что все вещества при нагревании увеличивают свой объём и уменьшают плотность. У воды же в интервале от 0 до 4 °С с возрастанием температуры объём сокращается и максимальная плотность отмечается при 4 °С. Если бы вода не обладала этой аномалией, то водоёмы зимой промерзали бы до самого дна, что было бы катастрофой для всего живого. При снижении температуры от 4 до 0 °С объём воды постепенно увеличивается, а при замерзании возрастает резким скачком (примерно на 11 %). Именно этим объясняется разрушительная сила замерзающей воды в трещинам горных пород, откалывающая подчас многотонные глыбы и дробящая их на мелкие осколки. 3. Замечательна очень высокая растворяющая способность воды. Существование у воды такой способности определяется её исключительно высокой диэлектрической проницаемостью. Она при комнатной температуре равна 80. Для сравнения у большинства других растворителей диэлектрическая проницаемость изменяется от 10 до 50. Что физически означает наличие у воды диэлектрической проницаемости, равной 80? Это означает, что два противоположных электрических заряда в воде взаимно притягиваются с силой в 80 раз меньшей, чем в воздухе, то есть отделение ионов от кристаллов какой–либо соли, что и составляет суть растворения, в воде в 80 раз легче; чем в воздухе. 4. Вода обладает самым большим поверхностным натяжением из всех жидкостей за исключением ртути. На поверхности воды могут лежать предметы, которые в 8 и более раз тяжелее воды. 5. Вода обладает теплоёмкостью, самой высокой среди всех твёрдых и жидких веществ за исключением аммиака. 6. Теплопроводность воды самая высокая из всех жидкостей. 7. Возрастание давления приводит, как правило, к увеличению вязкости вещества, а у воды в интервале 0–30 °С вязкостъ с ростом давления убывает.   Хорошо известно, что физические свойства любого вещества зависят, прежде всего, от его структуры. Чем же так необычна структура воды? Атом водорода представляет собой протонное ядро, вокруг которого существует одна электронная оболочка с единственным электроном (Рис. 1). У кислорода вокруг ядра имеются две электронные оболочки: на внутренней — два электрона и на внешней — шесть (Рис. 2). При образовании молекулы воды электроны водорода и кислорода обобществляются таким образом, что на внешней оболочке водорода их становится два, а на внешней оболочке кислорода — восемь. Химическая связь, обусловленная обобществлением электронов атомов, называется ковалентной. Это очень сильная связь, и именно поэтому молекула воды чрезвычайно устойчива. На последнем рисунке легко заметить два важных момента: 1) атомы водорода расположены несимметрично относительно атома кислорода (что связано с резко различными размерами атомов и сильной электроотрицательностью кислорода) и 2) в молекуле остаются на внешней оболочке кислорода 4 электрона или как их называют две неподелённые пары электронов [они не поделены между водородом и кислородом, в отличие от обобществлённых электронов]. Если перейти от плоскостной модели молекулы воды к объёмной, то, в свете современных представлений, молекула воды имеет вид электронного облака, в центре которого расположено ядро атома кислорода, а в противоположных углах нижней части грани условного куба находятся ядра водорода. Расстояние между кислородом и водородом 1 Å (стомиллионная доля метра). По четырём вытянутым эллиптическим орбиталям движутся электроны. С ядрами водорода связаны два полюса положительных электрических зарядов молекулы воды. А в противоположной части молекулы вытянуты орбитали, по которым движутся неподелённые пары электронов (о которых мы говорили), и к этим электронам приурочены два полюса отрицательных зарядов молекулы воды. Таким образом, молекулу воды можно представить в виде тетраэдра, два угла которого заряжены положительно, а два других — отрицательно. Вследствие несимметричности расположения зарядов молекула воды полярна. Полярность воды, бόльшая чем у других веществ, обусловливает высокую диэлектрическую проницаемость воды, высокую растворяющую способность и высокую электролитическую диссоциацию (т.е. распад на ионы) в воде солей, кислот и оснований. Как происходит растворение в воде твёрдых веществ? В сильно упрощённом виде это происходит так. В твёрдом кристаллическом состоянии ионные соединения типа NаСl состоят из закономерно расположенных положительных и отрицательных ионов. При погружении в воду кристаллов галита (NаСl) положительно заряженный ион натрия будет притягиваться отрицательным полюсом молекулы воды; отрицательно заряженный ион хлора — положительным. Процесс растворения будет, грубо говоря, представлять собой растаскивание ионов кристаллической решётки молекулами воды. Другой (кроме полярности) важнейшей особенностью структуры воды является способность молекулы воды соединяться с другими её молекулами посредством водородной связи. Каждая молекула воды взаимодействует с четырьмя соседними молекулами в вершинах электронных орбиталей (или в вершинах условного тетраэдра) путём электрического взаимодействия между водородом одной молекулы и неподелённой парой электронов — другой. Так возникает водородная связь между молекулами воды. Схематически она может быть выражена следующим образом. Водородная связь слабее ковалентной. Длина ковалентной связи O – H составляет 1,00 Å, а водородной O — H — 1,76 Å. Водородные связи между молекулами воды и возникающие пространственные структуры молекул определяют межмолекулярную структуру воды. Существует целый ряд структурных моделей, предложенных Дж. Берналом и Р. Фаулером, Х.С. Френком и У.И. Вина, М. Аджено, российским физико–химиком О.Я. Самойловым. Но для нас важно понять следующие основные моменты. Водяной пар состоит из мономерных молекул, т.е. одиночных, не связанных водородными связями. Во льду все молекулы воды связаны между собой водородными связями в молекулярные ассоциаты (рои или кластеры), поэтому структура льда представляется ажурным каркасом, состояшим из ассоциатов молекул воды с большим количеством пустот. В жидкой воде имеются и мономерные молекулы, и льдоподобные ассоциаты, в воде всё время происходит образование ассоциатов и распад их на одиночные молекулы (время жизни ассоциатов 10–10–10–11 сек) и структура жидкой воды в каждый данный момент определяется соотношением в ней льдоподобных ассоциатов с мономерными молекулами. Количество молекул, связанных в ассоциаты, и количество самих ассоциатов может быть различным и зависит от ряда факторов, в частности от температуры. Процесс плавления льда состоит в распаде молекулярных ассоциатов. Освобождающиеся от водородных связей молекулы попадают в полости имеющихся в воде льдоподобных структур. При этом укладка молекул оказывается более компактной, плотность воды растёт, а объём падает. Эти процессы наиболее активно протекают до температуры 4 °С. При приложении давления к воде, структура которой имеет большое количество пустот, её ажурные льдоподобные образования становятся менее устойчивыми. Они начинают разрушаться, становится больше мономерных молекул, которые более подвижны, чем льдоподобные ассоциаты. И вязкость воды уменьшается. Так, структурой объясняется аномальная зависимость вязкости от давления, присущая воде. Структурой воды объясняются и другие аномальные свойства воды. Так, водородные связи обусловливают необычайную силу сцепления воды, проявляющуюся в её высоком поверхностном натяжении. На структуру воды и свойства растворов влияют магнитное и электрическое поля, ультразвуковые воздействия, дозы радиоактивных излучений. Например, в магнитном поле наблюдаются: 1) ускорение коагуляции (оседания) взвешенных в воде твёрдых частиц; 2) образование кристаллов соли при выпаривании не на стенках, а в объёме; 3) ускорение растворения твёрдых тел; 4) изменение концентрации растворённых газов. Сущность изменений, происходящих в воде под влиянием внешних полей, пока мало ясна, а имеющиеся гипотезы противоречивы. Значительное влияние на структуру воды оказывают растворяющиеся в ней вещества. Ионы растворённого вещества, попадающие ж пустоты льдоподобных каркасов водного растворителя, могут или стабилизировать, или дестабилизировать эти каркасы и тем самым всю структуру воды. Ионы с большим зарядом и малым радиусом усиливают водородные связи и стабилизируют структуру воды. Это так называемые положительно гидратирующиеся ионы. К ним относятся Li+, Nа+, Ca2+, Mg2+, Sr2+, Fe2+, НСО3–, SO42–. Крупные однозарядные ионы (Cl–, Br–, I–, К+, Rb+, Сs+) — это отрицательно гидратирующиеся ионы. Они ослабляют и разрушают водородные связи и разупорядочивают структуру воды. Изменения, происходящие в структуре воды под влиянием ионов, аналогичны воздействию температуры, что позволило Дж. Берналу и Р. Фаулеру ввести понятие о структурной температуре раствора. Структурная температура ионного раствора — это температура, при которой чистая вода будет иметь ту же внутреннюю структуру и те же физические свойства (вязкость, диэлектрическая проницаемости и т.д.), что и ионный раствор при данной температуре. Отрицательно гидратирующиеся ионы повышают структурную температуру ионного раствора, положительно гидратирующиеся — понижают её. Надо иметь в виду, что с ростом концентрации ионов в растворе отрицательно гидратирующиеся ионы превращаются в положительно гидратирующиеся. Это значит, что при определённой концентрации солей в растворе структура этого раствора существенно упорядочена независимо от набора ионов. Таким образом, если сама чистая вода, содержащая льдоподобные структуры, в физическом смысле напоминает твёрдое вещество, то раствор солей высокой концентрации характеризуется ещё большей структурной упорядоченностью. Эти представления имеют большое значение для понимания процессов образования высококонцентрированных подземных вод. Нам осталось лишь рассмотреть вопрос о специфике физически связанной воды, т.е. воды, молекулы которой взаимодействуют не только между собой, но и с поверхностью твёрдого тела. Наличие физически связанной воды наиболее характерно для глинистых пород, в которых количество пор велико, а их размер очень мал. В связанной воде под воздействием поверхностных сил твёрдого тела происходит искажение структурных связей и изменение их физических свойств. Связанная вода обладает более высокой плотностью, чем вода в объёме, более низкой растворяющей способностью и как следствие меньшим содержанием солей, чем свободная вода. Эта особенность связанной воды может иметь существенные геологические последствия. При погружении осадочных толщ находящиеся в них физически связанные воды могут быть отжаты в трещины и крупные поры, по которым идёт фильтрация. Освободившись от влияния твёрдой поверхности, эта вода восстанавливает свою растворяющую способность, начинает интенсивно выщелачивать породы на путях движения воды и может сформировать коллекторы нефти и газа. |
