Разработка урока по теме Вода. План урока Вода. Вода растворитель. Растворы
 Скачать 213.06 Kb. Скачать 213.06 Kb.
|
|
Тема урока: Вода – растворитель. Растворы. УМК: Г.Е. Рудзитис, Ф.Г. Фельдман, «Химия, 8 класс» Цель урока: формирование представлений о воде как растворителе, о видах растворов, расширение представлений о значении воды и растворов в жизни человека. Задачи урока: образовательные: ознакомить с видами растворов (концентрированные, разбавленные, насыщенные, ненасыщенные); видами растворителей; развивающие: развивать интеллектуальные и когнитивные компетенции обучающихся; воспитательные: воспитывать личностные качества (самостоятельность, инициативу). Реактивы и оборудование: вода, поваренная соль (хлорид натрия), масло растительное, медный купорос, мел (карбонат кальция), бихромат калия, уксусная кислота, кристаллы, модели молекул; таблица растворимости, карточки (тестирование, рефлексия), лабораторный опыт «Выращивание кристалла», химические стаканы, стеклянные палочки. Мультимедийное сопровождение: презентация по теме. Инструктаж по технике безопасности: Не пробовать вещества на вкус. Рабочее место содержать в чистоте. Пользоваться можно только реактивами, имеющими этикетки. Проводить опыты только в чистой лабораторной посуде. Твёрдые вещества брать только сухой фарфоровой ложечкой. Ход урока 1.Орг. момент(1 мин.) 2.Беседа с учащимися: Общие сведения о воде: Химическая формула - H2O. Систематическое наименование - Оксид водорода. Традиционное название - ВОДА. Молярная масса - 18 г/моль. Физические свойства: Агрегатное состояние - жидкое. Плотность - 1 г/см3. Термические свойства. Температура плавления - 0° С. Температура кипения - 100° С. Три агрегатных состояния воды: Твёрдое - Лёд. Жидкое - Вода. Газообразное - Водяной пар. При 0° С вода замерзает. При 100° С – кипит. 3.Объяснение новой темы. 1. Строение молекулы воды: Молекула воды состоит из 2 атомов водорода и 1 атома кислорода. Атомы водорода находятся под углом 105°. Лабораторный опыт № 1. Изготовление шаростержневой модели молекулы воды. 2. Аномальные свойства воды: ПЛОТНОСТЬ ЛЬДА МЕНЬШЕ, ЧЕМ У ЖИДКОЙ ВОДЫ, ЧТО ЯВЛЯЕТСЯ АНОМАЛЬНЫМ СВОЙСТВОМ ВОДЫ; МАКСИМАЛЬНАЯ ПЛОТНОСТЬ ПРИ 4° С ПРИНЯТА ЗА 1г/мл, ВСЕ ОСТАЛЬНЫЕ ВЕЩЕСТВА СРАВНИВАЮТСЯ ПО ПЛОТНОСТИ И МАССЕ С ВОДОЙ; ВОДА ОБЛАДАЕТ САМОЙ БОЛЬШОЙ ТЕПЛОЕМКОСТЬЮ; ОНА НЕ ПРОВОДИТ ЭЛЕКТРИЧЕСКИЙ ТОК. 3. Растворы - однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия. Характерный признак растворов - однородность. Виды растворителей. Виды растворов: Концентрированные - растворы, содержащие много растворенного вещества и мало растворителя. Разбавленные - растворы, содержащие мало растворенного вещества и много растворителя. Насыщенные - растворы, в которых при данной температуре вещество уже не может больше растворяться. Ненасыщенные - растворы, в которых при данной температуре вещество еще может растворяться. Лабораторные опыты № 2-3. Приготовление насыщенного и ненасыщенного растворов . 4. Ознакомление с технологией выращивания кристаллов из медного купороса и поваренной соли. Лабораторный опыт № 4. Выращивание кристаллов (приложение № 1). 5. Взвеси – неоднородные системы, в которых можно увидеть частички вещества, распределённые между молекулами воды. Суспензии - взвеси, в которых мелкие частички твёрдого вещества равномерно распределены между молекулами воды. Смесь глины с водой. Эмульсии - взвеси, в которых мелкие капельки жидкого вещества равномерно распределены между молекулами воды. Смесь растительного масла с водой. Лабораторные опыты № 5-6. Приготовление суспензии и эмульсии. Растворимость веществ - способность веществ растворяться в растворителе. По растворимости вещества делятся на: растворимые: NaCI, KOH, CuSO4 малорастворимые: Са(OH)2, Ag2SO4, CaSO4 нерастворимые: BaSO4, AgCI, Cu(OH)2. Демонстрация таблицы растворимости (приложение № 2). 6. Качества воды: Парадоксальный факт: вода необходима для жизни, но она же является и одной из главных причин заболеваемости в мире. Опасность может быть микробиологической: вода в природе содержит множество микроорганизмов, вызывающих у человека заболевания (холера, тиф, гепатит, гастроэнтерит и др.). Загрязнение может быть и химическим, с немедленными или отсроченными последствиями. Вода должна быть не только очищена от этих загрязнений, но и быть приятной на вкус. 7. Память воды. Японский исследователь Масару Эмото (Masaru Emoto) приводит удивительные доказательства информационных свойств воды. За время работы он сделал более 10000 фотографий, некоторые из них опубликованы в его книгах «The Messages from Water» 1, 2 и «Water knows the answer.» Доктор Эмото использовал Анализатор Магнитного Резонанса (MRA) для нескольких функций, включая качественный анализ воды. Он заметил, что никакие два образца воды не образуют абсолютно похожих кристаллов, и что форма кристаллов отражает свойства воды. Демонстрация фотографий кристаллов воды. 4.Закрепление знаний. Тестирование (приложение № 3). 5.Рефлексия (приложение № 4). 6. Дом. задание: П. 33, № 1-2; т.№ 1-3. Доп. задание: № 3-5. Приложение № 1. Лабораторный опыт Выращивание кристалла Дистиллированную или кипячёную воду объёмом 300-350 см3 нагрейте до 50-60° С и перелейте в стеклянную банку. Затем вносите небольшими порциями медный купорос, перемешивая стеклянной палочкой. Соль добавляйте до тех пор, пока она не перестанет растворяться. Если полученный раствор содержит видимые примеси, быстро профильтруйте его в широкогорлый сосуд (в качестве фильтра можно использовать бинт или марлю, сложенные в несколько слоёв). Сосуд оберните тканью для теплоизоляции. Возьмите тонкую капроновую нить и привяжите к середине палочки. Палочку положите поперёк отверстия сосуда, а свободный конец нити опустите в раствор почти до дна сосуда. Сосуд закройте тканью или бумагой и поставьте в укромное место. Приложение № 2. Таблица растворимости 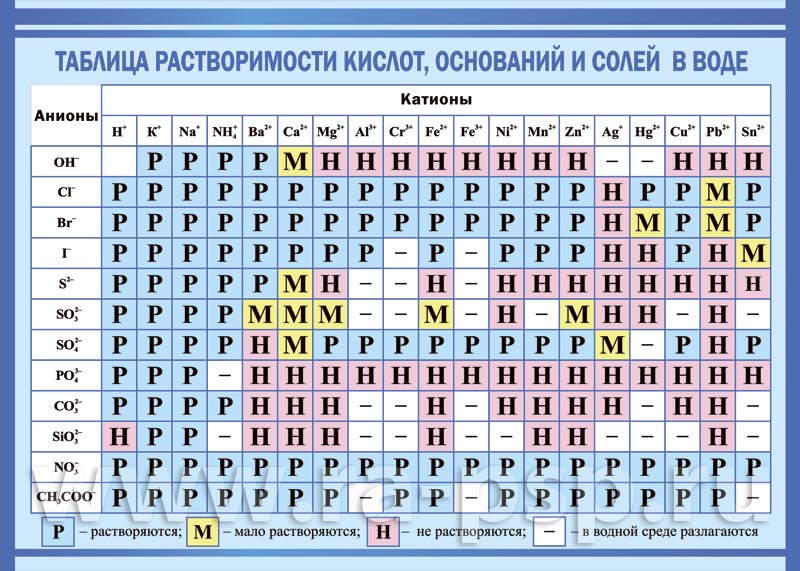 Приложение № 3. Ф.И.________________________________________ Дата ____________ Тестирование по теме: Вода - растворитель. Растворы. 1. Укажите верное утверждение: 1) Раствор, в котором данное вещество при данной температуре больше не растворяется, называют насыщенным. 2) Раствор, в котором данное вещество при данной температуре больше не растворяется, называют ненасыщенным. 2. Морская вода – это 1) раствор 2) суспензия 3) эмульсия 3. Смесь растительного масла с водой - это 1) раствор 2) суспензия 3) эмульсия 4. При увеличении температуры растворимость твёрдых веществ: а) возрастает б) уменьшается в) не изменяется г) периодически изменяется 5. Температуры плавления и кипения воды соответственно: а)10°C и 50°C б) 0°C и 100°C в)25°C и 100°C г)0°C и 10°C Система оценивания: 1 правильный ответ – «1 балл» 2 правильный ответ – «2 балла» 3 правильный ответ – «3 балла» 4 правильный ответ – «4 балла» 5 правильный ответ – «5 баллов» Оценка «_____» Приложение № 4. Рефлексия Кем был каждый из вас сегодня на уроке? Какими мы были на уроке? Каким вы видите сегодняшний урок?  |
