белки. Введение Строение белков
 Скачать 4.02 Mb. Скачать 4.02 Mb.
|
|
Содержание Введение………………………………………………………………………………3 1. Строение белков…………………………………………………………………...7 2. Классификация белков…………………………………………………………...10 3. Свойства белков………………………………………………………………….13 4. Значение белков…………………………………………………………………..18 Заключение………………………………………………………………………….22 Список литературы…………………………………………………………………23 Введение протеин полимер белок каталитический Белками или белковыми веществами называют высокомолекулярные природные полимеры (молекулярная масса колеблется от 5 до 10 000 до 1 млн и более), молекулы которых состоят из аминокислотных остатков, соединенных амидной связью (пептид). Белки также называют протеинами (от греческого «протос» — первый, важный). Количество аминокислотных остатков в белковой молекуле весьма вариабельно и иногда достигает нескольких тысяч. Каждый белок имеет свою присущую ему последовательность аминокислотных остатков. Белок можно рассматривать как сложный полимер аминокислот. Белки входят в состав всех живых организмов, но особенно важную роль они играют в животных организмах, которые состоят из различных форм белка (мышца, покровная ткань, внутренние органы, хрящи, кровь). Растения синтезируют белки (и их а-аминокислотные составляющие) из углекислого газа СО2 и воды Н2О путем фотосинтеза, усваивая остальные белковые элементы (азот N, фосфор P, серу S, железо Fe, магний Mg) из растворимых в почве солей. Белки выполняют разнообразные биологические функции: пластическую, транспортную, защитную, энергетическую, каталитическую, сократительную, регуляторную и другие. Белки, поступающие в организм с пищей животного и растительного происхождения, со временем гидролизуются до α-аминокислот. Наш организм устроен таким образом, что часть а-аминокислот – незаменимых аминокислот – обязательно должна содержаться в пище. У взрослых их всего 8, а у детей 10. А вот остальные незаменимые аминокислоты, которые синтезирует сам организм, были бы избыточным азотом, без которого не может быть ни одного белка. Этот процесс происходит в печени. Белки действуют как биокатализаторы, ферменты, регулирующие скорость и направление химических реакций в организме. В сочетании с нуклеиновыми кислотами они выполняют функции роста и передачи наследственных признаков, составляют структурную основу мышц и обеспечивают мышечное сокращение. Белок представляет собой полипептид, состоящий из сотен или тысяч единиц аминокислот. Белки были выделены в отдельный класс биологических молекул в 18 веке в результате работ французского химика Антуана Фуркруа и др., в которых было отмечено свойство белков коагулировать (денатурировать) под действием тепла или кислот. . В то время такие белки, как альбумин («яичный белок»), фибрин (белок крови) и клейковина злаков были изучены Антуаном Франсуа де Фуркруа, основоположником изучения белков пшеницы. Голландский химик Геррит Малдер проанализировал состав белков и выдвинул гипотезу, что почти все белки имеют сходную эмпирическую формулу. Термин «белок» для таких молекул предложил в 1838 году шведский химик Якоб Берцелиус. Малдер также определил продукты распада белков — аминокислоты, и для одной из них (лейцина) с небольшой погрешностью определил молекулярную массу — 131 дальтон. В 1836 г. Малдер предложил первую модель химической структуры белков. На основе теории радикалов он сформулировал понятие о минимальной структурной единице белкового состава C16H24N4O5, которую назвал «белком», и теорию — «белковую теорию». По мере накопления новых данных о белках теория стала неоднократно подвергаться критике, но до конца 1850-х гг., несмотря на критику, все же считалась общепринятой. К концу 19 века было изучено большинство аминокислот, входящих в состав белков. В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию о том, что аминокислоты являются строительными блоками белков. В начале 20 века немецкий химик Эмиль Фишер экспериментально продемонстрировал, что белки состоят из аминокислотных остатков, связанных пептидными связями. Он также провел первый анализ аминокислотной последовательности белка и объяснил явление протеолиза. Однако центральная роль белков в организмах не была признана до 1926 года, когда американский химик Джеймс Самнер (впоследствии лауреат Нобелевской премии) показал, что фермент уреаза представляет собой белок. Сложность выделения чистых белков затрудняет их изучение. Поэтому первые исследования были проведены с использованием полипептидов, которые можно было очистить в больших количествах, т.е. белков крови, куриных яиц, различных токсинов и пищеварительных/метаболических ферментов, выделяющихся после убоя. В конце 1950-х Armor Hot Dog Co. удалось очистить один килограмм бычьей панкреатической рибонуклеазы А, которая стала экспериментальным объектом для многих ученых. Идея о том, что вторичная структура белков возникает в результате образования водородных связей между аминокислотами, была предложена Уильямом Эстбери в 1933 году, но Лайнус Полинг считается первым ученым, успешно предсказавшим вторичную структуру белков. Впоследствии Вальтер Каузман, опираясь на работу Кая Линдерстрём-Ланга, внес значительный вклад в понимание закономерностей формирования третичной структуры белков и роли гидрофобных взаимодействий в этом процессе. В 1949 году Фред Сенгер определил аминокислотную последовательность инсулина, тем самым продемонстрировав, что белки представляют собой линейные полимеры аминокислот, а не их разветвленные цепи (как в некоторых сахарах), коллоиды или циклоолы. Первые белковые структуры на основе одноатомной рентгеновской дифракции были получены в 1960-х годах, а с помощью ЯМР — в 1980-х. В 2006 году Банк данных о белках содержал около 40 000 белковых структур. В 21 веке исследования белков перешли на качественно новый уровень, где изучаются не только отдельные очищенные белки, но и одновременное изменение количества и посттрансляционные модификации большого количества белков в отдельных клетках, тканях или организмах. Эта область биохимии называется протеомикой. С помощью методов биоинформатики стало возможным не только обрабатывать данные рентгеноструктурного анализа, но и предсказывать структуру белка на основе его аминокислотной последовательности. В настоящее время криоэлектронная микроскопия больших белковых комплексов и предсказание малых белков и больших белковых доменов с помощью компьютерных программ приближаются к точности разрешения структур на атомарном уровне. 1. Строение белков Природа R-радикалов (остатков) в молекулах аминокислот имеет большое значение в пространственной структуре белков. Неполярные аминокислотные радикалы обычно располагаются в макромолекуле белка и вызывают гидрофобные взаимодействия; Полярные радикалы, содержащие ионогенные (ионообразующие) группы, обычно располагаются на поверхности белковой макромолекулы и характеризуются электростатическими (ионными) взаимодействиями. Полярные неионогенные радикалы (например, содержащие спиртовые ОН-группы, амидные группы) могут находиться как на поверхности, так и внутри молекулы белка. Они участвуют в образовании водородных связей. В белковых молекулах а-аминокислоты связаны пептидными связями (-СО-NH-): 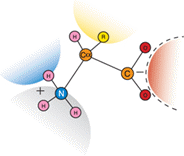 Построенные таким образом полипептидные цепи или отдельные участки внутри полипептидной цепи в ряде случаев могут быть дополнительно соединены между собой дисульфидными (-S-S-) связями или, как их часто называют, дисульфидными мостиками. Важную роль в создании структуры белков играют ионные (солевые) и водородные связи, а также гидрофобное взаимодействие — особый вид контакта между гидрофобными компонентами белковых молекул в водной среде. Все эти связи имеют разную силу и обеспечивают образование сложной и крупной белковой молекулы. Несмотря на различие строения и функций белковых веществ, их элементный состав различается незначительно (в % от сухой массы): углерод-51-53; кислород - 21,5-23,5; азот-16,8-18,4; водород-6,5-7,3; сера-0,3-2,5. Некоторые белки содержат небольшое количество фосфора, селена и других элементов. Особенность каждого вида белка связана не только с длиной, составом и строением полипептидных цепей, входящих в его молекулу, но и с тем, как эти цепи ориентированы. Различают четыре уровня организации белковых молекул: 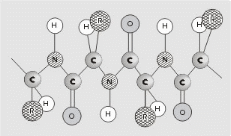 Первичная структура белка1. Первичная структура белка – это последовательность аминокислотных остатков в полипептидной цепи. Белковая молекула может состоять из одной или нескольких полипептидных цепей, каждая из которых содержит разное количество аминокислотных остатков. Разнообразие белков практически безгранично, но не все они существуют в природе. 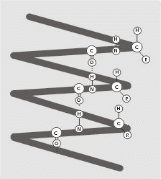 Вторичная структура белка2. Вторичная структура белка – это способ закручивания полипептидной цепи в пространстве (за счет водородной связи между водородом амидной группы – NH – и карбонильной группы – CO – разделенными четырьмя аминокислотными фрагментами). Большинство белков имеют вторичную структуру, хотя и не всегда по всей длине полипептидной цепи. Один виток спирали обычно содержит 3,6 аминокислотных остатка, шаг спирали 0,544 нм.  Третичная структура белка3. Третичная структура белка представляет собой реальную трехмерную конфигурацию закрученной в пространстве полипептидной цепи (спирали, закрученной в спираль). Третичная структура белка определяет специфическую биологическую активность белковой молекулы. Помимо водородных связей, в формировании третичной структуры важную роль играют ионные и гидрофобные взаимодействия. По характеру «упаковки» белковой молекулы различают глобулярные или сферические и фибриллярные или нитевидные белки. Для глобулярных белков более характерно а-спиральное строение, спирали изогнуты, «свернуты». Макромолекула имеет сферическую форму. Они растворяются в воде и растворах солей и образуют коллоидные системы. Большинство белков животного, растительного и микробного происхождения представляют собой глобулярные белки. Для фибриллярных белков более характерна нитевидная структура. Они не растворяются в воде. Белки фибрилл, как правило, выполняют структурообразующие функции. Их свойства (прочность, удлинение) зависят от способа упаковки полипептидных цепей. Примером фибриллярных белков являются белки мышечной ткани (миозин), кератин (роговая ткань).  Четвертичная структура белка4. Четвертичная структура белка – относится к макромолекулам, включающим в себя несколько полипептидных цепей (субъединиц), не связанных друг с другом ковалентно. Эти субъединицы связаны между собой водородными, ионными, гидрофобными и другими связями. Примером может служить макромолекула гемоглобина. 2. Классификация белков Существует несколько классификаций белков. Они основаны на разных характеристиках: • степень сложности (простой и сложный); • форма молекулы (глобулярные и фибриллярные белки); • растворимость в индивидуальных растворителях; • выполняемая функция. По своему составу белки делятся на простые, состоящие только из аминокислотных остатков (белки), и сложные (белки). Комплексы могут включать ионы металлов (металлопротеины) или пигменты (хромопротеины), образовывать прочные комплексы с липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеиды), а также ковалентно связываться с остатком фосфорной кислоты (фосфопротеиды), углевода (гликопротеины) или кислоты , нуклеиновый. геномы некоторых вирусов). 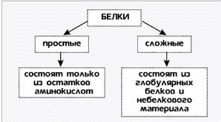 По ряду характерных свойств белки можно разделить на несколько подгрупп: Альбумины. Они растворимы в воде, коагулируют при нагревании, нейтральны, относительно трудно осаждаются растворами солей. Примерами их являются: альбумин яичного белка, альбумин сыворотки крови, альбумин мышечной ткани, альбумин молока. глобулины. Они нерастворимы в воде, но растворимы в очень слабых растворах солей. Примерами глобулинов являются: фибриноген, глобулин сыворотки крови, глобулин мышечной ткани, глобулин яичного белка. Гистоны. Основные белки. Они находятся в виде нуклеопротеидов в лейкоцитах и эритроцитах. Протамины. Они не содержат серы, обладают относительно сильными основными свойствами, дают кристаллические соли; обнаружены (в виде нуклеопротеидов) в сперматозоидах рыб. Проламин. Встречается в зернах различных злаков. Их примечательной особенностью является растворимость в 80% спирте. Представителем этих белков может выступать глиадин, являющийся основной частью глютена. Склеропротеины. Нерастворимые белки, входящие в состав наружного покрова тела животного и находящиеся в скелете и соединительной ткани. К ним относятся кератин, коллаген, эластин, фиброин. Кератин является основным компонентом волос, рогов, копыт, ногтей, перьев и верхнего слоя кожи. Химический состав кератина богат серой. коллаген. Чрезвычайно распространен в живых организмах. Соединительная ткань состоит из коллагенов; они находятся в хрящах. Кости позвоночных состоят из неорганических веществ (фосфата и карбоната кальция), жира и коллагена. Эластин входит в состав вен и других эластических веществ соединительной ткани. Белки также можно разделить на несколько групп: Фосфопротеины содержат в своем составе фосфор. Они имеют ярко выраженный кислый характер. Молочный казеин является основным представителем фосфопротеинов. Он имеет настолько ярко выраженный кислотный характер, что разлагает угольные соли с выделением углекислого газа. Казеин растворяется в слабых растворах щелочей, образуя с ними соли. Соли казеина называются казеинатами. При нагревании казеин не коагулирует. При действии кислот на соли казеина он высвобождается в свободной форме. Этим объясняется свертывание молока при сквашивании. Из других фосфоропротеинов следует отметить вителлин, который содержится в желтке куриного яйца. Нуклеопротеины находятся в ядрах клеток. При осторожном гидролизе они расщепляются на белок и нуклеиновую кислоту. Хромопротеины. Под этим названием известны белки, представляющие собой комбинацию белков с красителями. Из хромопротеинов гемоглобин является наиболее изученным пигментом эритроцитов. Гемоглобин, соединяясь с кислородом, становится оксигемоглобином, который отдает свой кислород другим веществам и снова превращается в гемоглобин. Значение гемоглобина в жизни человека и животных очень велико. Он играет роль переносчика кислорода от легких к тканям. Образовавшийся в легких оксигемоглобин транспортируется по организму кровью и способствует окислительным процессам в организме, выделяя свой кислород. Кроме того, гемоглобин вместе с плазмой крови регулирует рН крови и транспорт углекислого газа в организме. Гликопротеины. Некоторые белки этой группы обнаруживаются в слизистых соединениях животных организмов и свойства этих выделений вытягиваться в нити определяются даже при относительно большом разведении. Эти белки образуются в поднижнечелюстной железе, печени, железах желудка и кишечника. Другие гликопротеины обнаружены в хрящах, яичном белке, стекловидном теле глаза и др. Исследуемые представители гликопротеинов представляют собой соединения белков с веществами, содержащими остатки некоторых производных углеводов, серной и уксусной кислот. 3. Свойства белков Белки являются амфотерными электролитами. При определенном значении рН среды количество положительных и отрицательных зарядов в белковой молекуле одинаково. Белки имеют разнообразную структуру. Существуют водонерастворимые белки и водорастворимые белки. Существуют белки, химически неактивные и устойчивые к агентам. Некоторые белки крайне нестабильны. Есть белки, похожие на волокна, достигающие в длину сотен нанометров; есть белки, имеющие форму сфер диаметром всего 5-7 нм. Они имеют высокую молекулярную массу . Различают несколько химических свойств белка. 1.Гидратация. Процесс гидратации заключается в связывании воды белками, при этом они проявляют гидрофильные свойства: набухают, увеличиваются их масса и объем. Набухание белка сопровождается его частичным растворением. Гидрофильность отдельных белков зависит от их структуры. Имеющиеся в составе гидрофильные амидные (-CO-NH-, пептидная связь), аминные (NH2) и карбоксильные (СООН) группы, расположенные на поверхности белковой макромолекулы, притягивают молекулы воды и строго ориентируют их к поверхности белковая макромолекула... молекула. . Гидратная оболочка (вода) обволакивает белковые глобулы и препятствует стабильности белковых растворов. В изоэлектрической точке белки обладают наименьшей способностью связывать воду, гидратный слой вокруг белковых молекул разрушается, в результате чего образуются крупные агрегаты. Агрегация белковых молекул также происходит при их обезвоживании некоторыми органическими растворителями, такими как этиловый спирт. Это приводит к осаждению белка. При изменении рН среды белковая макромолекула заряжается и изменяется ее гидратационная способность. При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые желе. Желе не текучие, эластичные, обладают пластичностью, определенной механической прочностью, способны сохранять форму. Глобулярные белки могут быть полностью гидратированы при растворении в воде (например, молочные белки), образуя растворы с низкой концентрацией. Гидрофильные свойства белков имеют большое значение в биологии и пищевой промышленности. Высокоподвижным желе, построенным преимущественно из белковых молекул, является цитоплазма - полужидкое содержимое клетки. Высокогидратированное желе представляет собой сырой глютен, выделенный из пшеничной муки, и содержит до 65% воды. Гидрофильность, основное качество зерна пшеницы, злаковых белков и муки, играет важную роль при хранении и переработке крупы, в хлебобулочном производстве. Тесто, которое получается при выпечке, представляет собой набухший от воды белок, концентрированный кисель, содержащий крупинки крахмала. 2. Денатурация белков.  При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, т. е. ее нативной пространственной структуры. Первичная структура и, следовательно, химический состав белка не изменяется. Изменяются физические свойства: снижается растворимость, теряется способность к гидратации, биологическая активность. Изменяется форма белковой макромолекулы, происходит агрегация. При этом повышается активность некоторых групп, облегчается действие протеолитических ферментов на белки и, следовательно, они легче гидролизуются. В пищевой технологии особое практическое значение имеет термическая денатурация белков, степень которой зависит от температуры, времени нагревания и влажности. Это необходимо учитывать при разработке способов термической обработки пищевого сырья, полуфабрикатов, а иногда и готовых изделий. Процессы термической денатурации играют особую роль при отбеливании растительного сырья, сушке круп, выпечке хлеба и макаронных изделий. Денатурация белков может быть вызвана и механическим воздействием (давление, трение, взбалтывание, ультразвук). Действие химических реагентов (кислоты, щелочи, спирт, ацетон) приводит к денатурации белка. Все эти методы широко используются в пищевой и биотехнологии. Существует также ренатурация (высаливание) — обратный процесс денатурации, при котором белки возвращаются к своей естественной структуре. Следует отметить, что не все белки способны к ренатурации; в большинстве белков денатурация необратима. 3.Пенообразование. Процесс вспенивания — это способность белков образовывать высококонцентрированные жидкие газообразные системы, называемые пенами. Устойчивость пены, пенообразователем в которой является белок, зависит не только от ее природы и концентрации, но и от температуры. Белки широко используются в качестве пенообразователей в кондитерской промышленности (зефир, суфле). Хлеб имеет пенистую структуру, что сказывается на его вкусовых свойствах.  4.Горение. Белки сгорают с образованием азота, углекислого газа и воды, а также других веществ. Ожог сопровождается характерным запахом горелых перьев. 5.Цветные реакции. • Ксантопротеин – происходит взаимодействие ароматических и гетероатомных колец в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением желтой окраски; • Биурет – Взаимодействие слабощелочных белковых растворов с раствором сульфата меди(II) приводит к образованию комплексных соединений между ионами Cu2+ и полипептидами. Реакция сопровождается появлением сине-фиолетовой окраски.; • При нагревании белков со щелочью в присутствии солей свинца образуется черный сернистый осадок. амфотерные свойства Белки содержат карбоксильные и аминогруппы, и под действием щелочи белок вступает в реакцию в форме аниона - соединяется с катионом щелочи и образует альбуминатную соль. Под действием кислот превращается в катион и образует синтонин: 6.Гидролиз белков. Реакция гидролиза идет с образованием аминокислот. В общем виде ее можно записать так:  4. Значение белков БЕЛКИ-ФЕРМЕНТЫ. В каждой живой клетке непрерывно происходят сотни биохимических реакций. Быстрое протекание этих реакций обеспечивают биологические катализаторы или ускорители реакций - ферменты. Известно более тысячи различных ферментов. Они все белые. Каждый фермент обеспечивает одну или несколько реакций одного типа. Например, жиры в пищеварительном тракте (как и внутри клеток) расщепляются специальным ферментом, который не действует на полисахариды (крахмал, гликоген) или белки. В свою очередь фермент, расщепляющий только крахмал или гликоген, не действует на жиры. Каждая молекула фермента способна выполнять от нескольких тысяч до нескольких миллионов одинаковых операций в минуту. Вклад этих ферментативных белковых реакций не расходуется. Он соединяется с реагирующими веществами, ускоряет их превращения и оставляет реакцию неизменной. Ферменты лучше всего работают только при оптимальной температуре (например, у человека и теплокровных животных при 37 °С) и при определенной концентрации ионов водорода в окружающей среде. Процесс расщепления или синтеза какого-либо вещества в клетке обычно разбивают на ряд химических операций. Каждая операция выполняется отдельным ферментом. Группа таких ферментов образует своего рода биохимический трубопровод. БЕЛКИ-ГОРМОНЫ. Гормоны являются регуляторами физиологических процессов. Некоторые (но не все) гормоны животных и человека являются белками. Например, белковый гормон инсулин (гормон поджелудочной железы) активирует клетки для поглощения молекул глюкозы и их расщепления или хранения внутри клетки. Когда инсулина не хватает, в крови накапливается избыток глюкозы. Без инсулина клетки не могут его захватить — они голодают. Это то, что вызывает диабет, заболевание, вызванное недостатком инсулина в организме. Гормоны являются важнейшими функциями организма и контролируют активность ферментов. Например, инсулин активирует в клетках печени фермент, синтезирующий из глюкозы и многих других ферментов другое органическое вещество — гликоген. БЕЛКИ-СРЕДСТВА ЗАЩИТЫ. При попадании бактерий или вирусов в кровь животных и человека организм реагирует выработкой специальных защитных белков – антител. Эти белки связываются с белками чужеродных для организма возбудителей, подавляя их жизнедеятельность. На каждый чужеродный белок в организме вырабатываются особые «антибелки» — антитела. Механизм устойчивости к возбудителям называется иммунитетом. Помимо растворенных в крови антител, на поверхности особых клеток есть антитела, захватывающие чужеродные клетки. В большинстве случаев этот клеточный иммунитет обеспечивает уничтожение новообразованных раковых клеток. Для предотвращения заболеваний людям и животным вводят ослабленные или убитые бактерии или вирусы (вакцины), которые не вызывают заболевания, а вместо этого заставляют специальные клетки организма вырабатывать антитела против этих патогенов. Если через какое-то время в такой организм попадает неаттенуированный патогенный вирус или бактерия, они сталкиваются с сильным защитным барьером из антител. РОЛЬ БЕЛКОВ ДЛЯ ЧЕЛОВЕКА. Белки, которые расщепляются в организме, являются, подобно углеводам и жирам, источником энергии. Энергия, полученная при расщеплении белков, может без вреда для организма компенсироваться энергией расщепления жиров и углеводов. Однако очень важно, что организмы человека и животных не могут обходиться без регулярного поступления белков извне. Опыт показывает, что даже длительное исключение жиров или углеводов из рациона животного не вызывает серьезных проблем со здоровьем. Но прием пищи, не содержащей белка, в течение нескольких дней приводит к тяжелым заболеваниям, а длительное безбелковое кормление неизбежно заканчивается гибелью животного. Все это происходит при диете, богатой углеводами и жирами. Сколько белка необходимо в рационе человека для поддержания здоровья и работоспособности? «Фактор износа» у взрослого человека составляет около 23 граммов белка. Но азотистый баланс устанавливается за счет употребления в рационе большего количества белка, чем требует так называемый «фактор износа». В среднем азотистый баланс человека устанавливается при употреблении от 30 до 45 граммов белка в день. Этот минимум белка, необходимый для поддержания баланса азота в рационе, полностью покрывающем энергетические потребности организма, называется «физиологическим белковым минимумом». Таким образом, баланс азота у людей и животных может быть достигнут за счет потребления примерно вдвое большего количества пищевого белка, необходимого в соответствии с «фактором износа». Ученые пришли к выводу, что при расходе энергии в 1500 ккал и в жарком климате взрослый человек должен съедать в день не менее 100 г белка - не менее 120 г белка. Эти нормы соответствуют полностью механизированному умственному или физическому труду. Если вы тратите больше энергии, то есть при физической работе, которая недостаточно механизирована, то вам необходимо дополнительно 10 граммов белка на 500 ккал. Для физической работы с энергозатратами 4000 ккал требуется 130-150 г белка в сутки. Растущий организм нуждается в белке в зависимости от возраста. Нормы белка для детей приведены в таблице ниже: Для удовлетворения потребности организма необходимо не только количество, но и качество белка в пище. Разные белки отличаются друг от друга процентным содержанием аминокислот. В зависимости от состава аминокислот организму требуется больше одного белка и меньше другого. В этом смысле можно говорить о различной биологической ценности белков. Степень усвоения организмом также определяет биологическую ценность белка. Белки, присутствующие в потребляемой пище, содержат все аминокислоты в различных количествах. Изучение метаболизма азота у взрослых показало, что все восемь незаменимых аминокислот и источников азота необходимы для хорошего здоровья. Но установленные «оптимальные уровни» аминокислот для питания человека не постоянны при всех условиях. Они могут значительно и неравномерно расти по разным аминокислотам при определенных физиологических или патологических состояниях. Если пища, состоящая из нескольких продуктов, содержит неполные белки с разным составом аминокислот, дополняющих друг друга, то в результате из разных продуктов с неполными белками мы получаем пищу с белковым составом, соответствующим потребностям организма. В таблице показано содержание белка в различных продуктах. Заключение Подводя итог, нужно сказать, что вся жизнь на Земле обязана своим бесконечным разнообразием уникальным белковым молекулам. Белки, или протеины (от греческого «протос» — «первый»), — это природные органические соединения, обеспечивающие все жизненные процессы любого организма. Хрусталик глаза и паутинка, панцирь черепахи и ядовитые вещества грибов состоят из белков. Белок помогает нам переваривать пищу и бороться с болезнями. Благодаря особым белкам ночью светлячки светятся, а в глубинах океана загадочным светом мерцают медузы. Белковых молекул в живой клетке во много раз больше, чем всех остальных (кроме воды, конечно). Ученые установили, что белки составляют более половины их сухой массы у большинства организмов. Белок является важным компонентом каждой клетки нашего организма. Это органическое соединение, состоящее из 20 аминокислот, которые также известны как строительные блоки жизни. Как из 33 букв алфавита можно составить бесконечное количество слов, так из аминокислот — бесконечное количество белков. В организме человека насчитывается до 100 000 белков. С белками связано все многообразие функций организма, однако, наиболее важными из них являются: • каталитическая • транспортная • защитная • сократительная • структурная • гормональная • питательная Список литературы 1. Беляев Д. К. Общая биология.- М.: Просвещение,2002. 2. Беляев Д.К., Воронцов Н.Н., Дымишц Г.М. и др. Общая биология. М.: Просвещение, 1999. 3. Габриелян О. С. Химия 11 класс.- М.: Дрофа, 2002. 4. Кузовая Т.В., Калякина Е.А. Белки. "Химия" (Издательский дом "Первое сентября"), 2003, № 3 5. Ленинджер А. Основы биохимии. В 3 томах. - М.: Мир, 2005 6. Макареня А.А. Повторим химию. М.: Высшая школа, 1989. 7. Страйер Л. Биохимия. В 3 томах. - М.: Мир, 1984. 8. Хомченко Г. П. Химия для поступающих в вузы.- М.:Высшая школа,1985 9. Чертков И.Н. Эксперимент по полимерам в средней школе. М.: Просвещение, 1991 10. Я. Кольман, К.-Г. Рем. Наглядная биохимия. М.: Мир, 2000 |
