Задачи 1-3 химия к Экзамену. Задача 1. Титр раствора сульфата натрия (Na 2 so 4 ) составляет 0,0284 гмл. Определить молярную концентрацию раствора
 Скачать 54.43 Kb. Скачать 54.43 Kb.
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯРОССИЙСКОЙ ФЕДЕРАЦИИСибирский государственный университет геосистем и технологийЗадачи к экзамену по предмету Химия Преподаватель: Степанова С.А. Выполнил: обучающийся гр.1ГДВ-у Келлер С.В. Новосибирск 2022 Задачи к экзамену Задача №1. Титр раствора сульфата натрия (Na2SO4) составляет 0,0284 г/мл. Определить молярную концентрацию раствора. Решение Дано: 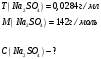 Согласно условия задания титр раствора сульфата натрия составляет 0,0284 г/мл или 28,4 г/л. Тогда для вычисления молярной концентрации раствора можно использовать формулу: 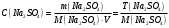 Подставим числовые данные в формулу: 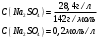 Ответ: 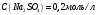 . .Задача № 2. В каком объёме насыщенного раствора содержится 1 мг сульфида серебра (Ag2S)? ПР данной соли составляет 2,0∙10-50. Решение Дано: 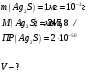 Сульфид серебра является малорастворимым веществом, в водных растворах он содержится в очень малой мере. И его растворение характеризуется произведением растворимости. Запишем уравнение диссоциации вещества: 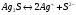 Для произведения растворимости сульфида серебра можно записать: 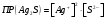 Для растворимости вещества можно записать формулу: 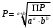 Тогда: 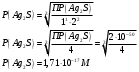 Растворимость является молярной концентрацией вещества, поэтому можно записать: 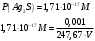 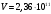 л л Ответ: 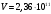 л. л. Задача № 3. Раствор содержит в 1 литре 54 г глюкозы (С6Н12О6). При одинаковой температуре раствор глюкозы изотоничен раствору нитрата калия (KNO3). Содержится 0,166 моль нитрата калия в 1 литре раствора. Растворы изотоничны друг другу, если равны их осмотические давления. Найти кажущуюся степень диссоциации раствора нитрата калия. Решение Дано: 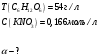 Для растворов глюкозы и раствора нитрата калия можно записать, что их осмотические давления одинаковы: 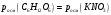 Поскольку осмотическое давление является произведением концентрации на универсальную постоянную R и температуру Т, то можно записать: 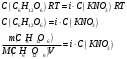 Согласно условия задания нам дано раствор нитрата калия, в водном растворе он диссоциирует на ионы согласно формулы: 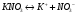 Для него можно записать: i= 1 + (k-1) Данная соль диссоциирует на две частицы и следовательно, k = 2. i = 1 + (2 – 1) =1 + Тогда формула примет вид: 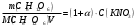 Учтем, что молярная масса глюкозы равна 180 г/моль и тогда: 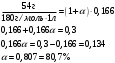 Ответ: а = 80,7% |
