|
|
Решение задач по АХиФХМА. К.р. ах и фхма. Задача 2 (71)
Задача №1 (50)
Вычислите объем раствора соляной кислоты с титром 0,0050 г/мл, требуемый для нейтрализации 0,2000 г карбоната натрия до углекислого газа.
Дано:
T(HCl)= 0,0050 г/мл
m( Na2CO3) = 0,07 г
|
2HCl+Na2CO3 → 2NaCl+CO2↑+H2O
C(HCl)=T(HCl)*1000/M(HCl)=0,0050*1000/36,5=0,1369 моль/л
M(Na2CO3)=106 г/моль
n(Na2CO3)=0,2000/106=0,0019 моль
n(HCl)=2* n(Na2CO3)=2*0,0019=0,0038 моль
C=n/V → V=n/C
V(HCl)=0,0038/0,1369=0,0278 л = 27,8 мл
|
V(HCl) - ?
|
|
Задача №2 (71)
Вычислите рН раствора, полученного при добавлении к объему V1 20 мл раствора вещества HNO3. с концентрацией С 0,1 моль/л объема V2 25 мл. раствора вещества КОН с концентрацией С 0,100 моль/л.
Дано:
V1(HNO3)=20 мл
C1(HNO3)=0,1моль/л
V2(KOH)=25 мл
C2(KOH)=0,1 моль/л
|
В 20 мл (0,02 л) 0,1 моль/л раствора HNO3 содержится
n=0,02*0,1=0,002 моль HNO3
HNO3 + KOH → KNO3 + H2O
Степень оттитрованности:
f = CщVщ/CкVк = 25*0,1/20*0,1 = 1,25, f > 1 тогда
[H+] = (Kw/Cщ*(f-1))*( Vк/(Vк+Vщ)
[H+] = (1*10-14/0,1*(1,25-1))*(20/(20+25))=1,8*10-13
pH = -lg[H+] = -lg1,8*10-13 = 12,74
|
pHр-ра - ?
|
|
Задача №3 (90)
Рассчитайте степень чистоты ( в %) пробы, загрязненной H2C2O4 ⸱2H2O , если для титрования 0,4 г этого вещества требуется 28,6 мл раствора KMnO4 , 1 мл которого содержит 5,98 мг KMnO4
Дано:
mпробы=0,4 г
V(KMnO4) = 28,6 мл
ρ(KMnO4) = 5,98 мг/мл
|
M(H2C2O4⸱2H2O) = 126 г/моль
M(KMnO4) = 158 г/моль
m(KMnO4) = ρ*V = 5,98*28,6 = 171,028 мг
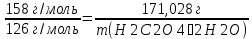
m(H2C2O4⸱2H2O)=126*171,028/158=136,4 г
ꞷч.пр.=263,6*100%/400 = 65,9%
|
х - ?
|
|
Задача №4 (110)
При титровании к объему 50 мл раствора вещества TlCl с молярной концентрацией эквивалента 0,10 моль/л добавили раствор вещества CeCl4 с молярной концентрацией эквивалента 0,10 моль/л. Рассчитайте потенциал в точках, соответствующим добавленному объему раствора В: а) 25 мл, б) 50 мл, в) 51мл.
Дано:
V(TlCl)=20 мл
C(TlCl)=0,1моль/л
C(CeCl4)=0,1 моль/л V1(CeCl4)=25 мл
V2(CeCl4)=50 мл V3(CeCl4)=51 мл
|
2TlCl + 4CeCl4 → 4CeCl3 + 2TlCl3
Tl+ -2е → Tl3+ ;
Се4+ +е →Се3+
а) рассчитываем количество окислителя и восстановителя до реакции:
n=CH*V
n(Tl+)=50*0,1=5 ммоль
n(Се4+)=25*0,1=2,5 ммоль > n(Tl+)
Рассчитываем количество веществ после проведения реакции:
n(Tl+)=5-2,5=2,5 ммоль
n(Tl3+)= n(Се4+)=2,5ммоль
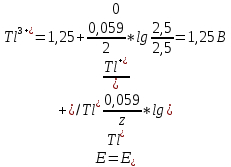
б) рассчитываем количество окислителя и востановителя до реакции:
n(Се4+)=50*0,1=5 ммоль = n(Tl+)
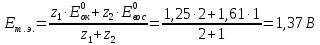
в) рассчитываем количество окислителя и восстановителя до реакции:
n(Се4+)=51*0,1=5,1 ммоль < n(Tl+)
Рассчитываем количество веществ после проведения реакции:
n(Се4+)=5,1-5=0,1ммоль
n(Се3+)=0,1*50=5ммоль
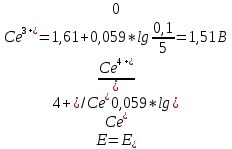
|
E1,2,3 - ?
|
|
Задача №5 (120)
Рассчитайте потенциал в точке эквивалентности и скачок ±1% при титровании в кислой среде ([H+]=0,1моль/л ) V1 10 мл раствора вещества MnSO4 с молярной концентрацией эквивалента С1 0,1 моль/л раствором вещества K2Cr2O7 с молярной концентрацией эквивалента С2 0,1моль/л.
Дано:
V(MnSO4)=10 мл
C(MnSO4)=0,1моль/л
C(K2Cr2O7)=0,1 моль/л
|
3MnSO4+K2Cr2O7+H2SO4 → K2SO4+ Cr2(SO4)3+3MnO2+H2O
Cr2O72- + 3e → Cr3+|окислитель
Mn2+ - 2e → MnO2|восстановитель
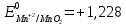
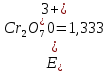
1. Расчет потенциала до точки эквивалентности
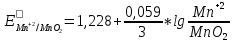
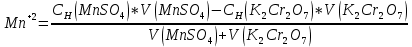
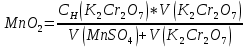
1% от 10 мл равняется 1 мл, тогда
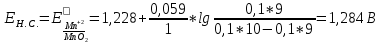
2. Расчет потенциала в точке эквивалентности
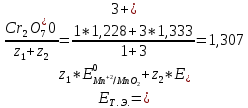 B B
3. Расчет потенциала после точки эквивалентности
После точки эквивалентности в растворе в избытке находится титрант, поэтому потенциал раствора рассчитываем для пары 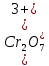 : :
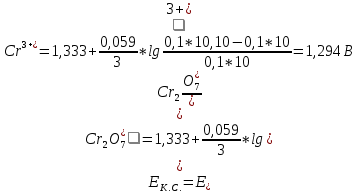
|
E - ?
|
| |
|
|
 Скачать 14.07 Kb.
Скачать 14.07 Kb.
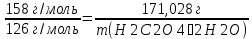
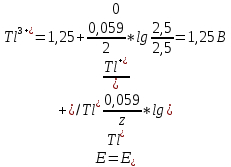
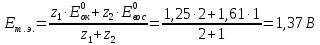
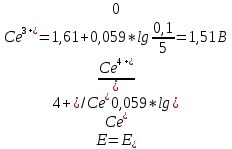
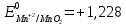
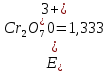
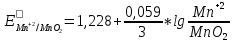
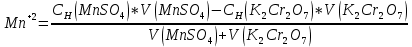
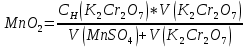
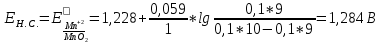
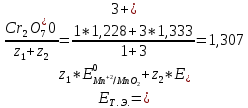 B
B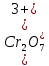 :
: