валера физика пласта от 22.12.21+++++. Задача на определение вязкости природного газа 18 2 Задача на определение плотности и теплоты гидрата природного газа 22 Список литературы 24 Приложение 1 25
 Скачать 3.31 Mb. Скачать 3.31 Mb.
|
|
Содержание ЗАДАНИЕ ПЕРВОЕ – ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ 3 Краткая характеристика газогидратных залежей 7 ЗАДАНИЕ ВТОРОЕ – ПРАКТИЧЕСКИЕ ВОПРОСЫ 11 1.Лабораторные методы определения плотности нефти, нефтепродуктов и пластовых вод. Краткая характеристика 11 3.1 Задача на определение вязкости природного газа 18 3.2 Задача на определение плотности и теплоты гидрата природного газа 22 Список литературы 24 Приложение 1 25 Приложение 2 26 ЗАДАНИЕ ПЕРВОЕ – ТЕОРЕТИЧЕСКИЕ ВОПРОСЫСхема фазовых превращений углеводородов, критическая температура и критическое давление многокомпонентных углеводородных смесей. Характеристика газогидратных залежей. В процессе эксплуатации месторождений в пластах непрерывно изменяются давление, температура, количественное соотношение газа и нефти. Это сопровождается непрерывным изменением состава газовой и жидкой фаз и переходом различных углеводородов из одной фазы в другую. Особенно интенсивно такие процессы происходят при движении нефти по стволу скважины от забоя к устью. Углеводородные газы изменяют объем подобно всем индивидуальным веществам в зависимости от температуры и давления примерно в соответствии с зависимостями, приведенными на рис.1. Справа от пунктирной линии отрезок соответствует газовой фазе, горизонтальный участок - двухфазной газожидкостной области и левый участок - жидкой фазе. Отрезок пунктирной кривой вправо от максимума в точке (С) называется кривой точек конденсации, а влево от максимума - кривой точек парообразования. Точка (С) называется критической. С приближением давления и температуры к их критическим значениям свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает, и плотности их уравниваются. Для изотермических фазовых превращений однокомпонентных газов характерно постоянство давления в двухфазной области до тех пор, пока весь газ не превратится в конденсат. Точно также со снижением давления после начала парообразования дальнейшее кипение жидкой фазы происходит при постоянном давлении. Обе фазы при данной температуре присутствуют в системе только в том случае, если давление равно упругости насыщенного пара этой жидкости. Значительно сложнее закономерности фазовых переходов в двух- и многокомпонентных системах. 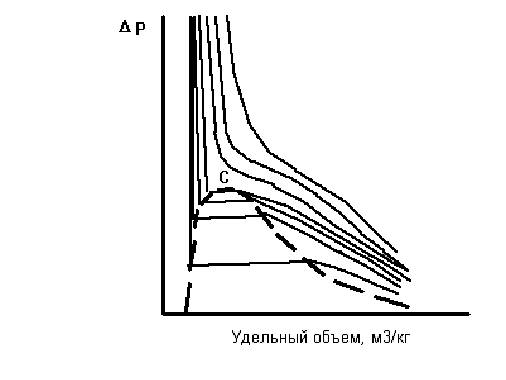 Рис. 1 – Схемы фазовых превращений однокомпонентных систем В отличие от однокомпонентных систем давление в двухфазной области в многокомпонентных системах изменяется. Поэтому давление точки парообразования в них выше давления конденсации. В соответствии с этим не одинаков и состав жидкой и газовой фаз в точках парообразования и конденсации. В бинарных и многокомпонентных системах критическая точка характеризуется лишь одинаково интенсивными свойствами газовых и жидких фаз. При этом в зоне пересечения кривых точек конденсации и парообразования образуется область, в которой могут существовать две фазы даже при температурах и давлениях, превышающих критические значения. Поведение бинарных и многокомпонентных систем в критической области Основной признак критической точки - одинаковые свойства газовой и жидкой фаз, т.е. она находится в точке соединения кривых конденсации и парообразования (С). Если давление несколько меньше (P¢), но больше, чем критическое (Pc), в системе появляется газовая фаза, находящаяся в равновесии с жидкой. Это относится ко всей области ADCA. Точно также в области CNBC существует одновременно две фазы несмотря на то, что при этом температура в системе выше критической (Tc). 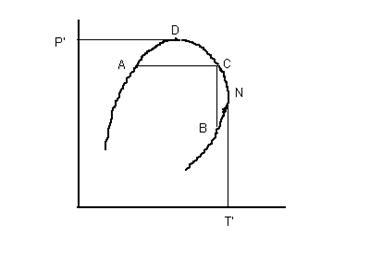 Рисунок 2 – Схема фазовых превращений двух- и многокомпонентных систем Наибольшее давление (P¢), при котором жидкость и пар могут существовать в равновесии, принято называть крикоденбар. Наивысшая температура (T¢), при которой жидкость и пар существуют в равновесии, называется крикодентерм. В области выше критической с изменением температуры и давления в многокомпонентной системе происходят необычные фазовые превращения. Вначале с повышением температуры жидкость закипает и объем газовой фазы увеличивается. Однако достигнув максимума в точке (D) при дальнейшем повышении температуры он снова снижается до нуля. То есть, имеет место обратное изобарическое испарение. Необычные процессы испарения и конденсации возможны также и в области CNBC при температурах выше критической. При изотермическом расширении от любой точки на кривой CN до кривой NB система проходит двухфазную область. Причем количество конденсата в ней вначале увеличивается, а после достижения максимума в точке N снова снижается до нуля в точке, расположенной на кривой начала конденсации. То есть, наблюдается обратная изотермическая конденсация. Аналогичные явления в области выше критических значений давления и температуры наблюдаются не только при изотермическом или изобарическом расширении и сжатии смеси, но и при осуществлении процесса по любому другому закону. Рассмотренные необычные процессы фазовых превращений двух и многокомпонентных систем в области выше критической называются процессами обратного или ретроградного испарения и конденсации. Бинарные и многокомпонентные системы также имеют свои особенности и в области, лежащей вблизи критических давлений и температур. Критическая точка чистых веществ (или однокомпонентных систем) характеризуется самыми высокими давлениями и температурой, выше которых невозможно одновременно существование двух фаз – жидкой и газообразной. В бинарных и многокомпонентных системах критическая точка характеризуется лишь одинаково интенсивными свойствами газовых и жидких фаз. При этом в зоне пересечения кривых точек конденсации и парообразования образуется область, в которой могут существовать две фазы даже при температурах и давлениях, превышающих критические значения. С появлением в системе второго компонента большие различия появляются также в диаграммах «давление — температура». Кривые точек начала кипения и точек росы не совпадают и образуют фазовую диаграмму, на вид которой, кроме температуры и давления влияет исходный состав смеси. Крайние левая и правая кривые на диаграмме (рис. 3.) соответствуют давлениям насыщенного пара для чистых компонентов — этана и н-гептана с критическими точками С и С7. 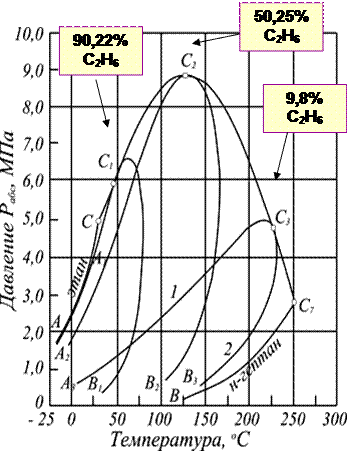 Рис. 3. Диаграмма фазового состояния смеси этана и н-гептана Между ними расположены фазовые диаграммы смесей этана с н-гептаном с массовой концентрацией этана 90,22; 50,25 и 9,8% с соответствующими критическими точками С1, С2 и C3. Пунктирная линия представляет собой огибающую критических точек системы этан — н-гептан. Линии А1С1, А2С2 и А3С3 представляют собой линии точек начала кипения рассматриваемых смесей (выше и слева от них смесь находится в жидком состоянии), В1С1, В2С2 и В3С3 — линии точек росы соответствующих смесей. Ниже и справа от этих линий смесь находится в газообразном состоянии. Между линиями точек начала кипения и точек росы располагается двухфазная область. Из рис. 3. видно, что с увеличением содержания н-гептана в системе критическая точка, располагающаяся слева от максимальных значений давления и температуры, при которых две фазы могут существовать в равновесии, сдвигается вправо от нее. Кривые же точек росы и начала кипения при этом приближаются к кривой давления насыщенного пара, преобладающего в смеси компонента — н-гептана. Аналогично изменяются также критические температуры и давления при изменении состава смеси. Величина критической температуры различных смесей находится между критическими температурами компонентов. По имеющимся экспериментальным данным для ее вычисления можно использовать свойство аддитивности (расчетные значения критических температур при этом получаются более близкими к действительным при выражении состава в процентах по массе, а не в молярных). Критическое же давление смеси обычно выше, чем критическое давление чистых компонентов, кроме тех случаев, когда в смеси один из компонентов содержится в значительном количестве (т. е. правило аддитивности для вычисления ркр смеси нельзя применять). Отклонение фактической величины ркр от вычисленного критического давления по правилу аддитивности возрастает с увеличением разницы между молекулярными массами чистых компонентов. Наибольшее критическое давление обычно наблюдается у смеси с близким массовым содержанием обоих компонентов. Как видно из рис. 3, размеры двухфазной области также зависят от состава смеси — они возрастают по мере того, как в составе смеси распределение между компонентами становится более равномерным. Естественные углеводородные смеси отличаются большим разнообразием состава. Поэтому фазовые диаграммы нефтегазовых смесей, сохраняя принципиальные черты фазовых переходов двухкомпоненных систем, обладают еще своими в основном количественными особенностями, зависящими от состава нефти и газа. Типовые изотермы многокомпонентных углеводородных смесей вблизи критической области показаны на рис. 4. Как уже упоминалось, основной признак критической точки — одинаковые свойства газовой и жидкой фаз, т. е. она находится в точке соединения кривых начала конденсации и парообразования (в точке С). Из этого рисунка следует, что в критической точке давление и температура не наибольшие, при которых еще возможно одновременное существование обеих фаз. Действительно, если давление несколько меньше р' , но больше, чем критическое Рс, в системе появляется газовая фаза, находящаяся в равновесии с жидкой. Это относится ко всей области ADCA. Точно так же в области CNBC существуют одновременно две фазы несмотря на то, что при этом температура в системе выше критической Тс- Наибольшее давление (р' на рис. 4), при котором жидкость и пар могут существовать в равновесии, принято называть к р и к о н д е н б а р . Наивысшая температура (T` на рис. 4), при которой жидкость и пар существуют в равновесии, называется к р и к о н д е н т е р м . 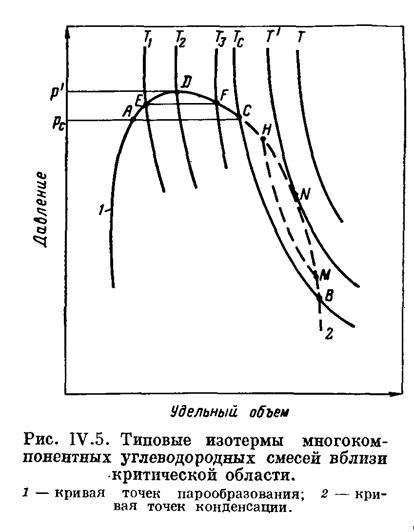 Рис.4 Типовые изотермы многокомпонентных углеводородных смесей вблизи критической области 1 – кривая точек парообразования; 2 – кривая точек конденсации В области выше критической с изменением температуры и давления в многокомпонентной системе происходят необычные фазовые превращения. Чтобы убедиться в этом, рассмотрим изобарическое расширение насыщенной газом жидкости по линии EF (рис. 4) вследствие повышения температуры от Т1 до Т3. В точке Е с увеличением температуры жидкость закипает. По мере увеличения температуры вначале объем газовой фазы увеличивается. Однако с дальнейшим повышением температуры объем газовой фазы, достигнув максимума, очевидно, вновь начинает уменьшаться, так как в точке F1, так же как и в точке Е, лежащей на кривой начала парообразования, содержание паровой фазы в системе равно нулю. |
