СОЧ химия. СОЧ ХИМИЯ. Задания суммативного оценивания за 3
 Скачать 141.49 Kb. Скачать 141.49 Kb.
|
|
Задания суммативного оценивания за 3 четверть по предмету «Химия» 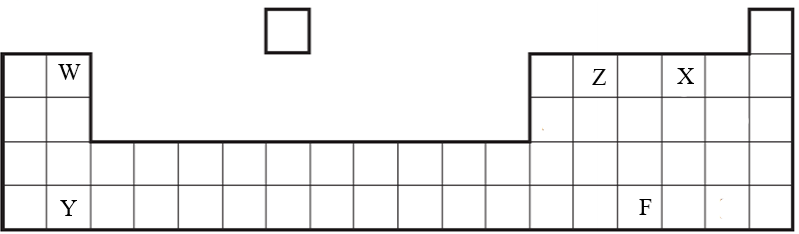 В длинной периодической таблице химических элементов показаны несколько элементов. В длинной периодической таблице химических элементов показаны несколько элементов.Определите элементы, которые имеют одинаковое количество электронов на внешнем энергетическом уровне. Y, F W, Y W, Z, X Z, X, F Бромид магния (MgBr2) – это бинарное ионное соединение. Укажите ряд характерных свойств для бромида магния.
На рисунке показаны различные типы кристаллических решёток веществ. [1] [1] 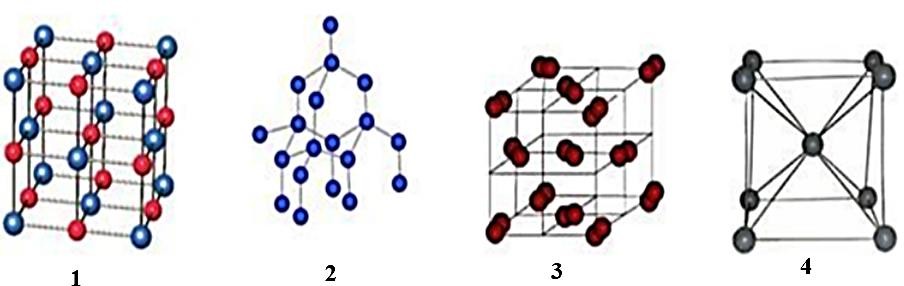 Вещество Х имеет высокую температуру плавления, очень твёрдое, не растворяется в воде, не проводит электрический ток. Предскажите тип кристаллической решётки вещества Х. 1 – ионная решётка 2 – атомная решётка 3 – молекулярная решётка 4 – металлическая решётка [1] В самом начале классификации химических элементов были выделены несколько природных семейств. Приведите не менее двух примеров щелочных металлов, галогенов и инертных газов.
Назовите и объясните причину, по которым элементы объединили в семейства. [3] [2] Итого[5]По порядковому номеру химического элемента можно дать ему полную характеристику. (а) Определите положение элемента в периодической системе с порядковым номером 16. Номер периода:номер группы. [1] Заполните пробелы в первом предложении и подчеркните необходимое слово во втором предложении. Элемент с порядковым номером 16 образует два оксида с формуламии. Эти оксиды обладают (основными / кислотными) свойствами. [2] Итого[3]При обычных условиях атомы большинства химических элементов в свободном виде не существуют. Даже в простых веществах атомы связаны друг с другом химическими связями, исключением являются лишь благородные газы. (а) Определите тип связи, которая образуется между водородом (H) и серой (S). При объяснении используйте значения электроотрицательности данных элементов. электроотрицательность водорода = 2,2 электроотрицательность серы = 2,58 Тип связи[1] Объяснение[1] (b) С помощью диаграммы «точек и крестов» изобразите образование молекулы сероводорода (H2S). [2] Итого[4]На рисунке показана температурная зависимость растворимости различных солей в 100г воды. 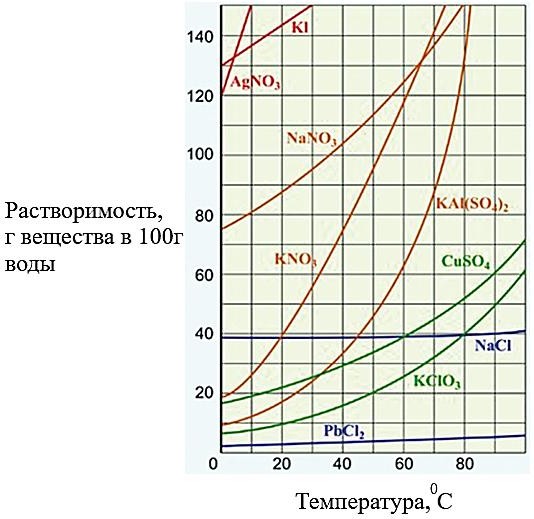 (а) Изучите кривую растворимости сульфата меди (II) (CuSO4) в воде. Опишите изменение растворимости сульфата меди (II) (CuSO4) при повышении температуры. [1] Определите массу сульфата меди (II), которая может раствориться в 100 г воды при температуре 70oC. [1] Насыщенный раствор сульфата меди (II) при температуре 70oC охладили до 40oC. Найдите массу осадка, который образуется при охлаждении насыщенного раствора. [2] (b) Изучите кривую растворимости нитрата натрия (NaNO3) в воде. Растворили 90 г нитрата натрия (NaNO3) в 100 г воды при температуре 40oC. Определите тип приготовленного раствора и объясните свой ответ. [2] Итого[6]Хлорид кальция (CaCl2) — лекарственное средство, восполняющее дефицит Ca2+. (а) Вычислите массу хлорида кальция, которая необходима для приготовления 200 г раствора с массовой долей 15%. Покажите формулу для нахождения массовой доли вещества. [2] (b) 500 мл раствора содержат 22,2 г хлорида кальция. Определите молярную концентрацию раствора. [2] Итого[4] |
