Опорный конспект по газовым законам. Закон БойляМариотта (изотермический процесс)
 Скачать 438.8 Kb. Скачать 438.8 Kb.
|
|
Процессы, при которых один из параметров состояния газа остается постоянным называют изопроцессами. Газовые законы – это законы, описывающие изопроцессы в идеальном газе. Закон Бойля-Мариотта (изотермический процесс) Изотермическим процессом называют изменение состояния газа, при котором его температура остаётся постоянной. Для неизменной массы газа при постоянной температуре произведение давления газа на объем есть величина постоянная: Графики зависимости параметров газа при постоянной температуре называются изотермами. Закон Гей-Люссака (изобарный процесс) Изобарным процессом называют изменение состояния газа, при котором его давление остаётся постоянным. Для неизменной массы газа при постоянном давлении отношение объема газа к температуре есть величина постоянная: Графики зависимости параметров газа при постоянном давлении называются изобарами Закон Шарля (изохорный процесс) Изохорным процессом называют изменение состояния газа, при котором его объем остаётся постоянным. Для неизменной массы газа при постоянном объеме отношение давления газа к его температуре есть величина постоянная: Графики зависимости параметров газа при постоянном давлении называются изохорами. Закон Бойля — Мариотта: 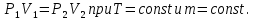 Закон Гей-Люссака: 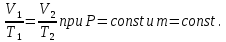 Закон Шарля: Закон Шарля: 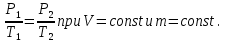 Если в сосуде находится смесь нескольких газов, не вступающих друг с другом в химические реакции, то результирующее давление определяется по закону Дальтона: давление смеси равно сумме давлений, производимых каждым газом в отдельности, как если бы он один занимал весь сосуд. Р = Р1 + Р2 +... + РN 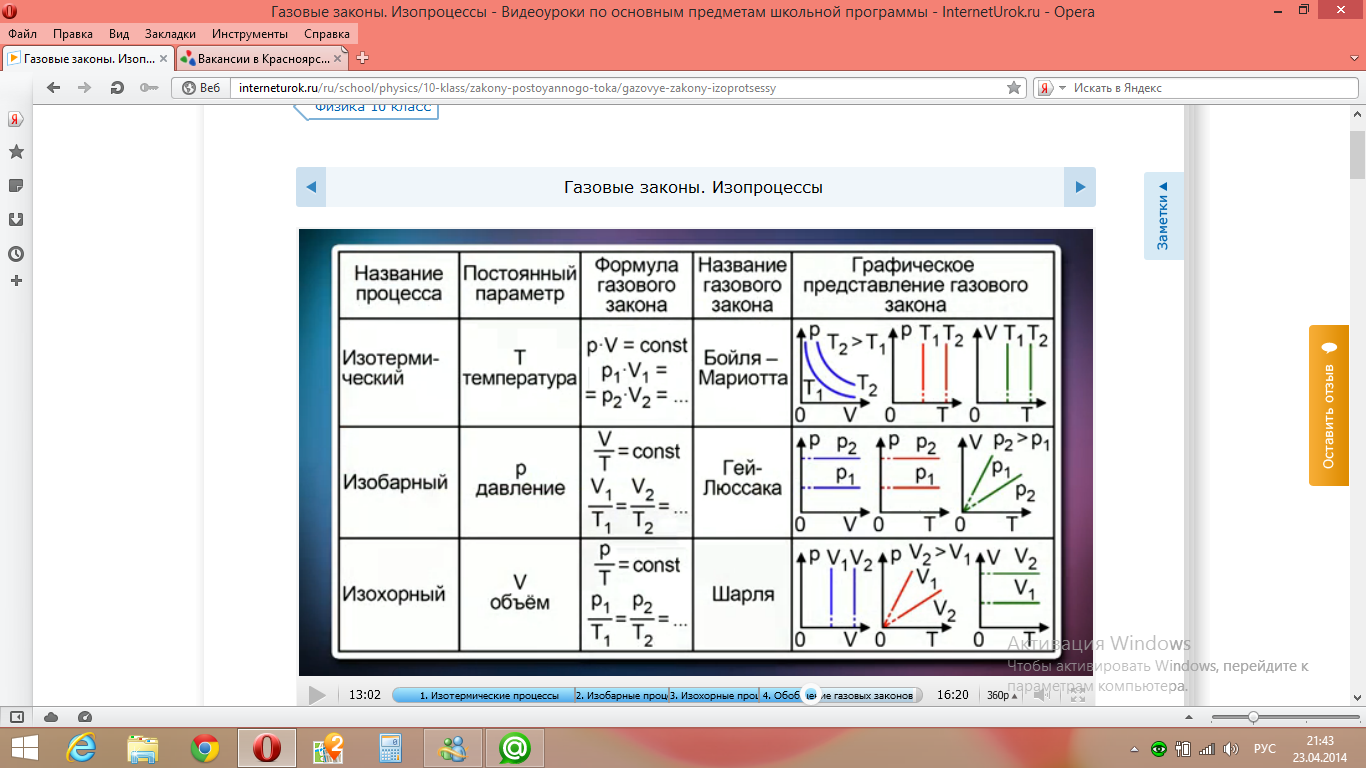 |
