Тема. Строение атома. Периодический закон и периодическая система химических элементов Д. И. Менделеева (ПСХЭ).. строение атома. Закон и периодическая система химических элементов Д. И. Менделеева (псхэ). Состав атома. Атом состоит из атомного ядра и электронной оболочки
 Скачать 256.57 Kb. Скачать 256.57 Kb.
|
ОПРЕДЕЛИТЬ КОЛИЧЕСТВО ЭЛЕКТРОНОВПервое, что нам понадобится - определить количество электронов в данном атоме, количество электронов равно порядковому номеру элемента. Например, для хрома - 24, для водорода - 1, а для хлора - 17. Если у атома не указан заряд - он считается нулевым, в случае, если есть положительный или отрицательный заряд, у атома указывается соответственно: Cr2+ - положительный заряд Cl- - отрицательный заряд Указанное число мы прибавляем к порядковому номеру, если это минус и отнимаем, если это плюс: Cr2+ → 24 - 2 = 22 Cl- → 17 + 1 = 18 Это единственный правильный способ определить количество электронов в атоме. ЗАПИСАТЬ ПОРЯДОК ЭНЕРГЕТИЧЕСКИХ ПОДУРОВНЕЙЕсли Вы забываете, в каком порядке идут энергетические подуровни, делайте такой рисунок: 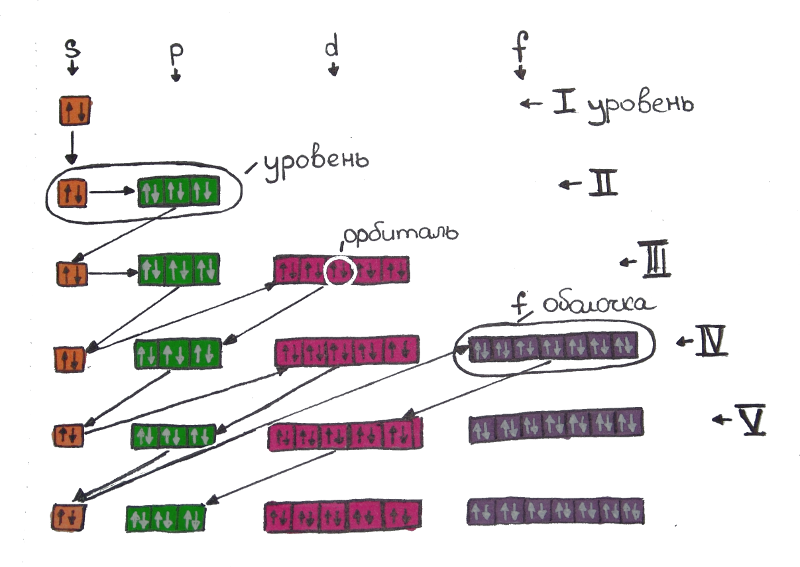 Рисунок 1. Порядок заполнения энергетических уровней Порядок энергетических подуровней следующий: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p ЗАПОЛНИТЬ ЭНЕРГЕТИЧЕСКИЕ ПОДУРОВНИ ЭЛЕКТРОНАМИКоличество электронов на энергетических подуровнях: для s - это 2 электрона, для p - 6, для d - 10, для f - 14. Если не понимаете почему - внимательно читайте статью (ссылка в начале страницы). Берём количество электронов и поочерёдно заполняем, на 1s - 2, на 2s - 2, на 2p - 6 и так далее, пока электроны не закончатся. КАК ПРАВИЛЬНО ЗАПОЛНИТЬ ПОСЛЕДНИЙ ЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬКаждый подуровень заполняется сначала по одному электрону на орбиталь, затем распределяются оставшиеся. Например, у атома кислорода восемь электронов, конфигурация выглядит так: 1s22s22p4. На уровне 2p на одной орбитале два электрона, на двух других по одному!
| |||||||||||||||||||||
