Тема. Строение атома. Периодический закон и периодическая система химических элементов Д. И. Менделеева (ПСХЭ).. строение атома. Закон и периодическая система химических элементов Д. И. Менделеева (псхэ). Состав атома. Атом состоит из атомного ядра и электронной оболочки
 Скачать 256.57 Kb. Скачать 256.57 Kb.
|
|
Тема. "Строение атома. Периодический закон и периодическая система химических элементов Д. И. Менделеева (ПСХЭ)". Состав атома. Атом состоит из атомного ядра и электронной оболочки. Ядро атома состоит из протонов (p+) и нейтронов (n0). У большинства атомов водорода ядро состоит из одного протона. Число протонов N(p+) равно заряду ядра (Z) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов). N(p+) = Z Сумма числа нейтронов N(n0), обозначаемого просто буквой N, и числа протонов Z называется массовым числом и обозначается буквой А. A = Z + N Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е-). Число электронов N(e-) в электронной оболочке нейтрального атома равно числу протонов Z в его ядре. Масса протона примерно равна массе нейтрона и в 1840 раз больше массы электрона, поэтому масса атома практически равна массе ядра. Форма атома - сферическая. Радиус ядра примерно в 100000 раз меньше радиуса атома. Химический элемент - вид атомов (совокупность атомов) с одинаковым зарядом ядра (с одинаковым числом протонов в ядре). Изотоп - совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре). Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов. Обозначение отдельного атома или изотопа: Строение электронной оболочки атома Атомная орбиталь - состояние электрона в атоме. Условное обозначение орбитали - Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов: s, p, d и f. Электронное облако - часть пространства, в которой электрон можно обнаружить с вероятностью 90 (или более) процентов. Примечание: иногда понятия "атомная орбиталь" и "электронное облако" не различают, называя и то, и другое "атомной орбиталью". Электронная оболочка атома слоистая. Электронный слой образован электронными облаками одинакового размера. Орбитали одного слоя образуют электронный ("энергетический") уровень, их энергии одинаковы у атома водорода, но различаются у других атомов. Однотипные орбитали одного уровня группируются в электронные (энергетические) подуровни: s-подуровень (состоит из одной s-орбитали), условное обозначение - p-подуровень (состоит из трех p-орбиталей), условное обозначение - d-подуровень (состоит из пяти d-орбиталей), условное обозначение - f-подуровень (состоит из семи f-орбиталей), условное обозначение - Энергии орбиталей одного подуровня одинаковы. При обозначении подуровней к символу подуровня добавляется номер слоя (электронного уровня), например: 2s, 3p, 5d означает s-подуровень второго уровня, p-подуровень третьего уровня, d-подуровень пятого уровня. Общее число подуровней на одном уровне равно номеру уровня n. Общее число орбиталей на одном уровне равно n2. Соответственно этому, общее число облаков в одном слое равно также n2. Обозначения: Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны упрощенно): 1. Принцип наименьшей энергии - электроны заполняют орбитали в порядке возрастания энергии орбиталей. 2. Принцип Паули - на одной орбитали не может быть больше двух электронов. 3. Правило Хунда - в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары. Общее число электронов на электронном уровне (или в электронном слое) равно 2n2. Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии): 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p ... Наглядно эта последовательность выражается энергетической диаграммой: 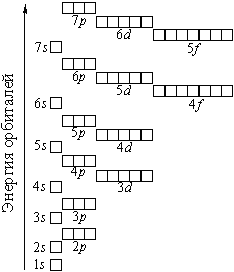 Распределение электронов атома по уровням, подуровням и орбиталям (электронная конфигурация атома) может быть изображена в виде электронной формулы, энергетической диаграммы или, упрощенно, в виде схемы электронных слоев ("электронная схема"). Примеры электронного строения атомов: 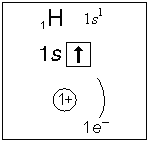 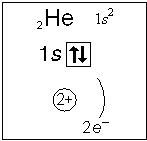 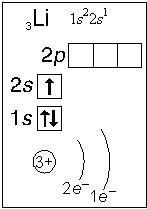 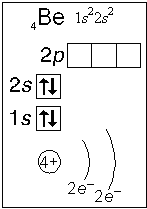 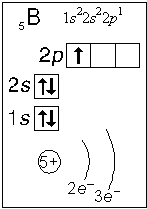 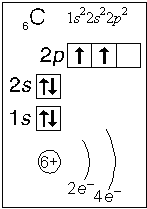 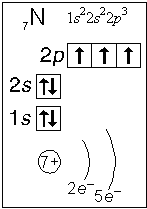 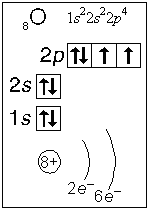 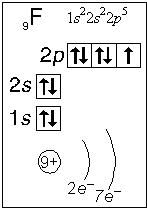 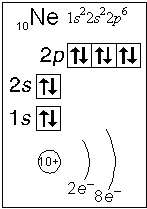 Валентные электроны - электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны - 4s2, они же и валентные; у атома Fe внешние электроны - 4s2, но у него есть 3d6, следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция - 4s2, а атома железа - 4s23d6. Периодическая система химических элементов Д. И. Менделеева (естественная система химических элементов) Периодический закон химических элементов (современная формулировка): свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической зависимости от значения заряда из атомных ядер. Периодическая система - графическое выражение периодического закона. Естественный ряд химических элементов - ряд химических элементов, выстроенных по возрастанию числа протонов в ядрах их атомов, или, что то же самое, по возрастанию зарядов ядер этих атомов. Порядковый номер элемента в этом ряду равен числу протонов в ядре любого атома этого элемента. Таблица химических элементов строится путем "разрезания" естественного ряда химических элементов на периоды (горизонтальные строки таблицы) и объединения в группы (вертикальные столбцы таблицы) элементов, со сходным электронным строением атомов. В зависимости от способа объединения элементов в группы таблица может быть длиннопериодной (в группы собраны элементы с одинаковым числом и типом валентных электронов) и короткопериодной (в группы собраны элементы с одинаковым числом валентных электронов). Группы короткопериодной таблицы делятся на подгруппы (главные и побочные), совпадающие с группами длиннопериодной таблицы. У всех атомов элементов одного периода одинаковое число электронных слоев, равное номеру периода. Число элементов в периодах: 2, 8, 8, 18, 18, 32, 32. Большинство элементов восьмого периода получены искусственно, последние элементы этого периода еще не синтезированы. Все периоды, кроме первого начинаются с элемента, образующего щелочной металл (Li, Na, K и т. д.), а заканчиваются элементом, образующим благородный газ (He, Ne, Ar, Kr и т. д.). В короткопериодной таблице - восемь групп, каждая из которых делится на две подгруппы (главную и побочную), в длиннопериодной таблице - шестнадцать групп, которые нумеруются римскими цифрами с буквами А или В, например: IA, IIIB, VIA, VIIB. Группа IA длиннопериодной таблицы соответствует главной подгруппе первой группы короткопериодной таблицы; группа VIIB - побочной подгруппе седьмой группы: остальные - аналогично. Характеристики химических элементов закономерно изменяются в группах и периодах. В периодах (с увеличением порядкового номера) увеличивается заряд ядра, увеличивается число внешних электронов, уменьшается радиус атомов, увеличивается прочность связи электронов с ядром (энергия ионизации), увеличивается электроотрицательность, усиливаются окислительные свойства простых веществ ("неметалличность"), ослабевают восстановительные свойства простых веществ ("металличность"), ослабевает основный характер гидроксидов и соответствующих оксидов, возрастает кислотный характер гидроксидов и соответствующих оксидов. В группах (с увеличением порядкового номера) увеличивается заряд ядра, увеличивается радиус атомов (только в А-группах), уменьшается прочность связи электронов с ядром (энергия ионизации; только в А-группах), уменьшается электроотрицательность (только в А-группах), ослабевают окислительные свойства простых веществ ("неметалличность"; только в А-группах), усиливаются восстановительные свойства простых веществ ("металличность"; только в А-группах), возрастает основный характер гидроксидов и соответствующих оксидов (только в А-группах), ослабевает кислотный характер гидроксидов и соответствующих оксидов (только в А-группах), снижается устойчивость водородных соединений (повышается их восстановительная активность; только в А-группах). |
