Лекция. Первый закон термодинамики. Лекция. Первый закон термодинамики. The first law of thermodynam. Закон термодинамики. The first law of thermodynamics Уравнение первого закона термодинамики. Теплоемкость газов. Термодинамические процессы идеальных газов. Первый закон термодинамики в общем случае записывается так
 Скачать 42.08 Kb. Скачать 42.08 Kb.
|
|
Лекция. Первый закон термодинамики. The first law of thermodynamics Уравнение первого закона термодинамики. Теплоемкость газов. Термодинамические процессы идеальных газов. Первый закон термодинамики в общем случае записывается так: δQ = dU + δA, где dU – полное изменение внутренней энергии системы (Дж); δQ– элементарное количество тепла, подведенное к системе; δA – элементарная работа, совершаемая системой против внешних сил. Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам. Изотермический процесс, Т=const. Первый закон термодинамики для этого процесса имеет вид: δA=pdv Согласно закону Джоуля, внутренняя энергия идеального газа при Т=const не зависит от объема и не зависит от давления, то есть 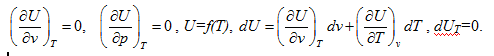 Следовательно, при Т=const, δQT = δAT. Изохорический процесс, v=const. Следовательно, при v=const, δQv = dUили в интегральном виде Qv=∆U. Сообщение телу теплоты в каком либо процессе вызывает изменение его состояния и в общем случае сопровождается изменением температуры. Отношение элементарного количества теплотыδQ, полученного телом при бесконечно малом изменении его состояния, к изменению температуры dT, называется удельной теплоемкостью тела в данном процессе. Теплоемкость при постоянном объеме: размерность теплоемкости: Дж/(моль∙К). Проинтегрируем предыдущее выражение: 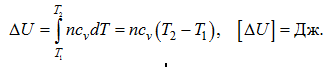 С учетом выражения для идеального газа dU=cvdT, то есть внутренняя энергия идеального газа зависит только от температуры. Что касается реального газа, то его внутренняя энергия зависит и от температуры газа, и от объема газа. Для реальных газов Изобарический процесс, p=const. Работа определяется так: 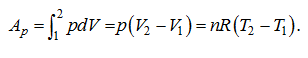 Теплоемкость при постоянном давлении: 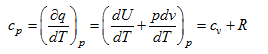 Для идеального газа разность между cpиcV есть величина постоянная. cp–cV=R. Этоуравнение носит название уравнения Майера. Для реальных газов cp–cV>R. Это неравенство объясняется тем, что при расширении реальных газов (при p=const) совершается не только внешняя, но и внутренняя работа, связанная с применением внутренней потенциальной энергией тела, что и вызывает большой расход теплоты. В термодинамике часто используется отношение теплоемкостей k = cp/ cv, Согласно классической кинетической теории газов, величина k определяется числом степеней свободы молекулы. Известны следующие уравнения для определения cpи cV: 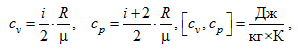 где iчисло степеней свободы, определяемое числом координат однозначно задающих состояние движения. Адиабатический процесс, δQ =0. Первый закон термодинамики для этого процесса имеет следующий вид: –dU=dA При адиабатическом процессе произведение давления на объем газа в степени k есть величина постоянная. Величину k называют показателем адиабаты. Уравнение адиабаты имеет вид: p∙vk= const. |
