Cu + HCl 
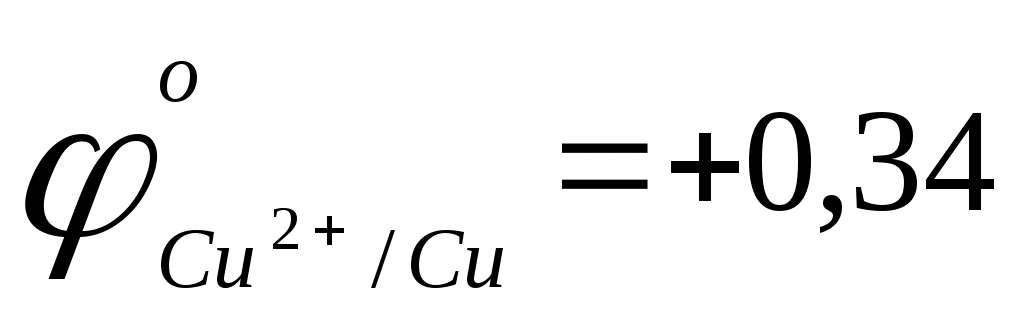 > > 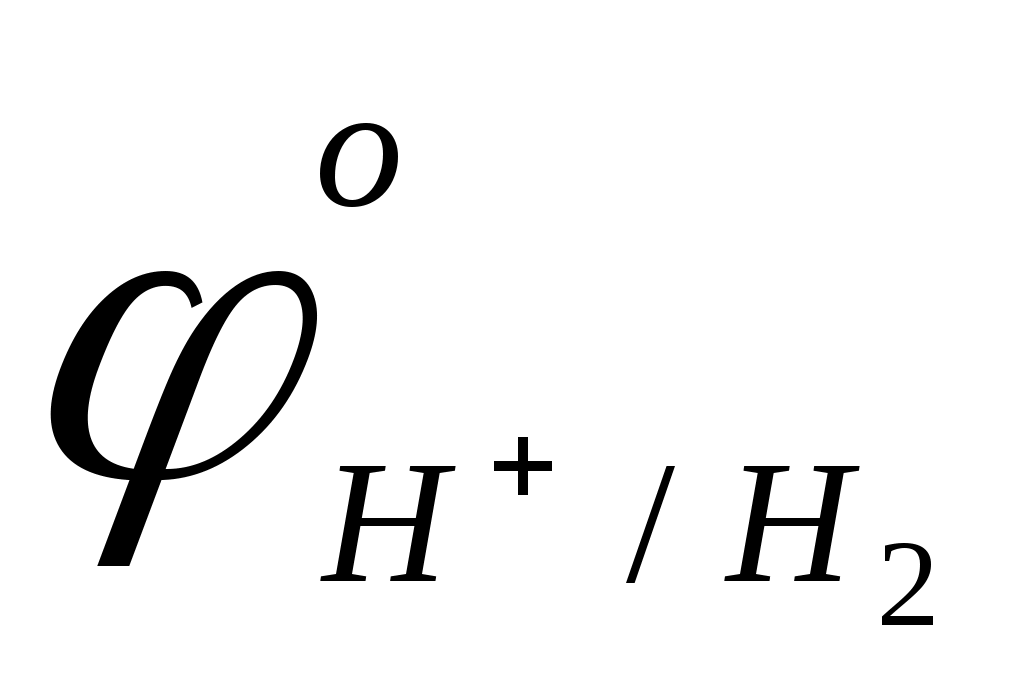
2. Взаимодействие металлов с водой
Окислителем в воде является ион Н+. Окислительные свойства системы
2H+ + 2e  H2 (pH<7) H2 (pH<7)
или
2H2O + 2e  H2 + 2OH– (pH≥7) H2 + 2OH– (pH≥7)
зависят в соответствии с уравнением Нернста от рН раствора (для Т=298К и 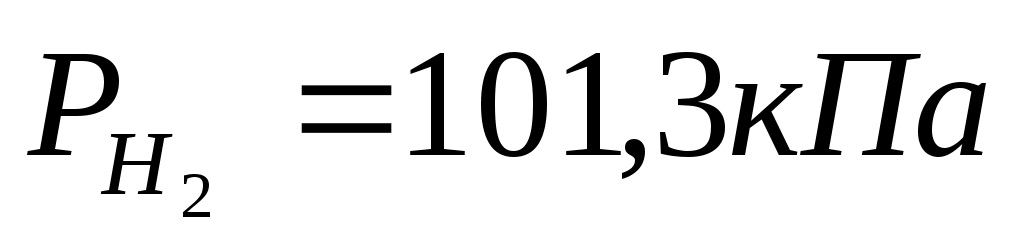 ): ):
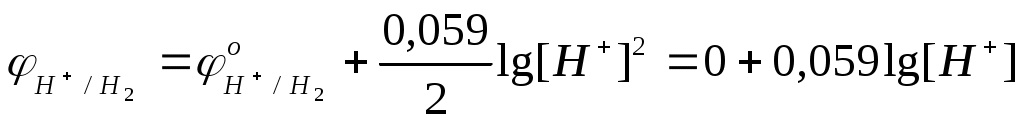
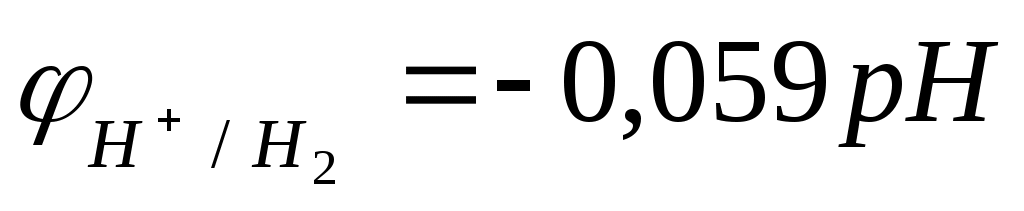
В нейтральной водной среде рН=7 и 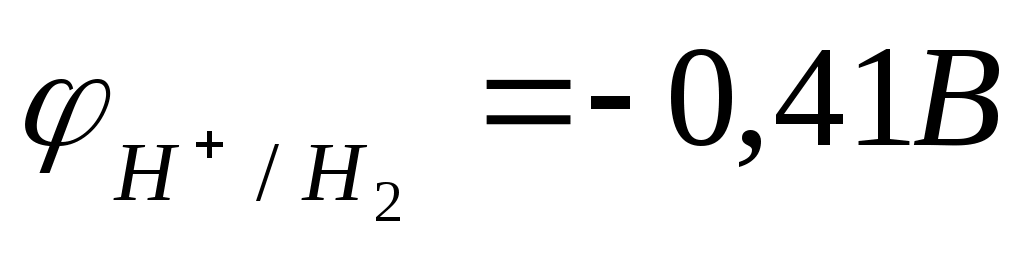 . Термодинамически возможна реакция воды с металлами, для которых . Термодинамически возможна реакция воды с металлами, для которых
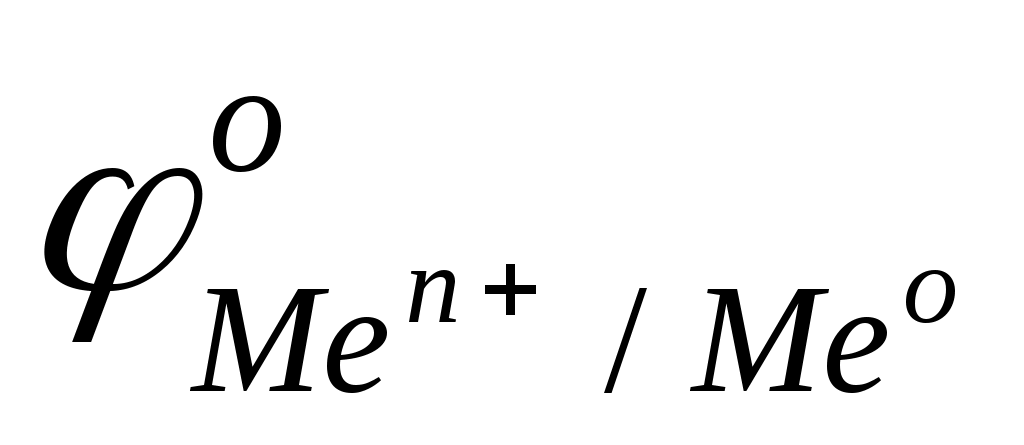 < < 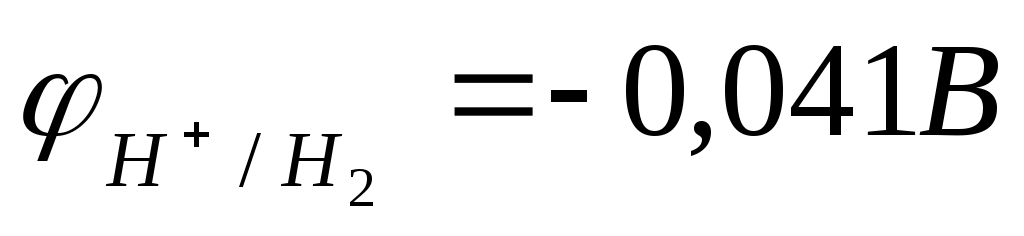 , ,
т.е. стоящими в ряду стандартных окислительно-восстановительных потенциалов металлов левее Cd. Однако большинство из них покрыты защитными оксидными пленками, нерастворимыми в воде, которые и «пассивируют» металлы. Поэтому активно взаимодействуют с водой только щелочные (IA группа) и щелочно-земельные металлы. Продуктами реакции являются молекулярный водород и растворимые гидроксиды металлов.
2Me + 2nH2O → 2Me(OH)n + nH2
Me: Li, Na, K, Rb, Cs, Fr (IA – подгруппа)
Ca, Sr, Ba, Ra (IIA – подгруппа)
3. Взаимодействие металлов с водными растворами щелочей
С водными растворами щелочей взаимодействуют металлы, оксиды и гидроксиды которых растворимы в щелочах, и выполняется условие протекания окислительно-восстановительных реакции
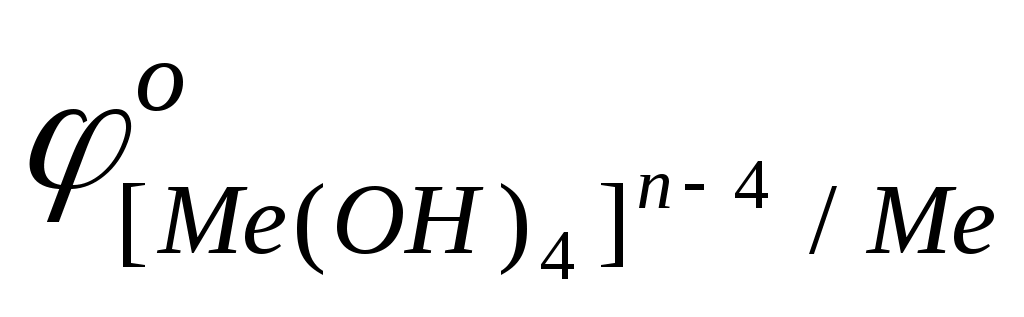 < < 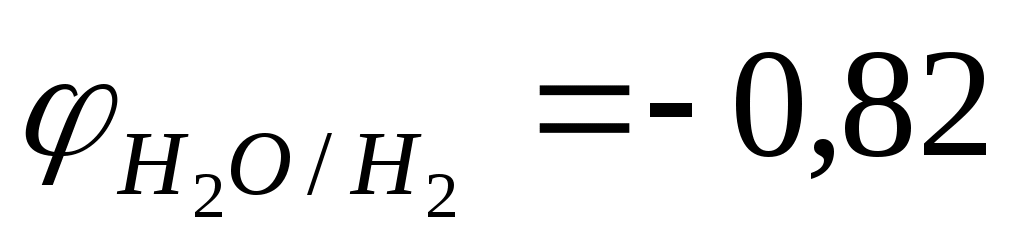
К ним относятся «амфотерные» металлы : Be, Al, Ga, Sn, Pb, Zn.
Продуктами реакции являются молекулярный водород и гидроксокомплексы
2Me + 2nH2O + (8–2n)OH- → 2[Me(OH)4]n-4 + nH2
Например:
Zn + 2H2O + 2NaOH → Na2[Zn(OH)4] + H2
4. Взаимодействие металлов с растворами кислот, окисляющими
ионом Н+
К этой группе относятся кислоты, анионы которых не проявляют окислительных свойств. Например, HF, HCl, HBr, HI, H2CO3, H2S, H3PO4, H2SO4(разб.), RCOOH….
Окислителем в них является ион Н+, по отношению к которому термодинамически неустойчивы все металлы, стоящие в ряду стандартных окислительно-восстановительных потенциалов левее водорода
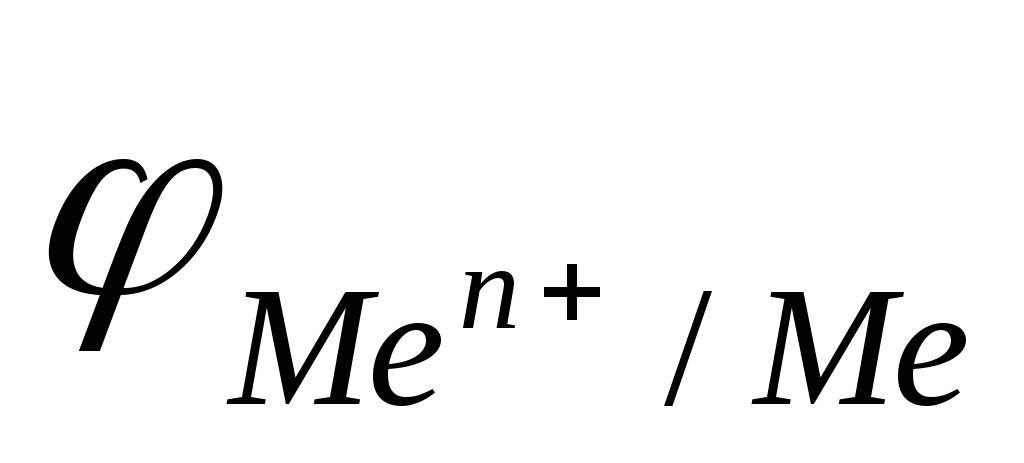 < < 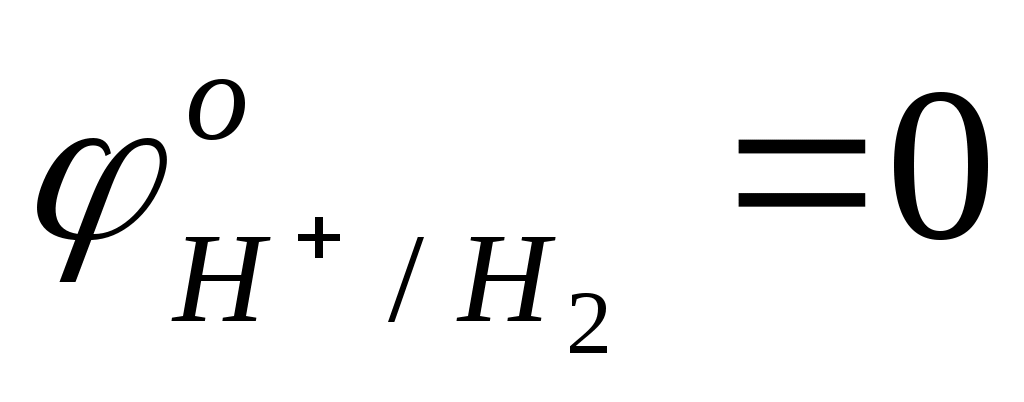
Продуктами реакции металлов с растворами кислот, окисляющими ионом Н+ являются молекулярный водород и соль металла (в меньшей степени окисления).
2Ме + 2nH+ → 2Men+ + nH2
Например:
2Al + 6HCl → 2AlCl3+3H2
+2
Fe + H2SO4 → FeSO4 + H2
разб.
Большинство металлов покрыто оксидами основного или амфотерного характера, растворимыми в кислотах. Поэтому оксидные пленки не пассивируют металлы в кислой среде, за исключением молибдена, вольфрама…, на поверхности которых оксиды – MoO3, WO3 – проявляют кислотные свойства.
Пассивирование металлов в кислой среде возможно, если образующаяся на поверхности металла соль, плохо растворима. Например:
Pb + 2HCl → PbCl2↓ + H2
хол. бел.ос.
или Pb + H2SO4 → PbSO4↓ + H2
разб. бел.ос.
5. Взаимодействие металлов с концентрированной серной кислотой
В разбавленной серной кислоте окислителем является ион Н+, в концентрированной – анион SO42-, за счет S+6. Восстановление сульфат - аниона возможно до серы (S), диоксида серы (SO2) или сероводорода (H2S).
H2SO4(разб.) → H2
 SO2↑ (газ с резким запахом) SO2↑ (газ с резким запахом)
H  2SO4(конц.) S↓ (белый осадок) 2SO4(конц.) S↓ (белый осадок)
H2S↑ (газ с характерным запахом «тухлых яиц»)
Концентрированная серная кислота окисляет металлы, стоящие в ряду стандартных окислительно-восстановительных потенциалов левее серебра. Продуктами реакции металлов с концентрированной серной кислотой являются соль – сульфат металла в высокой степени окисления, вода и продукт восстановления S+6 (SO2, S или H2S). Взаимодействие, как правило, протекает не селективно, по нескольким направлениям
Например

Некоторые металлы (Be, Al, Fe, Co, Ni, V, Nb…) «на холоду» концентрированной серной кислотой пассивируются.
9.3.6. Взаимодействие металлов с азотной кислотой
В азотной кислоте окислителем является анион – NO3–, восстановление которого возможно до любого из продуктов, в соответствии со схемой
  NH4+ NO2 NH4+ NO2
  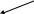 N2H5+ HNO3 HNO2 N2H5+ HNO3 HNO2
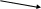 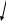 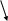
+NH3OH NO
N2 N2O
Окислительно-восстановительные потенциалы для всех реакций восстановления HNO3 близки, поэтому процессы взаимодействия металлов и азотной кислоты неселективные.
Продуктами взаимодействия металла с азотной кислотой являются соль-нитрат металла в высокой степени окисления, вода и продукты восстановления N+5 (NO2, HNO2, NO…, NH+4), состав которых определяется активностью металла и концентрацией кислоты. Концентрированная азотная кислота восстанавливается преимущественно до оксида азота (IV); разбавленная – преимущественно до NO с неактивными металлами или до NH4+ – с активными металлами
 HNO3 (конц) . NO2 HNO3 (конц) . NO2
  NO (с неактивными металлами) NO (с неактивными металлами)
  HNO3(разб.) NH4+ (с активными металлами) HNO3(разб.) NH4+ (с активными металлами)
Например
1. Сu + 4HNO3 конц. → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 разб. → 3Сu(NO3)2 + 2NO + 4H2O
2. 4Zn + 10HNO3 разб. → 4Zn(NO3)2 + NH4NO3 + 3H2O
3. Fe + 4HNO3 разб. → Fe(NO3)3 + NO + 2H2O
Окисляются азотной кислотой металлы, стоящие в ряду стандартных окислительно-восстановительных потенциалов до серебра включительно. Некоторые металлы (Be, Al, Cr, Fe, Co, Ni…) концентрированной азотной кислотой на холоде пассивируются.
Контрольные тестовые задания по теме
ЛР 2«Химические свойства металлов»
Задание 1.1 Среди приведенных металлов наиболее активный:
Ответы: 1) Na; 2) Fe; 3) Mg; 4) Cu; 5) Ag.
Задание 1.2 Используя ряд электродных потенциалов металлов, расположите металлы в порядке увеличения их химической активности:
а) Zn, б) Ca, в) Ag.
Ответы: 1) Zn, Ca, Ag; 2) Ca, Ag, Zn; 3) Ag, Zn, Ca; 4) Ca, Zn, Ag; 5) Zn, Ag, Ca.
Задание 1.3 Используя ряд электродных потенциалов металлов, расположите металлы в порядке увеличения их химической активности:
а) Fe, б) Cu, в) Al.
Ответы: 1) Fe, Cu, Al; 2) Cu, Al, Fe; 3) Al, Fe, Cu; 4) Cu, Fe, Al; 5) Fe, Al, Cu.
Задание 1.4 Используя ряд электродных потенциалов металлов, расположите металлы в порядке увеличения их химической активности:
а) Mg, б) Hg, в) Sn.
Ответы: 1) Mg, Hg, Sn; 2) Hg, Sn, Mg; 3) Sn, Mg, Hg; 4) Hg, Mg, Sn;
5) Mg, Sn, Hg.
Задание 1.5 Используя ряд электродных потенциалов металлов, расположите металлы в порядке уменьшения их химической активности:
а) Na, б) Al, в) Au.
Ответы: 1) Na, Al, Au; 2) Al, Au, Na; 3) Au, Na, Al; 4) Al, Na, Au; 5) Na, Au, Al.
Задание 1.6 Используя ряд электродных потенциалов металлов, расположите ме-
таллы в порядке увеличения их химической активности:
а) Ba, б) Pb, в) Zn.
Ответы: 1) Ba, Pb, Zn; 2) Pb, Zn, Ba; 3) Zn, Ba, Pb; 4) Pb, Ba, Zn; 5) Ba, Zn, Pb.
Задание 1.7. Железо из раствора соли FeCl2 вытесняет:
Ответы: 1) магний; 2) олово; 3) свинец; 4) медь; 5) серебро.
Задание 1.8 Цинк из раствора соли ZnSO4 вытесняет:
Ответы: 1) железо; 2) свинец; 3) медь; 4) никель; 5) алюминий.
Задание 1.9 Металл, который не вытесняет олова из соли SnCl2:
Ответы: 1) Ca; 2) Mg; 3) Cu; 4) Fe; 5) Ni.
Задание 1.10 Железо вытесняет металл из раствора соли:
Ответы: 1) NaCl; 2) Pb(NO3)2; 3) MgSO4; 4) ZnSO4; 5) Al2(SO4)3.
Задание 1.11 Химическая реакция произойдет между веществами:
Ответы: 1) Cu и HCl; 2) Ag и CuSO4; 3) Zn и FeSO4; 4) Zn и MgCl2;
5) Au и AgNO3.
Задание 1.12 Раствор железного купороса можно хранить в посуде из металла:
Ответы: 1) Mg; 2) Zn; 3) Al; 4) Cr; 5) Cu.
Задание 1.13 Раствор медного купороса можно хранить в посуде из металла:
Ответы: 1) Cr; 2) Ag; 3) Fe; 4) Zn; 5) Al.
Задание 1.14 Раствор медного купороса нельзя хранить в посуде из металла:
Ответы: 1) Au; 2) Ag; 3) Fe; 4) Pt; 5) Pd.
Задание 1.15 Никель из сульфата никеля вытесняет металл:
Ответы: 1) Sn; 2) Mg; 3) Cu; 4) Pb; 5) Ag.
Задание 2.1 Водород из разбавленной соляной кислоты вытесняет:
Ответы: 1) медь; 2) золото; 3) платина; 4) серебро; 5) магний.
Задание 2.2 Водород из разбавленной серной кислоты вытесняет:
Ответы: 1) цинк; 2) медь; 3) серебро; 4) золото; 5) платина.
Задание 2.3 Металл, который не вытесняет водород из раствора соляной кислоты:
Ответы: 1) Ca; 2) Fe; 3) Zn; 4) Hg; 5) Sn.
Задание 2.4 Не вытесняет водород из раствора соляной кислоты:
Ответы: 1) K; 2) Ag; 3) Mn; 4) Zn; 5) Li.
Задание 2.5 Металл, который вытесняет водород из раствора соляной кислоты:
Ответы: 1) Cu; 2) Ag; 3) Hg; 4) Mg; 5) Au.
Задание 2.6 Не вытесняет водород из соляной кислоты металл:
Ответы: 1) Mg; 2) Pt; 3) Zn; 4) Fe; 5) Al.
Задание 2.7 Не вытесняет водород из соляной кислоты металл:
Ответы: 1) Ca; 2) Fe; 3) Cu; 4) Mn; 5) Al.
Задание 2.8 Водород из разбавленной серной кислоты вытесняет:
Ответы: 1) Bi; 2) Co; 3) Cu; 4) Ag; 5) Au.
Задание 2.9 Водород из разбавленной серной кислоты вытесняет:
Ответы: 1) Ni; 2) As; 3) Hg; 4) Pt; 5) Bi.
Задание 2.10 Водород из разбавленной серной кислоты вытесняет:
Ответы: 1) Hg; 2) Ag; 3) Pt; 4) Au; 5) Cr.
Задание 2.11 Водород из разбавленной серной кислоты вытесняет:
Ответы: 1) Hg; 2) Cd; 3) Ag; 4) Au; 5) Bi.
Задание 2.12 Водород из разбавленной соляной кислоты не вытесняет:
Ответы: 1) Fe; 2) Zn; 3) Al; 4) Ag; 5) Mg.
Задание 2.13 Водород из разбавленной соляной кислоты не вытесняет:
Ответы: 1) Mg; 2) Al; 3) Be; 4) Cr; 5) Au.
Задание 2.14 Водород из разбавленной соляной кислоты не вытесняет:
Ответы: 1) Pt; 2) Fe; 3) Ca; 4) Mn; 5) Ba.
Задание 2.15Водород из разбавленной соляной кислоты не вытесняет:
Ответы: 1) Sr; 2) Ag; 3) Al; 4) Be; 5) Fe.
Задание 2.16 Водород из разбавленной соляной кислоты не вытесняет:
Ответы: 1) Ca; 2) Zn; 3) Hg; 4) Mg; 5) Mn.
Задание 3.1 С водой взаимодействует металл:
Ответы: 1) Sn; 2) Pb; 3) Cu; 4) Ag; 5) K.
Задание 3.2 Водород из воды вытесняет металл:
Ответы: 1) Na; 2) Au; 3) Cu; 4) Ag; 5) Sn.
Задание 3.3 С водой взаимодействует металл:
Ответы: 1) Co; 2) Sn; 3) K; 4) Pb; 5) Bi.
Задание 3.4 С водой взаимодействует металл:
Ответы: 1) Co; 2) Fe; 3) Ag; 4) Fr; 5) Bi.
Задание 3.5 С водой взаимодействует металл:
Ответы: 1) Mn; 2) Ti; 3) Pb; 4) Cu; 5) Sr.
Задание 3.6 С водой взаимодействует металл:
Ответы: 1) Co; 2) Zn; 3) Ba; 4) Be; 5) Al.
Задание 3.7 С водой взаимодействует металл:
Ответы: 1) Rb; 2) Co; 3) Ni; 4) Bi; 5) Cu.
Задание 3.8 С водой взаимодействует металл:
Ответы: 1) Fe; 2) Cs; 3) Sn; 4) Pb; 5) Ag.
Задание 3.9 С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Al; 2) Mg; 3) Mn; 4) Cu; 5) Ag.
Задание 3.10 С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Fe; 2) Co; 3) Cd; 4) Bi; 5) Zn.
Задание 3.11 С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Cu; 2) Sn; 3) Mn; 4) Ag; 5) Co.
Задание 3.12 С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Ni; 2) Bi; 3) Fe; 4) Pb; 5) Mg.
Задание 3.13 С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Be; 2) Cd; 3) Fe; 4) Hg; 5) Au.
Задание 3.14 С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Co; 2) Ag; 3) Al; 4) Au; 5) Pt.
Задание 3.15 С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Pt; 2) Ca; 3) Mg; 4) Mn; 5) Bi.
Контрольные тестовые задания по теме
ЛР 1«Окислительно-восстановительные реакции»
Задание 4.1 Сумма коэффициентов в уравнении реакции
Cu + HNO3 → Cu(NO3)2 + NO2 + H2O равна:
конц.
Ответы: 1) 3; 2) 6; 3) 5; 4) 8; 5) 10.
Задание 4.2 Сумма коэффициентов в уравнении реакции
Cu + HNO3 → Cu(NO3)2 + NO + H2O равна:
разб.
Ответы: 1) 5; 2) 12; 3) 14; 4) 20; 5) 10.
Задание 4.3 Сумма коэффициентов в уравнении реакции
to
Fe + HNO3 → Fe(NO3)3 + NO2 + H2O равна:
конц.
Ответы: 1) 8; 2) 14; 3) 10; 4) 12; 5) 5.
Задание 4.4 Сумма коэффициентов в уравнении реакции
Fe + HNO3 → Fe(NO3)3 + NO + H2O равна:
разб.
Ответы: 1) 8; 2) 14; 3) 10; 4) 12; 5) 9.
Задание 4.5 Сумма коэффициентов в уравнении реакции
Sn + HNO3 → H2SnO3 + NO2 + H2O равна:
конц.
Ответы: 1) 7; 2) 11; 3) 9; 4) 13; 5) 5.
Задание 4.6 Сумма коэффициентов в уравнении реакции
H2O + Sn + HNO3 → H2SnO3 + NO равна:
разб.
Ответы: 1) 8; 2) 14; 3) 20; 4) 10; 5) 15.
|
 Скачать 298.5 Kb.
Скачать 298.5 Kb.