микробиология. Занятие 3 Тема Бактериологический метод диагностики инфекционных заболеваний. Определение чувствительности микроорганизмов к антибиотикам
 Скачать 1.59 Mb. Скачать 1.59 Mb.
|
|
Лабораторное занятие № 3 Тема Бактериологический метод диагностики инфекционных заболеваний. Определение чувствительности микроорганизмов к антибиотикам. Цель лабораторной работы: научиться проводить простейшие микробиологические исследования; дифференцировать разные группы микроорганизмов по их основным свойствам (т.е. провести идентификацию бактерий с целью установления причины заболевания. Напоминаю, что идентификация – это установление рода и вида возбудителя) Основой бактериологического метода является культивирование бактерий на питательных средах с учетом свойств бактерий, которые определяются их физиологией (питание, дыхание и т.д.) - Задания для студентов: Задание № 1 Разберите типы питательных сред, их классификацию и пригодность для применения в бактериологической практике, используя рисунок 1, 2 и таблицу 1, материал учебника (К.С. Камышева основы микробиологии и иммунологии) стр 74-76 ПИТАТЕЛЬНЫЕ СРЕДЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ 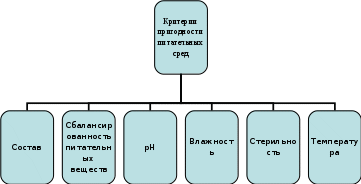 Рис. 1 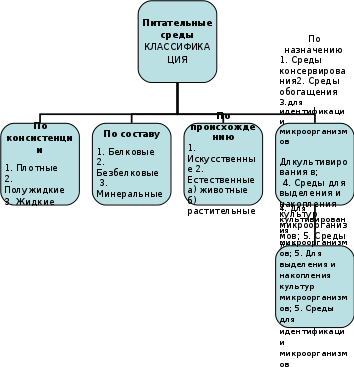 Рис. 2 Таблица 1 ХАРАКТЕРИСТИКА ПИТАТЕЛЬНЫХ СРЕД
Задание № 2 Этапы бактериологического метода диагностики инфекционных заболеваний (запишите в тетради) Выделение бактерий из исследуемого материала Изучение изолированных колоний и накопление чистой культуры Изучение чистой культуры (идентификация) Разбираем все эти этапа Этап Выделение бактерий из исследуемого материала (учебник стр 76-79) (на этом этапе выполняются следующие действия): Микроскопия окрашенных мазков (простые красители-форма, размер, расположение; сложные красители + структурные компоненты обязательные и необязательные: споры-Ожешко; Бури-Гинс – капсулы; Циль-Нильсон- кислотоустойчивые) или нативных - неокрашенных препаратов (выявл. Подвижности-спирохета, холерный вибрион. Например – темнопольная микроскопия) Это мы уже прошли, напоминание Посев на плотные питательные среды для получения роста чистой культуры (изолированные колонии). Простые (МПА), селективные (стафилококк –ЖСА; стрептококк – 5% кровяной агар; сальмонеллы –ВСА), ДДС (Левина, Плоскирева, Эндо) Посев на среды обогощения (селенитовый бульон, магниевая среда и др.) (Среда для обогащения подавляет микроорганизмы, не принадлежащие к исследуемой группе, и будет способствовать росту патогенна). Инкубация в термостате при 37˚С 24ч±4ч Задание № 3 Изучите правила и способы посева микроорганизмов ( запишите) 1.Проводить посев в боксе. 2.На чашках Петри и пробирках перед посевом наносить специальным карандашом название материала и дату посева. 3.Бактериологическую петлю перед взятием материала прокаливать в пламени горелки. 4.Остужать петлю о стенку пробирки или на поверхности агара, свободного от микробного роста. 5.После окончания посева прокаливать петлю. 6.Все манипуляции проводить над пламенем горелки. 7.Края пробирки прожигать перед и после посева. 8.Пробку обжигать перед тем, как закрыть пробирку. 9.Крышку с чашки Петри слегка приоткрывать (не снимать - в целях предупреждения контаминации). 10.После использования пипетки, шпателя, петли, иглы поместить в емкость с дезраствором. Задание № 4 Выполните посев штрихом на плотную питательную среду с целью получения изолированных колоний: (это основные, но не единственные способы посева для аэробных бактерий) а) правой рукой взять бактериальную петлю и простерилизовать ее над пламенем горелки; б) левой рукой, между большим и указательным пальцами держать пробирку с исследуемым материалом; в) легким вращательным движением обхватить ватную пробку мизинцем правой руки, прижимая к ладони и вынуть ее из пробирки; г) край пробирки слегка обжечь; д) стерильной петлей забрать немного материала, содержащего микробы и зигзагообразными движениями нанести на поверхность питательного агара чашки Петри; е) петлю после посева прожечь, пробирку закрыть пробкой. Следите, чтобы посев был выполнен на всю поверхность питательной среды, не нарушая ее целостности.  Метод посева истощающим штрихом (по Голду). В основе метода лежит механическое разобщение микробных клеток путем снижения их концентрации по ходу нанесения исследуемого материала бактериологической петлей штриховыми движениями по поверхности плотной питательной среды и последующим их культивированием с целью получения изолированных колоний. Метод посева истощающим штрихом (по Голду). В основе метода лежит механическое разобщение микробных клеток путем снижения их концентрации по ходу нанесения исследуемого материала бактериологической петлей штриховыми движениями по поверхности плотной питательной среды и последующим их культивированием с целью получения изолированных колоний.Рассмотрите картинки  Сплошной рост – не правильный посев Рост отдельными колониями правильный посев На данной картинке хорошо видно каким способ осуществлен посев:  Задание № 5 Выполните посев на питательную среду шпателем. Метод Дригальского: а) чашку слегка приоткрыть. На поверхность агара нанести стерильной бактериальной петлей каплю исследуемого материала; б) стерильным стеклянным шпателем растереть каплю по всей поверхности, проводя легкие вращающие движения шпателем (крышка на чашке должна быть слегка приоткрыта); в) не прожигая шпателя, посев производится аналогичным образом во 2-ю и затем в 3-ю чашку последовательно. г)Чашки подписываются и инкубируются при t - 37 С. д) по окончании работы шпатель дезинфицировать путем прожигания над пламенем горелки, предварительно обработав спиртом, либо опустив его в дезинфицирующий раствор  Задание № 6 Выполните посев уколом в столбик агара: а) пробирку с агаром держать дном кверху. б) материал, подлежащий посеву берут стерильной иглой, которую отвесно вкалывают в поверхность агара и продвигают по оси пробирки до самого дна; в) иглу извлечь, обжечь над пламенем горелки, пробирку закрыть пробкой и поставить в термостат.  Задание № 7 Разберите способы создания анаэробных условия, используя рис. 3 По способу дыхания микроорганизмы делятся на аэробы и анаэробы. Аэробам необходим для дыхания свободный кислород. Для культивирования анаэробов следует создавать сниженное парциальное давление кислорода в среде. Анаэробные условия можно создать, используя физико-механические, химические и биологические методы. 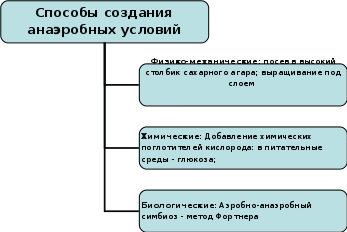 Рис. 3 Среда Кита – Тароцци. Состав: -МПБ; - глюкоза; - кусочки печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течении 10 -15 мин для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение среды и образование пузырьков газа. Этап Изучение изолированных колоний и накопление чистой культуры (на этом этапе выполняются следующие действия): Изучение морфологии колоний По истечении времени инкубации изучают характер роста бактерий на жидких и плотных питательных средах (Например, на плотной питетельной среде Эндо колонии представителей семейства энтеробактерий обычно выпуклые, округлой формы, опалесцирующие, иногда слизистые, Могут быть окрашены в красный цвет с металлическим блеском или без, бесцветные, диаметр, окраска зависят от рода). Задание 8,9 помогает понять данные действия 2-го этапа) Мазок, окраска по Грамму или другими методами для изучения морфологии клеток. Мазок готовят из изолированной колонии. Накопление чистой культуры: посев выполняют, например, на: - скошенный агар (скошенный сыворот. агар- на менингококк), - комбинированные среды (Олькеницкого, Клиглера, Ресселя первичная родовая идентификация сем. энтеробактериевых), - в жидкие питат. среды (солевой бульон –стафилококк; сахарный бульон – стрептококк: МПБ – кишечная группа) Инкубация в термостате при 37˚С 24ч±4ч После инкубации на следующий день, изучают характер роста бактерий на комбинированых средах и жидких питат. средах, т.е. проводится идентификация рода бактерий. (Задания 10,11 помогают понять данные действия 2-го этапа) Задание № 8 Опишите характер роста микробной культуры на плотных питательных средах, используя рисунок 4 и комментарии: Изучение изолированных колоний Величине: крупные (4-5 мм); средние (2-4 мм); малые (1-2 мм); точечные Форме: круглые; правильные; неправильные Цвету: бесцветные; пигментированные (белые, желтые, оранжевые, золотистые и др.) Консистенции: сухие; влажные; слизистые; плотные: мягкие Внутренней структуре: зернистая; гомогенная; неоднородная Поверхность колонии: плоская; выпуклая; гладкая; морщинистая; исчерченная; складчатая; блестящая Край колонии: ровный; волнистый; бахромчатый; фестончатый; зазубренный  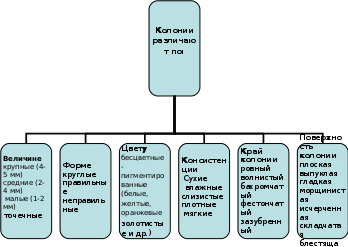 Рис. 4 ТИПЫ КОЛОНИЙ МИКРООРГАНИЗМОВ ФОРМИРУЮЩИЕСЯ НА ПЛОТНЫХ ПИТАТЕЛЬНЫХ СРЕДАХ Рассмотрите картинку  А Б На картинке вы видите рост бактерий семейства энтеробактер на среде Эндо: А – Кишечная палочка, она ферментирует лактозу, которую добавляют в среду Эндо (Дифференциально-диагностическая сред), лактозоположительные штаммы кишечной палочки на среде Эндо образуют темно-красные колонии с металлическим блеском Б. Лактозоотрицательные штаммы эшерихии, сальмонеллы, другие энтеробактерии, не ферментирующие лактозу и образуют на среде Эндо бесцветные или бледно-розовые колонии Задание № 9 Определите характер роста микробных культур на жидких питательных средах и зарисуйте в тетрадь 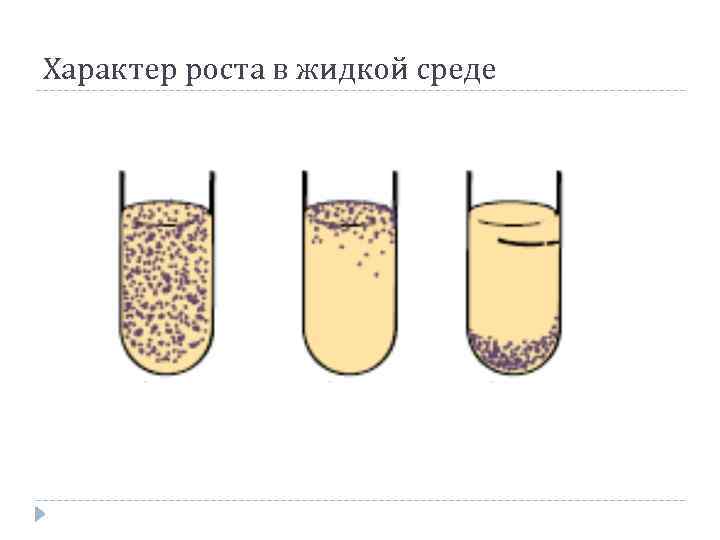 А Б В Задание № 10 Изучите характер роста на комбинированных средах В качестве комбинированной среды используют среду Клиглера, среду Олькеницкого или другую среду. Среда Клиглера позволяет выявлять ферментацию лактозы и глюкозы и образование сероводорода. Исходный цвет среды Клиглера – оранжево-красный. Посев выполняется петлей – штрихами по скошенной части агара и уколом – в столбик агара. Ферментация углеводов проявляется изменением цвета скоса (ферментация лактозы с образованием кислоты, индикатор меняет цвет на желтый), и столбика среды (ферментация глюкозы с образованием кислоты, индикатор меняет цвет на желтый) Образование газообразных продуктов разложения сахаров проявляется характерными разрывами столбика среды и образованием пузырьков. Образование сероводорода приводит к появлению черного преципитата Задание № 11 Опишите характер роста бактерий на среде Клиглера, сделайте вывод рост какого рода бактерий семейства энтеробактер наблюдается на среде Клиглера, используйте таблицу №2  - это среда Клиглера (контроль) ____________________________ ____________________________ ____________________________ Пример оформления: Глюкоза КГ, Лактоз «-», Н2S «-« Вывод – сальмонелла (Этот пример не правильный) 3 этап Изучение чистой культуры (идентификация) (на этом этапе выполняются следующие действия): Микроскопия окрашенных мазков для проверки однородности культуры Посев на среды для изучения биохимических свойств: сахаролитических; протеолитических; ферменты патогенности (Задание 12, 13, 14) Постановка серологических реакций для изучения антигенных свойств (задание 15) Изучение отношения к фагам (задание 16) Задание № 12 Изучите идентификационные тесты, используемые в культуральном методе для определения вида возбудителя Сахаролитические ферменты Под действием сахаролитических ферментов бактерий расщепляют углеводы и высокоатомные спирты до альдегидов и кислоты. Конечными продуктами их расщепления являются газообразные вещества: углекислый газ и водород. Отношение микроорганизмов к различным углеводам специфично и поэтому они используются в бактериологической практике для дифференциации различных видов бактерий. Для обнаружения сахаролитических ферментов исследуемую культуру засевают в питательную среду Гисса, которая также называется «пестрый ряд». Для обнаружения сахаролитических ферментов исследуемую культуру засевают в питательную среду Гисса, которая также называется «пестрый ряд». «Пестрый ряд» представляет собой ряд пробирок с пептонной водой, каким-либо сахаром. «Пестрый ряд» Гисса содержит глюкозу, маннит, лактозу, мальтозу, сахарозу. В отдельных случаях его дополняют дульцитом, сорбитом, ксилитом, арабинозой.. «Пестрый ряд» получил свое название за то, что под действием ферментов растущего микроорганизма, одни углеводы остаются неизменными (отсутствие ферментов) и следовательно, цвет питательной среды не изменяется. В то время как другие сахара расщепляются, образуя кислые продукты распада, которые изменяют цвет индикатора и следовательно цвет питательной среды Среда Гисса бывает жидкой и полужидкой. В пробирку с жидкой средой Гисса для обнаружения газа опускают «поплавок», который представляет собой маленькую трубочку, запаянную с одного конца. При стерилизации питательных сред он заполняется средой. При образовании в среде газообразных продуктов часть питательной среды вытесняется, вследствие чего в запаянной верхушке поплавка образуется воздух - пузырек различной величины. Протеолитические ферменты Протеолитические ферменты бактерий определяется по наличию продуктов деструкции белка. Протеолитическая активность одного и того же микроорганизма культивации на разных средах питательных средах проявляется неодинаково, что обусловлено специфичностью ферментов. Чаще всего для этой цели в качестве белкового субстрата применяют желатин, свернутую лошадиную сыворотку, молоко. Некоторые виды микроорганизмов с выраженной протеолитической активностью обладают способностью расщеплять белок и пептон до продуктов глубокого распада: индола, сероводорода, мочевины, аммиака. При определении видов наибольшее значении имеет выявление индола и сероводорода. Образование H2S и индола в микробной культуре определяют одновременно. Для выявления протеолиза ферментов используемую культуру засевают в питательную среду, содержащую тот или иной белок. Определение индола Определение индола в культуре микроорганизмов по Морелю. Индол определятся из сложной гетероцикличной кислоты тириптофана. Для выявления индолобразующих их культуры микроорганизмов необходимо исследуемую культуру микроорганизмов засевают петлей в МПБ, приготовленный особым способом и содержащий большое количество свободного триптофана. После посева под пробку вставляют индикационную бумажку, пропитанную раствором щавелевой кислоты (следить, чтобы она не упала в питательную среду и не касалась её поверхности) посевы инкубируют в термостате до 48 часов при температуре 48°С. Учет результатов Образование индола сопровождается окрашиванием нижнего конца индикаторной бумаги в слабо розовый цвет. Определение сероводорода Сероводород является конечным продуктом расщепления серосодержащих аминокислот (цистеин, цистин, метионин) для определения H2S исследуемую культуру микроорганизмов засевают в МПБ. После посева под пробку вносятся индикаторная бумага, пропитанная уксуснокислым свинцом. Учет результатов В случае если культура при росте на МПБ выделяет H2S, которая вступает в соединение с уксуснокислым свинцом, в результате чего образуется сернокислый свинец. При этом бесцветная индикаторная бумага на H2S окрашивается в черно-бурый цвет Протеолитические свойства бактерий, рассмотрите картинки:  Задание № 13 Определите род и вид микроорганизма рис 1, 2, используя его биохимические свойства (наличие определенных сахаролитических ферментов). Воспользуйтесь таблицей 2  Рис 1  Рис2 На рисунках редставлено изменения в среде Гиса, характерные для кишечной палочки E.Coli и для сальмонеллы – Salmonella tephi Таблица 2 Основные признаки межродовой дифференциации семейства Enterobacteriaceae (грамотрицательные)
Обозначение К – расщепление определенного углевода до кислоты Г - расщепление определенного углевода с образованием газа Н2S – расщепление углевода с образованием сероводорода Задание № 14 Определение ферментов патогенности 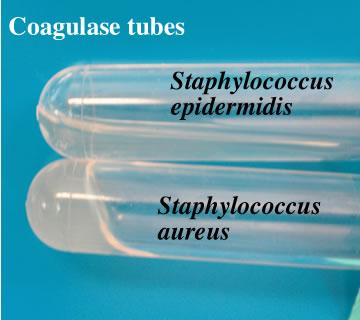 Для идентификации вида S. aureus (вызывает гнойно-воспалительные процессы) и для выяснения принадлежности культуры к видам S. epidermidis или S. Saprophyticus (нормальная микрофлора человека) проводят определение наличия фермента – плазмокоагулазы с помощью которого активируется естественная система свертывания крови. Для этого в пробирку вносят 1 петлю суточной агаровой культуры исследуемого штамма, которую суспендируют в плазме кролика. Появление на дне пробирки студнеобразного сгустка любого размера считается положительным результатом реакции. Задание № 15 Определение антигенов Постановка серологических реакций для изучения антигенных свойств Серодиагностика Сероидентификация:  Задание № 16 Определение чувствительности к бактериофагам     |
