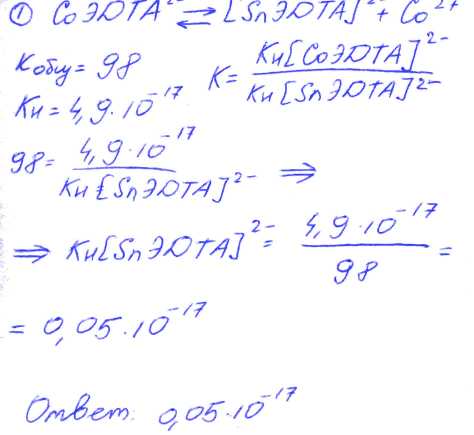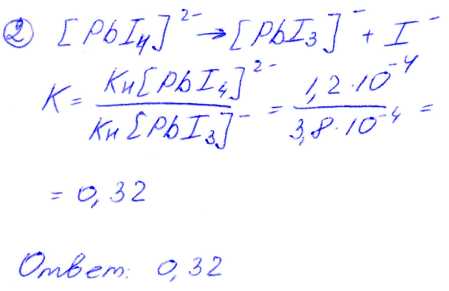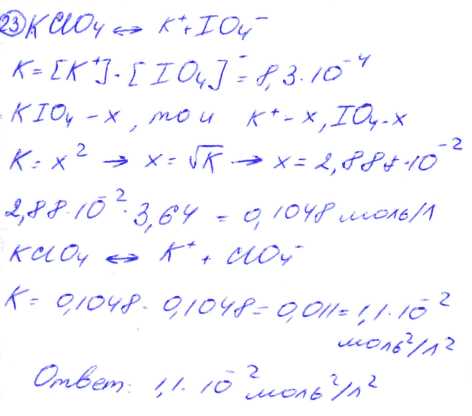№ 01 Константа равновесия замещения Со2+ на Sn2+ в составе комплекса с ЭДТА равна 98. Вычислите константу нестойкости комплекса Sn2+ с ЭДТА, используя справочное значение константы нестойкости комплекса Со2+ с ЭДТА.
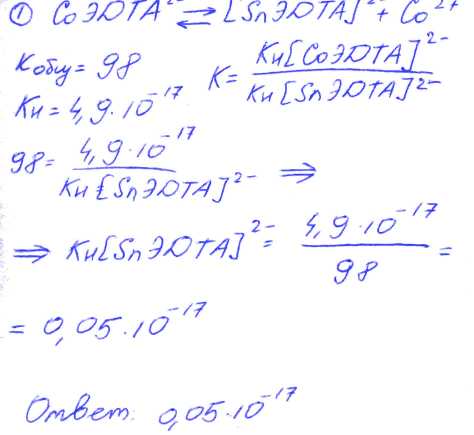
|
№ 02 Константа нестойкости К1-3комплексного иона [РbI3]- равна 3,8*10 -4. Используя справочное значение константы нестойкости К1-4комплексного иона [РbI4]2-, рассчитайте константу равновесия процесса: [РbI4]2-[РbI3]- + I-
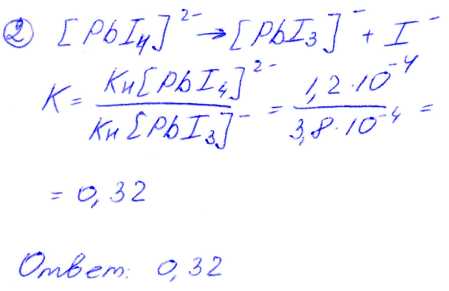
|
№ 03 К какому электроду будут притягиваться частицы белка (pI = 4,0) при электрофорезе в ацетатном буфере, приготовленном из раствора ацетата натрия, объемом 100 мл с концентрацией 0,1 моль/л и раствора уксусной кислоты объёмом 25 мл с концентрацией 0,2 моль/л.

|
|
№ 04 Вычислите ΔG (298 К) для процессов взаимодействия фосфата кальция с уксусной кислотой, при условии, что образуется
а) гидрофосфат кальция
б) дигидрофосфат кальция
Сделайте заключение о практической осуществимости этих процессов.
Ca3(PO4)2 + СН3СООН => СН3СООCa + 2CaHPO4
ΔG = ΔН – ТΔS
ΔН = ΔН(СН3СООCa)+ΔН(CaHPO4) - ΔН(Ca3(PO4)2) + ΔН(СН3СООН)
ΔS = ΔS(СН3СООCa)+ΔS(CaHPO4) - ΔS(Ca3(PO4)2) + ΔS(СН3СООН)
|
№ 05 Смесь карбоната магния и карбоната кальция обработали раствором, в котором концентрации цитратных комплексов магния и кальция составили по 0,1 моль/л. Как изменится состав твердой фазы? Ответ подтвердите расчетом величины ΔG.
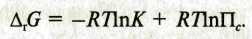
R=8,31 Дж/моль*К
T=298 К
Пс = 0,1 * 0,1 = 0,01 моль/л
K (MgCO3) =
K (CaCO3) =
|
№ 06 Какую массу хлорида натрия можно добавить к раствору нитрата диамминсеребра(I) объемом 2 л с концентрацией 0,5 моль/л, содержащего 0,05 моль/л аммиака, до начала выпадения осадка?

|
|
|
№ 07 Для некоторой реакции в прямом направлении ΔG0 >0. В каком соотношении находятся величины периодов полупревращения прямой и обратной реакции (для прямого и обратного процесса кинетическое уравнение имеете первый порядок)? Дайте пояснения
Период полупревращения реакций первого порядка не зависит от начальной концентрации реагента, период полупревращения реакций нулевого порядка возрастает при увеличении с0, а реакций второго порядка уменьшается. Анализируя зависимость периода полупревращения реакции от начальной концентрации реагента, можно определить порядок реакции.

|
№ 08 Раствор тиоцианата аммония приготовлен растворением 0,76 г в дистелированой воде (объём раствора 500 мл). Образуется ли осадок при смешивании этого раствора с 1%-ым раствором нитрата серебра (пл. 1г/мл) в равном соотношении по объёму?

|
№ 09 Константа равновесия процесса: HOOC–CH = CH – COOH 2Н+ + -ООС–СН2–СОО- равна 3,9 10-8. Показатель константы ионизации гидрофумарат-иона равен 4,38. Вычислите константу ионизации фумаровой кислоты по первой ступени.

|
|
№ 10 Вычислите константы равновесия взаимодействия в водном растворе между следующими веществами:
а) бензойной кислотой и формиатом натрия;
б) ацетата калия и фтороводорода;
в) уксусной кислотой и лактатом калия;
г) уксусной кислотой и фенолятом натрия.
Какие из приведенных реакций не протекают в прямом направлении в стандартном состоянии? Направление каких реакций можно изменить, изменяя концентрации реагирующих веществ?

|
№ 11 Какой из двух ионов: магния или кальция полнее связывается ЭДТА (при одинаковых условиях)? Во сколько раз концентрация одного из ионов будет больше?

|
№ 12 Вычислите массовую концентрацию (в г/мл) ионов платины(II) в растворе, содержащем 0,15 моль тетрабромоялатината(III) натрия и 0,3 моль бромида натрия в растворе, объемом 0,4 л.

|
|
№ 13 К нитрату серебра массой 17 г добавили раствор аммиака с концентрацией 10 моль/л объемом 0,5 л. Полученный раствор разбавили дистиллированной водой до объема 1 л. Вычислите концентрацию ионов серебра; в образовавшемся растворе.

|
№ 14 Во сколько раз уменьшится концентрация ионов железа(III) в растворе, содержащем 0,1 моль/л хлорида железа(III), при добавлении цианида калия (концентрация цианид-ионов в растворе после комплексообразования будет равна 0,5 моль/л)

|
№ 15 Через раствор хлорида цинка с концентрацией 0,15 моль/л и объемом 500 мл пропустили аммиак объемом 11,2 л (условия нормальные). Вычислите, какая часть ионов цинка перешла в состав комплексного соединения. Изменением объема раствора в результате поглощения аммиака пренебречь.

|
|
|
№ 16 Вычислите ΔG (298К) для процессов взаимодействия фосфата кальция с уксусной кислотой , при условии, что образуется:
а) гидрофосфат кальция
б) дигидрофосфат кальция
Ca3(PO4)2 + СН3СООН => СН3СООCa + 2CaHPO4
ΔG = ΔН – ТΔS
ΔН = ΔН(СН3СООCa)+ΔН(CaHPO4) - ΔН(Ca3(PO4)2) + ΔН(СН3СООН)
ΔS = ΔS(СН3СООCa)+ΔS(CaHPO4) - ΔS(Ca3(PO4)2) + ΔS(СН3СООН)
|
№ 17 Может ли уксусная кислота разрушить комплекс [Ag(NH3)2]Cl? Ответ подтвердите расчетом константы равновесий.

|
№ 18 Выпадет ли осадок соли серебра при прибавлении к 1 л раствора нитрата диамминсеребра (I) с концентрацией 0,1 моль/л, содержащему избыток аммиака 1 моль/л:
а) 0,01 ммоль КВr;
б) 0,01 ммоль КI;
Ответ подтвердите расчётами

|
|
|
№ 19 Вычислите ΔG (298К) процесса
MnS + 3CH3COOH H2S + Mn(CH3COO)2 при условии, что Пс равно
а) 0,4
б) 40
Укажите в каждом случае направление процесса.

|
№ 20 При исследовании осмотической стойкости эритроцитов в клинических лабораториях применяют фосфатный буфер, который готовят следующим образом: безводный гидрофосфат натрия массой 27,31 г; дигидрат дигидрофосфата натрия массой 4,86 г и хлорид натрия массой 180 г растворяют в воде, после чего объем раствора доводят до 2 л. Вычислите рН такого буферного раствора.

|
№ 21 Для какой из двух реакций: 3C2H2(г) C2H2(ж); ΔН0 < 0; ΔS0 < 0
FeO(тв) + H2(г) Fe(тв) + H2O(г) ΔН0 > 0; ΔS0 > 0
вероятность самопроизвольного протекания реакции уменьшается при увеличении температуры? Дайте краткие пояснения.

|
|
№ 22 Для проведения исследования были взяты равные массы двух радионуклидов: цезий-137 и цирконий-95. Какая часть циркония-95 останется к тому моменту, когда 2% цезий-137 подвергнется распаду?

|
№ 23 Константа растворимости периодата калия КIO4 равна 8,310-4. Молярная концентрация ионов калия в насыщенном растворе перхлората калин КСIО4 в 3,64 раза больше концентрации ионов калия в насыщенном растворе периодата калия. Вычислите константу растворимости перхлората калия.
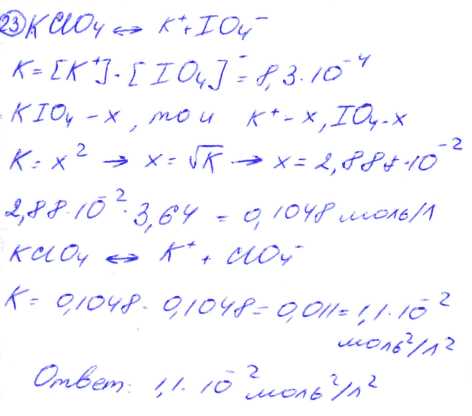
|
№ 24 Объемы насыщенных растворов хлората серебра AgCI03 и хлорита серебра AgCIO3, содержащие одинаковую массу ионов серебра, относятся как 15,9:1. Вычислите отношение констант растворимости этих солей.

|
|
№ 25 Стандартная ЭДС (298 К) гальванического элемента, одним из электродов которого является платина, опущенная в раствор смеси гексацианоферрата(II) калия и гексацианоферрата(III) калия, равна 0,60 В. Вычислите возможные значения стандартного электродного потенциала другого электрода (два случая). Как будет изменяться концентрация гексацианоферрат(III)-иона в ходе работы гальванического элемента в обоих случаях?

|
№ 26 Стандартное значение изменения энергии Гиббса реакции окисления цинка редокс-системой Ме2+/Ме, равно -120 кДж/моль (298 К). Вычислите стандартную ЭДС гальванического элемента, в котором происходит реакция Вr2 + Me МеВr2

|
№ 27 Для реакций 2AgNO3 + Fe(NO3)2 Ag + Fe(NO3)3 изменение энергии Гиббса (298 К) равно 4 кДж/моль. В исходном состоянии концентрации ионов Fe3+ и Ag+ равны по 1*10-2 моль/л. Вычислите исходную концентрацию нитрата железа(II).

|
|
|
№ 28 Изменение энергии Гиббса (298 К) реакции между двумя редокс-парами: и [Fe(CN)6]3-/[Fe(CN)6]4- равно –60 кДж/моль. Вычислите отношение активностей [Mn(CN)6]3-/[Mn(CN)6]4- для исходного состояния, если отношение активностей [Fe(CN)6]3-/[Fe(CN)6]4- в исходном состоянии было равно 10.

|
№ 29 Редокс-потенциал системы НАДФ+/НАДФ-Н при 298 К и рН 7 равен -0,3 В Как надо изменить рН, не изменяя соотношения концентраций окисленной и восстановленной форм, чтобы редокс-потенциал стал равен редокс-потенциалу этой системы?

|
|
|
 Скачать 0.78 Mb.
Скачать 0.78 Mb.