Коллоквиум по химии. Коллоквиум 2!. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Буферные растворы. Понятия. Расчет Ph для буферного раствора. Примеры
 Скачать 154.34 Kb. Скачать 154.34 Kb.
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Буферные растворы. Понятия. Расчет Ph для буферного раствора. Примеры. Буферные растворы – растворы, содержащие смеси слабой кислоты или слабого основания и ее соли, предназначенные для поддержания постоянного значения pH при проведении эксперимента. Уравнения для вычисления pH буферных растворов: Для кислотных буферных растворов: [H+]=Кд*Cкислоты/Cсоли pH=-lg[H+] Для основных буферных растворов: [OH-]=Кд*Соснования/Ссоли pOH=-lg[OH-] pH=14-pOH Примеры: ацетатный буферный раствор – CH3COOH и CH3COONa, аммонийный буферный раствор NH4OHи NH4Cl Скорость химической реакции, ее зависимость от природы и концентрации реагентов, температуры. Порядок и молекулярность реакции. Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора (чем больше катализатора, тем выше скорость химической реакции), температура (правило Вант-Гоффа: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза) и площадь поверхности раздела фаз (скорость химической реакции выше при большей площади поверхности раздела фаз). Порядок реакции по данному веществу — сумма показателей степеней при концентрации, входящей в кинетическое уравнение. Молекулярность элементарной реакции — число частиц участвующих в элементарном акте химического взаимодействия. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции. Сильную зависимость скорости хим. реакции от температуры нельзя объяснить увеличением числа столкновения частиц. Реальная причина в том, что резко возрастает число успешных столкновений частиц, которые приводят к образованию продуктов реакции. Константа скорости и ее зависимость от температуры. Уравнение Аррениуса. Энергия активации. Энергия активации – это минимальная энергия, которая необходима молекулам, чтобы вступить в хим. Взаимодействие. Она необходима для образования активного комплекса. В большинстве случаев, скорость химической реакции увеличивается при повышении температуры. При этом возрастает константа скорости реакции. Зависимость константы скорости реакции от температуры выражается уравнением Аррениуса: где k - константа скорости реакции; A - константа, называемая предэкспоненциальным множителем; е - основание натурального логарифма; Еa - энергия активации, Дж/моль; Т - температура, К; R - газовая постоянная, 8,31 Дж/мольК. Для того чтобы произошла реакция, необходимо преодолеть отталкивание электронных оболочек молекул и разорвать или ослабить связи между атомами. На это надо затратить определенную энергию. Избыточная энергия (по сравнению со средней энергией при данной температуре), которой должны обладать молекулы, для протекания реакции, называется энергией активации. Молекулы, обладающие такой энергией, называются активными молекулами. В ходе реакции вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Именно для его образования необходима энергия активации Переходным состоянием системы (или активированным комплексом) называется состояние системы реагирующих веществ, соответствующее максимальной энергии на пути реакции. Энергия активации – это количество дополнительной энергии, необходимой для перехода системы из исходного состояния в состояние активированного комплекса. 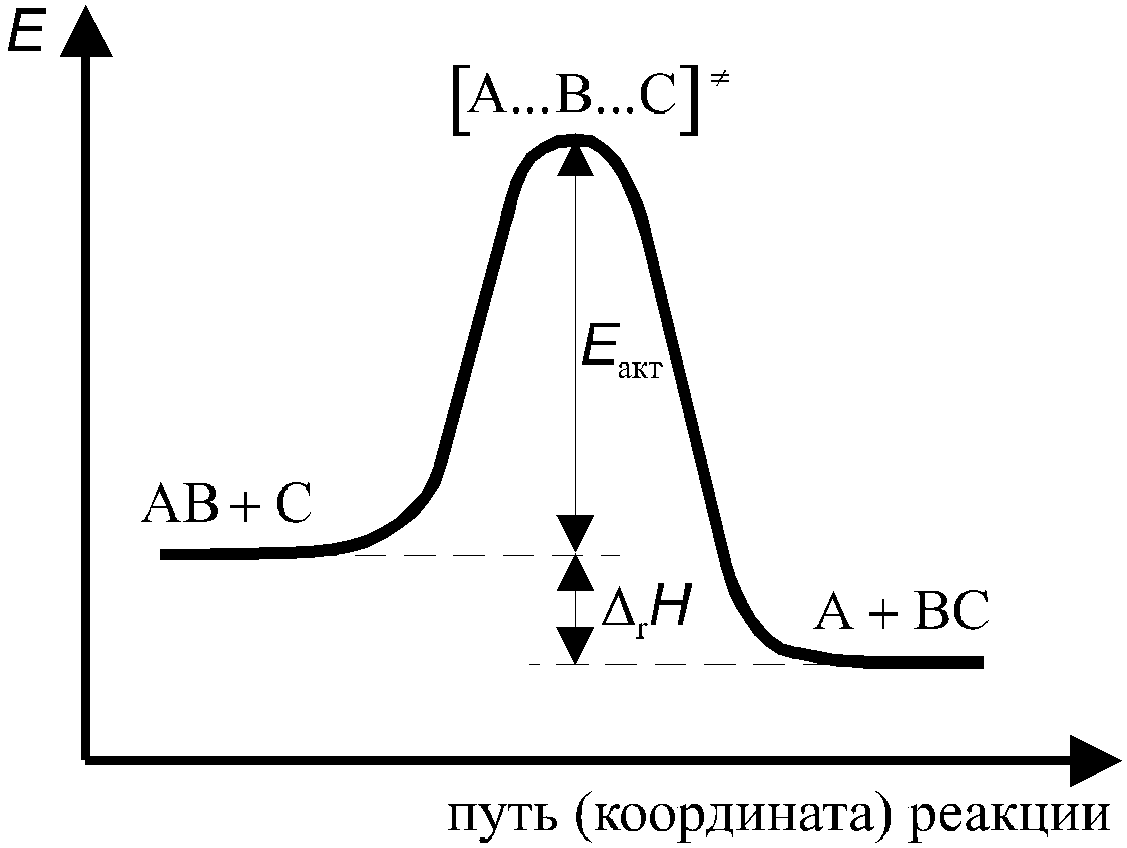 Теория активных соударений. Согласно теории активных столкновений активными принято считать такие столкновения в которых суммарная энергия сталкивающихся возбужденных молекул либо равна либо больше энергии активации. При столкновении молекулы сближаются до определенного состояния которое называется эффективным радиусом столкновения и в этом случае электроны одной молекулы попадают в поле действия электрических сил, возбужденных в другой молекуле. Только при таких столкновениях может произойти разрыв связи в исходных веществах и образование новых связей. Все молекулы запас энергии которых не ниже энергии барьера реакции находятся в особом переходном состоянии которое называется активным комплексом (или активированный). Таким образом система находящаяся в составе активного комплекса характеризуется тем что в ней нет уже исходных веществ но и нет еще продуктов реакции.  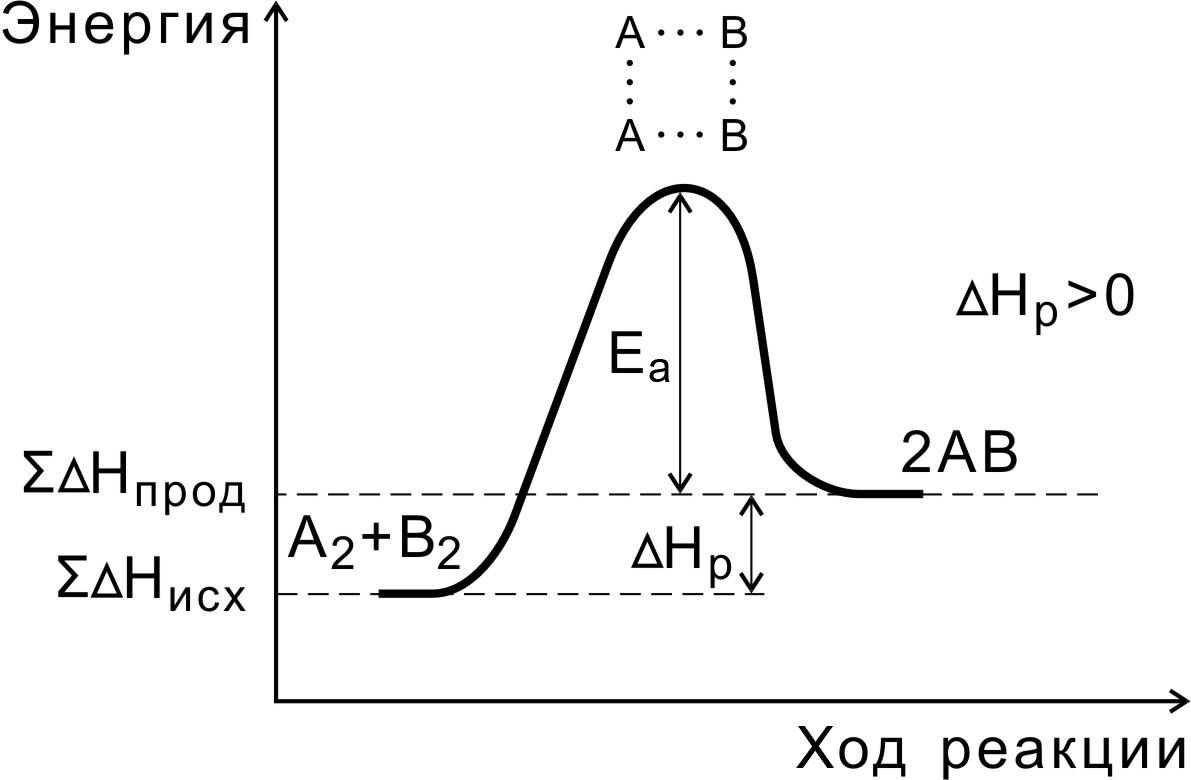 Понятия о механизме реакции в гомогенных и гетерогенных системах. Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы. Гетерогенной — система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела. Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Например, при сливании (и перемешивании) растворов серной кислоты и тиосульфата натрия помутнение, вызываемое появлением серы, наблюдается во всем объеме раствора. Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Например, растворение металла в кислоте может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующих вещества. В связи с этимскорость гомогенной реакции и скорость гетерогенной реакции определяются различно. Скорость гомогенной реакции определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объёма системы. Понятие о катализе. Роль и механизм действия катализатора. Катализ — процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Катализаторы – вещества, принимающие участие в химической реакции, но в состав конечных продуктов не входящие и в результате реакции не расходующиеся. Каталитические реакции — реакции, протекающие в присутствии катализаторов. Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) — при котором она убывает. Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное. Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него. Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемыеактивные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция. 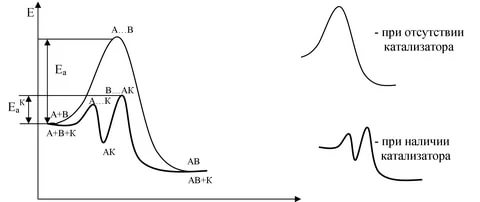 Константа химического равновесия. Закон действующих масс. Факторы, влияющие на величину константы равновесия. Смещение химического равновесия. Принцип Ле-Шателье. Отношение произведения равновесных концентраций продуктов реакции в степенях равных стехиометрическим коэффициентам к произведению равновесных концентраций исходных веществ в степенях равных стех коэф при фиксированной температуре является постоянной величиной. Эта величина называется константой равновесия и для обратимых гипотетически реакций она выражается след образом: аА+бБ=сС=дД Кс=[С]^с*[Д]^д/[А]^а*[Б]^б К0 = асс * адд / ааа*абб где а=c*f Константа равновесия зависит от природы реагирующих веществ и от температуры с которой связана посредственно энергией Гиббса. Дельта G = -RTlnK Большое отрицательное значение дельта джи будет указывать на то что в системе преобладает продукт реакции а большое положительное значение указывает на преобладание исходных веществ а значит реакция идет в обратную сторону. Принцип Ле-Шателье: если находящаяся в состоянии равновесия система подвергается внешнему воздействию равновесие смещается в таком направлении которое способствует ослаблению этого воздействия. Окислительно-восстановительные реакции. Основные понятия. Гальванический элемент, электрическая ячейка. Электродный потенциал. Стандартный электродный потенциал. Стандартный водородный электрод. Уравнение Нернста. Электролиз. ОВР - химические реакции, в которых происходит передача электронов от одних частиц к другим, в результате чего степень окисления некоторых атомов, входящих в состав этих частиц, изменяется. Степень окисления – условный заряд элемента в соединении. Восстановление – процесс, в котором окислитель принимает электрон. Окисление – процесс, в котором восстановитель отдает электрон. ОВР бывают межмолекулярные, внутримолекулярные, диспропорционирования и конпропорционирования. Гальванический элемент – химический источник эл. тока, основанный на взаимодействии двух металлов/оксидов в электролите, приводящий к возникновению замкнутой цепи/электр. тока. Если в элементе Даниэля замкнуть внешнюю цепь, то вольтомметр будет регистрировать перемещение электронов от электрода с меньшим потенциалом к электроду с большим потенциалом (Zn-Cu). В данном случае реакция идет самопроизвольно и такой элемент называется гальваническим. Электролитическая ячейка – сосуд с электролитами, в которые погружены два электрода. Электрохимическое устройство, служащее для проведения электрохимический реакций. Стандартный водородный электрод – электрод, относительно которого можно измерить потенциал всех редокс-пар. Это электрод из платинированной платины (т.е. платины, покрытой электролитическим способом платиновой чернью) и омываемый газообразным водородом. Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. Вывод уравнения Нернста Связь константы равновесия со стандартными потенциалами. Факторы, влияющие на направление окислительно-восстановительных реакций. Факторы, влияющие на направление ОВР: Характер протекания ОВР зависит от химической природы взаимодействующих веществ и от условий проведения реакции: концентрация реагентов, температура, наличие катализатора, характер среды. 1) С серной и азотной кислотой при разной концентрации получаются разные продукты реакции 2) В холодных и горячих щелочах и воде с галогенами получаются разные продукты реакции 3) От наличия катализатора влияют продукты реакции 4) Разные продукты реакции в зависимости от кислой, нейтральной или щелочной среды ОВР является сочетанием двух полуреакций. Для определения направления реакции необходимо найти разность стандартных потенциалов этих полуреакций. Если разность – положительное число, то это указывает на протекание реакции слева-направо. Связь константы равновесия и стандартного потенциала: lgKp=nFE0/RT Основные типы химической связи. Характеристики химической связи в молекулах: энергия, длина, валентный угол, порядок (кратность) и полярность. Различают три типа связи: ковалентную, ионную и металлическую. Количественными характеристиками химической связи являются: 1) Энергия 2) Длина 3) Валентные углы Энергия связи – мера ее прочности, т.е. то количество энергии, которое выделяется при образовании одинарной связи в кДж/моль. Есв примерно = 400. Ее можно теоретически рассчитать с помощью закона Гесса на основании энтальпии реакции при которой образовывается или разрывается изучаемая смесь. Прочность связи также зависит от ее полярности, т.е.степени смещения электрической плотности в области перекрывания орбиталей к одному из атомов, и это смещение будет тем больше, чем больше разность электроотрицательностей элементов, образующих связь. При прочих равных условиях чем больше полярность связи, тем больше ее энергия. Полярность не стоит путать с поляризуемостью, поскольку поляризуемость связи – это ее способность становиться более полярной под действием внешнего электрического поля. Длина – расстояние между ядрами атомов в молекуле. Выражаются в нм. Диапазон [0,074-0,3] нм Ее можно определить с помощью рентгеноструктурного анализа или молекулярной спектроскопии. Чем меньше длина, тем молекула более устойчивая. Валентные углы – углы между линиями двух связей одного и того же атома. Выражаются в градусах. Все данные позволяют определить геометрическую модель к любой молекуле. Для того чтобы предсказать геометрию молекулы для сложных веществ приходится прибегать к различным допущениям и данная проблема решена точно в настоящее время только для молекулы Н2. Метод валентных связей (МВС), сигма, пи-связывание. Представление о гибридизации атомных орбиталей. Геометрия многоатомных молекул: модель Гиллепси. Основные положения МВС: 1) Связь возникает в результате обобществления пары электронов, которое сопровождается перекрыванием электронных облаков 2х взаимодействующих атомов, а значит оно является 2х электронной и 2х центровой. 2) Образование связей происходит либо по обменному, либо по донорно-акцепторному механизму. Обменный механизм связи: В результате перенаправления атомных орбиталей 2х атомов электрон одного атома может проникнуть а орбиталь электрона соседнего атома – это позволяет ему находиться вблизи не только своего ядра, но и соседнего атома. Это приводит к понижению электростатической энергии электрона. Это смещение будет тем больше, чем больше разность электроотрицательности элементов => образуется связь. Сигма-связь возникает при перекрывании орбиталей вдоль оси соединяющей ядро взаимодействующих атомов. Сигма-связь является одинарной (прочной). Пи-связь образуется при перекрывании р-орбиталей в двух областях. Пи-связь является двойной следовательно менее прочная чем сигма. sp-гибридизация образуется когда смешивается одна s-орбиталь и одна p-орбиталь, в результате образуются две полноценные sp-орбитали. Угол между ними составляет 180о sp2-гибридизация образуется когда смешивается одна s-орбиталь и две p-орбитали, в результате происходит образование трех орбиталей, которые расположены на одной плоскости под углом 120о друг к другу. sp3-гибридизация образуется когда смешивается одна s-орбиталь и три p-орбитали в результате происходит образование четырех полноценных sp3-орбиталей. Они образуют тетраэдр и находятся под углом в 109,28о Характерна для CH4 SiH4 SiF4 GeH4 и др. Гибридизация происходит в процессе образования ковалентной связи. Модель Гиллепси (теория отталкивания электронных пар): 1) ЭП стремится к минимуму отталкивания между собой 2) Наибольшее отталкивание между неподеленными парами,, а наименьшее между поделенными 3) Двойные связи занимают больший объем чем одинарные 4) Связывающие электронные пары занимают меньший объем с атомами электроотрицательных элементов, чем электроположительных элементов Теория описывает строение молекул (ионов) атомы которых имеют неподеленные (несвязывающие) электронные пары Связывающей называется такая электронная пара, которая образует связь между двумя атомами. Несвязывающая электронная пара принадлежит только одному атому и не принимает участия в образовании хим. связи, но влияет на форму молекулы (иона). Метод молекулярных орбиталей (ММО). Основные понятия. Энергетические диаграммы. Ионная связь. Ионная связь осуществляется посредством электростатического притяжения. Ионы можно представить в виде электрических зарядов шаровой симметрии, притяжение между которыми будет определяться законом Кулона. Однако любая ионная связь содержит долю ковалентности, причем чем больше разность электроотрицательности ионов, образующих связь, тем выше доля ионности и тем ниже доля ковалентности Основными свойствами ионной связи являются ненаправленность и ненасыщенность. Ненпаравленность заключается в том, что ионы образуют силовое поле, близкое к сферически симметричному, и поэтому силы притяжения не зависят от относительного положения ионов. А ненасыщенность заключается в том, что взаимодействие ионов противоположного знака не приводит к компенсации силовых полей, а поэтому у них остается возможность притягивать ионы противоположного знака и по другим направлениям. Ионные соединения как правило состоят из отдельных молекул только лишь в парообразном состоянии. В твердых, которые называются кристаллическими, они состоят из закономерно расположенных кристаллов, в целом представляя собой гигантскую молекулу, состоящую из ионов. Расплавы таких соединений содержат ионы, а потому являются проводниками. Энергия связи Есв >1000 кДж/моль, а значит связь является очень прочной. Металлическая связь. Металлическая связь возникает между атомами металлов. Характерной особенностью атомов металлов является небольшое число электронов на внешнем энергетическом уровне, слабо удерживаемых ядром, и большое число свободных атомных орбиталей с близкой энергией, поэтому металлическая связь ненасыщенная. Металлическая связь очень устойчива. Металлы имеют особую кристаллическую решётку, в узлах которой находятся как нейтральные, так и положительно заряженные атомы металла, между которыми свободно перемещаются (в пределах кристалла) обобществлённые электроны. В случае металлической связи невозможно говорить о её направленности, так как общие электроны равномерно делокализованы по всему кристаллу. Особенности строения металлов определяют их характерные физические свойства: твёрдость, ковкость, высокую электрическую проводимость и теплопроводность, а также особый металлический блеск. Водородная связь. Силы Ван-дер-Ваальса. Водородная связь является особым видом межмолекулярного, а в некоторых случаях внутримолекулярного взаимодействия. Она возникает между двумя электроотрицательными элементами, которые принадлежат разным молекулам. Она осуществляется посредством атома водорода соединенного с одним из них химической связью. Атом водорода, связанный с сильно электроотрицательным атомом, становится в значительной степени поляризованным, и его состояние приближается к состоянию протона, свойства которого уникальны, потому что он не имеет электрической оболочки, а значит не испытывает отталкивания, а только лишь притяжение. К тому же он очень маленький, а значит может внедряться в электронные оболочки других атомов. По величине энергетической связи водородная находится между Ван-дер-Ваальскими силами и донорно-акцепторным взаимодействием. Ен=20-150 кДж/моль. Поскольку при нагревании водородная связь разрывается, то существует она в основном в конденсированном состоянии, что приводит к ассоциации молекул (вода, фтороводород). Водородная связь играет большую роль в процессах кристаллизации, растворения, а также в биологических процессах, соединениях цепи нуклеиновых кислот. Ван-дер-Ваальские силы имеют электростатическую природу, но относятся к слабым взаимодействиям. Ев-д-в = 8-20 кДж/моль. Суммарная энергия такого воздействия на 1-2 порядка ниже, чем энергия химических связей. Однако такое взаимодействие проявляется на больших расстояниях, чем химическое воздействие, и характеризуется ненаправленностью и ненасыщенностью. Его подразделяют на индукционное, ориентационное и дисперсионное. Существование Ван-дер-Ваальских сил обуславливает существование жидкостей, молекулярных кристаллов, явление адсорбции газов, превращение газов в жидкости и жидкостей в твердые вещества. |
