1 8мин. 15 сек
 Скачать 48.7 Kb. Скачать 48.7 Kb.
|
|
1.При 20С реакция протекает за 2 мин. За сколько времени будет пртекать эта же реакция А) при 0С Б) при 50С? Температурный коффициент реакции равен 2. 1) 8мин. 15 сек. 2) 15 сек. 8 мин 3) 9 мин. 17 сек. 4) 17 сек, 9 мин. 2.Какая из приведённых реакций будет обратимой: 1) AgNO3 + NaCI --- , 2) K2SO4 + BaCI2 --- 3) Na2SO4 + KCI – 4) Fe(NO3)2 + NaOH – http://studopedia.info/4-26465.html 3.К эндотермическим процессам относятся: 1) гашение извести 2) растворение серной кислоты в воде; 3) Разложение известняка 4) горение фосфора. 4. Какие вещества будут реагировать между собой с большей скоростью при равных условиях; 1) Са и Н2SO4 2) H2SO4 и Mg 3) H2SO4 и Fe 4) Ni и H2SO4. 5.Скорость гетерогенной химической реакции при увеличении поверхности реагирующих веществ; 1) не изменяется 2) незначительно изменяется 3) возрастает 4) снижается. 6.Какова средняя скорость химической реакции А + В == 2 С, если начальная концентрация вещества А равна 0,25 моль/л., а через 20 сек. --- 0,10 моль/л. 1) 0,3 моль/л.сек. 2)0,35*10-2 моль/л.сек. 3)7,5*10-3 моль/л.сек. 4)0,15 моль /л.сек. 7. Температурный коэффициент равен 3. Начальная скорость реакции 4 моль /л.сек. Какова будет скорость этой реакции при повышении температуры на 40С: 1) 120 2)480 3)240 4) 324 моль /л.сек 8.Катализаторы изменяют скорость химической реакции в связи с тем, что изменяется 1) температура 2) концентрация веществ 3) число столкновений молекул; 4) увеличивается активность реагентов. 9. В какую сторону сместится равновесие в реакции 2А(т) + В (ж)== 2С(г) + Д (ж) + Q если давление повысить; температуру понизить: 1) влево,.влево 2)влево,вправо 3) вправо,влево 4) вправо, вправо. 11.В каком направлении сместится равновесие прцесса N2 + 3 H2 == 2NH3 + Q при внесении в ситему катализатора: 1) вправо 2) влево 3) не сместится. 12.Для каких из приведённых прцессов уменьшение давления смещает равновесие вправо. 1) FeO + CO == Fe + CO2 2) CO2 + C == 2CO 3) CaCO3 == CaO + CO2 4) N2 + 3H2 == 2NH3. 13.В каком направлении сместится равновесие в реакции 2HBr == H2 + Br2 – Q при увеличении концентрации водорода: 1) вправо; 2) влево 3) не сместится. 14. Какие факторы смещают вправо равновесие процесса 2SO2+O2== 2SO3+Q 1) увеличение концентрации SO2 2) изменение природы катализатора 3) увеличение давления 4) понижение температуры. 15.Повышение температуры и понижение давления одновременно смещают влево равновесие реакций: 1) H2+CI2== 2HCI +Q 2) 2CO+O2== 2CO2+Q 3)N2+O2== 2NO-Q 4)2SO2 + O2 == 2SO3 + Q. 16.Для каких реакций увеличение температуры смещает равновесие влево: 1) N2 + O2 == 2NO – Q 2) 2NH3 == N2 + 3H2 - Q 3) 2H2 + O2 == 2H2O 4)СаО + СО2 == СаСО3 +Q 17.Термохимическое уравнение реакции горения углерода С + О2 – СО2 + 402,24кДж. Какова масса сгоревшего углерода в г. , если при реакции выделяется 167600 кДж. 1)500 2)1000 3)4000 4)5000 18.Теплота образования 1 моль воды из простых веществ равна 242 кДж. Укажите тепловой эффект (кДж) реакции образования 7,2г. воды.. 1)95,4 2)96,8 3)98,6 4) 94,5 19.Как изменится скорость реакции при горении водорода , если концентрации реагентов увеличить в 2 раза 1) увеличится в 4 раза 2) в 6раз 3) в 8 раз 4) в 10 раз. 20.Укажите гомогенную систему: 1)СаСО3 – СаО + СО2; 2) СО2 + С – 2СО; 3)2СО + О2 -- 2СО2; 4) С + О2 ---- СО2. 21. Какая из приведённых реакций явлвется обратимой: 1) 2 NaOH + H2SO4 == Na2SO4 + 2 H2O 2) 2 KmnO4 == K2MnO4 + MnO2 + O2; 3) CuSO4 + 2 KOH == Cu(OH)2 + K2SO4 4) KCI + NaOH == KOH + NaCI. 22. Скорость химической реакции определяется уравнением: 1) v = t / c 2) v = c – t 3)v = c2 – c1 4)v = c/t 23.Какие факторы влияют на скорость химической реакции: 1) природа реагирующих веществ; 2) концентрация реагирующих веществ; 3) температура; 4) присутствие катализатора. 24.Какие два вещества будут реагировать между собой с большей скоростью при равных условиях: 1) Zn и H2SO4 2)H2SO4 и Mg 3)H2SO4 и Fe 4) Pb и H2SO4; 25.За время равное 10 сек, концентрация вещества А изменилась от 3,10 до 3,05 моль/л. Укажите среднее значение скорости реакции по веществу А: 1) 0,003 моль/л.сек 2) 0,005 3) 0,3 моль/л.мин. 4) 8,33*10-5 моль/л.мин. 26.При 60*С скорость реакции равна 2 моль/л.сек. Скорость этой реакции в моль /л.сек. при 20С и температурном коэффициенте, равном 2 составляет: 1) 0,125; 2)0,120 3) 0,040 4) 1. 27.Катализатор --- вещество, которое: 1) увеличивает скорость реакции; 2)изменяет скорость реакции, формально не участвуя в ней; 3)вначале увеличивает скорость химической реакции, затем уменьшает её. 4) Замедляет скорость реакции. 28. Действием каких факторов можно сместить вправо равновесие процесса Н2О + СО2 = Н2СО3 + Q 1) перемешиванием 2) понижением температуры 3)повышением давления 4) увеличением концентрации СО2. 29.Гомогенная реакция с участием газообразных веществ 2А + В == 2С +Q. В какую сторону сместится равновесие, если давление повысить: 1) вправо, влево 2) вправо, вправо. 3) влево, вправо. 4) влево, влево. 30.Как влияют катализаторы на смещение химического равновесия; 1) влияют, но слабо 2) увеличивают выход продукта 3) не влияют 4) катализаторы смещают равновесие вправо, а ингибиторы --- влево. 31.Для какой из приведённых реакций увеличение концентрации водорода смещает равновесие влево: 1) N2 + 3H2 == 2NH3 ; 2) 2NH3 == N2 + 3H2; 3) 2H2 + O2 ==== 2 H2O; 4) FeO + H2 == Fe + H2O; 32.Как повлияет на состояние равновесия реакции SO2 + ½ O2 == SO2 + 99кДж. Понижение температуры: 1) равновесие не сместится; 2) равновесие сместится вправо; 3) равновесие сместится влево 33.Изменение давления не смещает равновесие процессов: 1) Н2 + S == H2S; 2) N2 + O2 == 2NO ; 3) H2 + I2 == 2 HI; 4) H2 + CI2 == 2HCI. 34.Учитывая термохимическое уравнение С (т) + О2 (г) – СО2 (г) + 412 кДж, определите , какая масса угля сожжена, если выделилось 206 кДж теплоты: 1) 12г. 2) 12кг. 3) 6г. 4) 12000мг. 35. Растворение цинка в соляной кислоте будет замедлятся при: 1) увеличении концентрации кислоты 2) раздроблении цинка; 3) повышении температуры 4) разбовлении кислоты. 36. Кусочки угля в банке с кислородом горят значительно быстрее . чем в банке с воздухом так как: 1) быстрота горения угля зависит от природы реагирующих веществ; 2) концентрация кислорода была большой; 3) кислород поддерживает горение; 4) кислород тяжелее воздуха. 37.Во сколько раз увеличится скорость реакции при повышении температуры от 300 до 350*С , если температурный коэффициент реакции равен 3? 1) 243 2) 343 3) 143. 38. Укажите математическое выражение закона действия масс для реакции 4NH3(г)+3О2(г)=2N2(г)+6Н2О(ж) 1) V= к C4NH3*C3O2; 2) V= к CNH3* CO2; 3) V= к CNH3* CO2*CN2*CH2O; 4) нет ответа; 5) V= к C4NH3* C3O2*C2N2*C6H2O? 39. 1) V= к С3Fe; 2) V= к СН2О; 3) V= к С4Н2О; 4) V= к С3Fe* С4Н2О; 5)V= к СFe* СН2О? 40. Укажите математическое выражение закона действия масс для реакции Ва(к)+2HCl(р) = BaCl2(р)+H2(г) 1) V= к CBa*C2HCl; 2) V= к CBa*CHCl; 3) V= к CBa*C2HCl*CBaCl2*CH2; 4) нет ответа; 5) V= к C2HCl? 41. Укажите математическое выражение скорости прямой реакции 1) V= к CMgCO3; 2) нет ответа; 3) V=к; 4) V=к CMgO*CCO2; 5) V=к CCO2 ? 42. В растворе проходит реакция по уравнению KCl(р)+HClO(р)=Cl2(г)+KOH(р) Во сколько раз изменится скорость реакции при разбавлении реагирующей смеси в 6 раз 1) Уменьшится в 6 раз; 2) уменьшится в 12 раз; 3)увеличится в 12 раз; 4) уменьшится в 36 раз; 5) не изменится 43. Во сколько раз возрастет скорость реакции 2NO(г)+Cl2(г)=2NOCl(г) при увеличении давления в системе в 3 раза 1) В 27 раз; 2) в 9 раз; 3) в 6 раз; 4) в 2 раза; 5) в 18 раз 44. Во сколько раз следует изменить (увеличить или уменьшить) давление, чтобы скорость образования NO2 по реакции 2NO(г)+O2(г)=2NO2(г) возросла в 1000 раз 1) Уменьшить в 100 раз; 2) увеличить в 1000 раз; 3) увеличить в 10 раз; 4) увеличить в 100 раз; 5) уменьшить в 10 раз? 45. 1) в 2 раза; 2) в 4 раза; 3) в 3/2 раза; 4) в 0,5 раза; 5) в 2/3 раза? 46. Во сколько раз увеличится скорость реакции при повышении температуры от 400 до 700 С Температурный коэффициент равен 3 1) В 9 раз; 2) в 3 раза; 3) в 27 раз; 4) в 90 раз; 5) в 30 раз? 47. На сколько градусов необходимо понизить температуру, чтобы скорость реакции уменьшилась в 27 раз, если температурный коэффициент равен 3 1) на 90С; 2) на 300С; 3) на 810С; 4) на 30С; 5) на 270С? 48. При повышении температуры на каждые 100С скорость некоторой химической реакции увеличивается в 4 раза. При какой температуре следует проводить реакцию, чтобы скорость реакции, идущей при 1000С, уменьшилась в 16 раз 1) при 200С; 2) при 400С; 3) при 800С; 4) при 1160С; 5) при 640С? 49. Кинетическое уравнение реакции CaO(к)+CO2(г)=CaCO3(к) имеет вид V=кССО2. Определите общий порядок реакции 1) первый; 2) второй; 3) третий; 4) нулевой; 5) дробный 50. Определите порядок реакции С6Н6(г)+Br2(ж)=C6H5Br(ж)+HBr(г) 1) дробный; 2) нулевой; 3) третий; 4) второй; 5) первый 51. При какой концентрации воды гидролитическое разложение сахара с образованием глюкозы и фруктозы С12Н22О11(р)+Н2О(р)=С6Н12О6(р)+С6Н12О6(р) является реакцией второго порядка 1) высокой; 2) средней; 3) низкой; 4) любой; 5) нет ответа 52. Общий порядок реакции Н2(г)+I2(г)=2HI(г) равен 2. Чему равны частные порядки реакции по водороду и иоду 1) Нулевой порядок по водороду и первый по иоду; 2) Первый порядок по водороду и второй по иоду; 3) Нулевой порядок по водороду и иоду; 4) Второй порядок по водороду и иоду; 5) Первый порядок по водороду и иоду 53. Укажите выражение константы равновесия реакции 1) Кс=  ; ; 2) Кс= 3) Кс= 4) Кс= 5) Кс= 54. Укажите выражение константы равновесия реакции 1) Кс= СCl2; 2) Кс= 3) Кс= 4) Кс= 5) Кс= 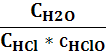 55. 1) 0,17; 2) 5,79; 3) 6,36; 4) 0,16; 5) 5,4 56. 1) нет ответа; 2) СН2=CI2=0.61, CHI=0,78; 3) CH2=CI2=0.22, CHI=1.56; 4) СH2=CI2=0.00, CHI=2.0; 5) CH2=CI2=0.5, CHI=1,0 57. Исходные концентрации оксида углерода и паров соответственно равны 0,08 моль/л. Вычислите равновесные концентрации СО, Н2О, Н2 в системе СО+Н2О СО2+Н2, если равновесная концентрация СО2 оказалась равной 0,05 моль/л. Рассчитайте константу равновесия реакции. 1) 2) ССО=СН2О=0,03, СН2=0,05, Кс=0,36; 3) ССО=СН2О=0,13, СН2=0,05, Кс=1,47; 4) Нет ответа; 5) ССО=СН2О=0,13, СН2=0,05, Кс=6,76 58. 1) Введением катализатора; 2) понижением температуры 3) понижением давления; 4) увеличением концентрации СО2 или Н2; 5) увеличением объема реакционного сосуда 59. Каким путем можно повысит выход СО2 в следующей реакции: 1) Повысить давление; 2) понизить давление; 3) увеличить концентрацию CaO; 4) уменьшить концентрацию СаСО3; 5) нет ответа 60. В каких из нижеприведенных обратимых реакций изменение давления не вызовет нарушения равновесия 1) 2) СО(г)+Н2О(г) СО2+Н2(г); 3)СОСl2(г) СО(г)+Cl2(г); 4) MgCO3(к) MgO(к)+СО2(г); 5) 2NO(г)+O2(г) 2NO2(г) 61. 1) увеличить температуру и давление; 2) уменьшить температуру и давление; 3) уменьшить температуру, увеличить давление; 4) увеличить температуру, уменьшить давление; 5) температуру не изменять, давление увеличить. |
