Реферат Хром. ХРОМ. 1. Электронная структура атома хрома Физические и химические свойства
 Скачать 29.65 Kb. Скачать 29.65 Kb.
|
|
ХРОМ ПЛАН 1. Электронная структура атома хрома 2. Физические и химические свойства 2.1. Физические свойства 2.2. Химические свойства 2.2.1. Взаимодействие с неметаллами и водой 2.2.2. Взаимодействие с кислотами 2.2.3. Взаимодействие со щелочами 2.2.4. Восстановление металлов из оксидов и солей 3. История открытия 4. Содержание в земной коре 5. Особенности технологии получения хрома из полезных ископаемых 6. Практическое применение 1. Электронная структура атома хрома Хром расположен в четвертом периоде VI группе побочной (В) подгруппе периодической системы элементов Д.И. Менделеева. Относится к элементам d-семейства. Металл. Обозначение – Cr. Порядковый номер – 24. Относительная атомная масса – 51,996 а.е.м. Атом хрома состоит из положительно заряженного ядра (+24), внутри которого находятся 24 протона и 28 нейтронов, а вокруг ядра на четырех электронных уровнях движутся 24 электрона. Атомный радиус составляет 166 пм. Распределение электронов по орбиталям выглядит следующим образом: +24Сr)2)8)13)1 1s22s22p63s23p63d54s1 Для атома хрома характерен так называемый «провал» электрона – явление, при котором один s-электрон с внешнего энергетического уровня переходит на d-орбиталь предвнешнего уровня. Это связано с тем, что наполовину заполненный d-подуровень обеспечивает атому наибольшую энергетическую устойчивость. Таким образом, энергетическая диаграмма валентных электронов атома в основном состоянии имеет следующий вид: 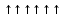 4s 3d Все шесть валентных электронов атома хрома неспаренные, поэтому для атома хрома не характерно возбужденное состояние атома. В соединениях хром может проявлять степени окисления от –4 до +6. Наиболее характерные степени окисления: +2, +3 и +6. Валентность:II, IV, VI. 2. Физические и химические свойства 2.1. Физические свойства Хром – серовато-белый блестящий металл по внешнему виду похож на сталь. Из металлов он самый твердый, его плотность 7,19 г/см3 , т. пл. 1855 °С. Природный хром состоит из смеси пяти изотопов смассовыми числами 50, 52, 53, 54 и 56. Радиоактивные изотопы получены искусственно. Хром обладает всеми характерными свойствами металлов – хорошо проводит тепло, почти не оказывает сопротивления электрическому току, имеет присущий большинству металлов блеск. Любопытна одна особенность хрома: при температуре около 37°С многие его физические свойства резко, скачкообразно меняются. В этой температурной точке внутреннее трение хрома достигает максимума, а модуль упругости падает до минимальных значений. Так же внезапно изменяются электропроводность, коэффициент линейного расширения, термоэлектродвижущая сила. Ниже температуры 37 °C является антиферромагнетиком, выше переходит в парамагнитное состояние. Пока ученые не могут объяснить эту аномалию. Чистый хром пластичен, однако даже незначительные примеси кислорода, азота и углерода делают его хрупким. Такой металл при ударе молотком легко раскалывается. Значительное влияние даже ничтожного количества примесей на физические свойства характерно и для большинства других переходных металлов. Хром имеет твердость по шкале Мооса = 9; это один из самых твердых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). 2.2. Химические свойства Хром при обычных условиях – инертный металл, при нагревании становится довольно активным. 2.2.1 Взаимодействие с неметаллами и водой. При нагревании выше 600°С хром сгорает в кислороде: 4Cr + 3O2 = 2Cr2O3. С фтором реагирует при 350°С, с хлором – при 300°С, с бромом – при температуре красного каления, образуя галогениды хрома (III): 2Cr + 3Cl2 = 2CrCl3. С азотом реагирует при температуре выше 1000°С с образованием нитридов: 2Cr + N2 = 2CrN или 4Cr + N2 = 2Cr2N. Сера при температуре выше 300°С образует с хромом сульфиды от CrS до Cr5S8, например: 2Cr + 3S = Cr2S3. Реагирует с бором, углеродом и кремнием с образованием боридов, карбидов и силицидов: Cr + 2B = CrB2 (возможно образование Cr2B, CrB, Cr3B4, CrB4), 2Cr + 3C = Cr2C3 (возможно образование Cr23C6, Cr7B3), Cr + 2Si = CrSi2 (возможно образование Cr3Si, Cr5Si3, CrSi). С водородом непосредственно не взаимодействует. В тонкоизмельченном раскаленном состоянии хром реагирует с водой, образуя оксид хрома (III) и водород: 2Cr + 3H2O = Cr2O3 + 3H2 2.2.2. Взаимодействие с кислотами В электрохимическом ряду напряжений металлов хром находится до водорода, он вытесняет водород из растворов неокисляющих кислот: Cr + 2HCl = CrCl2 + H2; Cr + H2SO4 = CrSO4 + H2. В присутствии кислорода воздуха образуются соли хрома (III): 4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O. Концентрированная азотная и серная кислоты пассивируют хром. Хром может растворяться в них лишь при сильном нагревании, образуются соли хрома (III) и продукты восстановления кислоты: 2Cr + 6H2SO4 = Cr2(SO4)3 + 3SO2 + 6H2O; Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3H2O. 2.2.3. Взаимодействие со щелочами В водных растворах щелочей хром не растворяется, медленно реагирует с расплавами щелочей с образованием хромитов и выделением водорода: 2Cr + 6KOH = 2KCrO2 + 2K2O + 3H2. Реагирует с щелочными расплавами окислителей, например хлоратом калия, при этом хром переходит в хромат калия: Cr + KClO3 + 2KOH = K2CrO4 + KCl + H2O. 2.2.4. Восстановление металлов из оксидов и солей. Хром – активный металл, способен вытеснять металлы из растворов их солей и при нагревании – из оксидов менее активных металлов: 2Cr + 3CuCl2 = 2CrCl3 + 3Cu 2Cr + 3CuO = 3Cu + Cr2O3 3. История открытия Открытие хрома относится к периоду бурного развития химико- аналитических исследований солей и минералов. В России химики проявляли особый интерес к анализу минералов, найденных в Сибири и почти неизвестных в Западной Европе. Одним из таких минералов была так называемая сибирская красная свинцовая руда (крокоит), описанная еще Ломоносовым и впервые химически исследованная И.Г.Леманом в Петербурге в 1766 г. П. С. Паллас, описывая золотые прииски близ Екатеринбурга, упоминает о крокоите, как об особо интересном минерале. Позднее этот минерал многократно изучался русскими учеными - И. Д. Биндгеймом, Т. Е. Ловицем, А.А.Мусиным-Пушкиным и др. В конце XVIII в. образцы крокоита попали в минералогические коллекции Западной Европы. Вокелен и Маккварт анализировали его, но не нашли в нем ничего, кроме оксидов свинца, железа и алюминия. В 1797 г. Вокелен вернулся к исследованиям минерала, чудесный красный цвет, прозрачность и кристаллическая структура которого побуждали химиков интересоваться его природой. Сначала он предполагал наличие в минерале молибдена, но затем убедился в ошибочности этого предположения. Прокипятив тонко измельченный образец минерала с поташем и осадив карбонат свинца, Вокелен получил раствор, окрашенный в оранжево-желтый цвет. Из этого раствора он выкристаллизовал рубиново-красную соль, из которой выделил окисел и свободный металл, отличный от всех известных металлов. Вокелен назвал его хромом (Chrome) от греческого - окраска, цвет; правда, здесь имелось в виду свойство не металла, обладавшего серебристо-белым цветом, а его ярко окрашенных солей. Почти одновременно с Вокеленом хром открыл Клапрот. Обрабатывая размолотый в порошок крокоит соляной кислотой, Клапрот получил хромокислый свинец, из которого отделил хлорид свинца. Оставшийся раствор он обработал содой, в результате чего получилась зеленоватая гидроокись хрома. По традиции, идущей еще от алхимиков, признававших лишь семь металлов, каждый вновь открываемый металл получал очередной номер. Клапрот считал хром 21-м вновь открытым металлом. В России в XIX в. его именовали еще и хромием. 4. Содержание в земной коре Хром встречается в виде соединений в различных минералах. Наиболее распространен минерал хромит, или хромистый железняк FeCr2О4 , богатые месторождения которого имеются на Урале и в Казахстане. Массовая доля хрома в земной коре составляет 0,03%. Хром обнаружен на Солнце, звездах и в метеоритах. Хромиты окрашены в темный или почти черный цвет, имеют металлический блеск и обычно залегают в виде сплошных массивов. Месторождения хромита имеют магматическое происхождение. Его выявленные ресурсы оценены в 47 странах мира и составляют 15 миллиардов тонн. Первое место по запасам хромита занимает ЮАР (76% от разведанных мировых запасов), где наибольшее значение имеет группа Бушвельдских месторождений, содержание хромовой руды в которых составляет 1 миллиард тонн. Второе место в мире по ресурсам хромита занимает Казахстан (9% от мировых запасов), хромовые руды там очень высокого качества. Все ресурсы хромита в Казахстане сосредоточены в Актюбинской области (Кемпирсайский массив с запасами 300 млн. тонн); месторождения разрабатываются с конца 1930-х. Третье место занимает Зимбабве (6% от мировых запасов). Кроме того, значительными ресурсами хромита обладают США, Индия, Филиппины, Турция, Мадагаскар, Бразилия. В России довольно крупные залежи хромита встречаются на Урале (Сарановское, Верблюжьегорское, Алапаевское, Монетная дача, Халиловское и другие месторождения). Хром, вероятно, более характерен для мантии Земли, так как ультраосновные породы, которые, как полагают, ближе всего по составу к мантии Земли, обогащены хромом (2·10-4%). Хром образует массивные и вкрапленные руды в ультраосновных горных породах; с ними связано образование крупнейших месторождений хрома. В основных породах содержание хрома достигает лишь 2·10-2%, в кислых - 2,5·10-3%, в осадочных породах (песчаниках) - 3,5·10-3%, глинистых сланцах - 9·10-3% . Хром - сравнительно слабый водный мигрант; содержание хрома в морской воде 0,00005 мг/л. В целом хром – металл глубинных зон Земли; каменные метеориты (аналоги мантии) тоже обогащены хромом (2,7·10-1%). Известно свыше 20 минералов хрома. Промышленное значение имеют только хромшпинелиды (до 54% Сr); кроме того, хром содержится в ряде других минералов, которые нередко сопровождают хромовые руды, но сами не представляют практической ценности (уваровит, волконскоит, кемерит, фуксит). 5. Особенности технологии получения хрома из полезных ископаемых В промышленности получают чистый хром и сплав его с железом – феррохром. Феррохром получают при восстановлении хромистого железняка углем. Чистый хром получают восстановлением оксида хрома методом алюминотермии: Cr2O3 + 2Al = 2Cr + Al2O3 Получение чистого хрома – дорогой и трудоемкий процесс. Поэтому для легирования стали применяют главным образом феррохром, который получают в дуговых электропечах непосредственно из хромита. Восстановителем служит кокс. Содержание оксида хрома в хромите должно быть не ниже 48%, а отношение Cr: Fe не менее 3: 1. Полученный в электропечи феррохром обычно содержит до 80% хрома и 4.-7% углерода (остальное – железо). В промышленных масштабах чистый металлический хром производят электролитическим и алюмотермическим способами. Метод алюминотермии был открыт еще в 1865 г. известным русским химиком Н.Н. Бекетовым. Сущность метода – в восстановлении окислов алюминием, реакция сопровождается значительным выделением тепла. Предварительно необходимо получить чистый оксид хрома Сr2О3. Для этого тонко измельченный хромит смешивают с содой и добавляют к этой смеси известняк или оксид железа. Вся масса обжигается, причем образуется хромат натрия: 2Сr2О3 + 4Na2CO3 + 3О2 → 4Na2CrO4 + 4CO2. Затем хромат натрия выщелачивают из обожженной массы водой; щелок фильтруют, упаривают и обрабатывают кислотой. В результате получается бихромат натрия Na2Cr2O7. Восстанавливая его серой или углеродом при нагревании, получают зеленый оксид хрома Cr2O3 . Металлический хром можно получить, если чистый оксид хрома смешать с порошком алюминия, нагреть эту смесь до 500-600°C и поджечь. Эта реакция– основа промышленного (алюминотермического) способа получения хрома, хотя, конечно, заводская технология значительно сложнее. Хром, полученный алюминотермически, содержит алюминия и железа десятые доли процента, а кремния, углерода и серы – сотые доли процента. Несколько ниже содержание этих примесей в алюмотермическом хроме двойной дегазации. Электролитический хром высокой чистоты (98-99%) производят электролизом путем осаждения на катодах из растворов соединений трех- или шестивалентного хрома. Технически чистый и электролитический хром идет главным образом на производство сложных хромовых сплавов. 6. Практическое применение Сегодня общий объем потребления чистого хрома (не менее 99% Cr) составляет около 15 тысяч тонн, из них около трети приходится на электролитический хром. Мировым лидером в производстве высокочистого хрома является английская фирма Bell Metals. Первое место по объемам потребления занимают США (50%), второе – страны Европы (25%), третье – Япония. Рынок металлического хрома довольно нестабилен, и цены на металл колеблются в широком диапазоне. Хром применяется для получения различных сортов специальных сталей в изготовлении стволов огнестрельных орудий (от ружейных до пушечных), броневых плит, несгораемых шкафов и т. д. Стали, содержащие более 13 % хрома, почти не ржавеют и применяются для изготовления подводных частей кораблей, в частности, для постройки корпусов подводных лодок. Хром широко применяется для хромирования изделий. Хромирование осуществляется электролитическим путем. Несмотря на то, что толщина наносимых пленок часто не превышает 0,005 мм, хромированные изделия становятся устойчивыми к внешним воздействиям (влаге, воздуху) и не ржавеют. Из соединений хрома изготавливаются хромистые кирпичи - хромомагнезиты, применяемые в рабочем пространстве металлургических печей и в других металлургических устройствах и сооружениях. Использование хрома основано на его жаропрочности, твердости и устойчивости против коррозии. Больше всего хрома применяют для выплавки хромистых сталей. Алюмино- и силикотермический хром используют для выплавки нихрома, нимоника, других никелевых сплавов и стеллита. Значительное количество хрома идет на декоративные коррозионно-стойкие покрытия. Широкое применение получил порошковый хром в производстве металлокерамических изделий и материалов для сварочных электродов. Хром в виде иона Cr3+ - примесь в рубине, который используется как драгоценный камень и лазерный материал. Соединениями хрома протравливают ткани при крашении. Некоторые соли хрома используются как составная часть дубильных растворов в кожевенной промышленности; PbCrO4, ZnCrO4, SrCrO4 – как художественные краски. Из смеси хромита и магнезита изготовляют хромомагнезитовые огнеупорные изделия. Список использованной литературы 1. Лахтин Ю.М., Леонтьева В.Н. Материаловедение. Учебник для ВУЗов технич. спец. - 3-е изд. - М. Машиностроение, 2010. - 528с. 2. Лисицын А.Е., Остапенко П.Е. Минеральное сырье. Хром // Справочник. М:ЗАО Геоинформмарк, 1999. 25 с. 3. Салли А., Брендз Э. Хром. Изд. 2-е переработ. и доп. Перев. с англ. М.: Металлургия, 1971. 360 с. 4. Популярная библиотека химических элементов http://n-t.ru/ri/ps/pb082.htm |
