Тема 18. Аминокислоты и белки. 1. Методы получения
 Скачать 262.15 Kb. Скачать 262.15 Kb.
|
|
Аминокислоты – гетерофункциональные соединения, содержащие карбоксильную и аминогруппы. По взаимному расположению функциональных групп различают a -,b -, g - и т.д. аминокислоты. Аминокислоты, содержащие аминогруппу на конце цепи, называют w -аминокислотами. 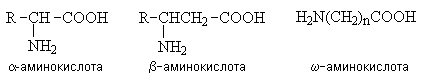 1. Методы получения !) Аммонолиз галогензамещенных кислот. 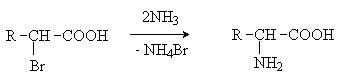 Метод используется для синтеза a -аминокислот из доступных a -галогензамещенных кислот. 2) Метод Штеккера- Зелинского Включает стадии образования аминонитрила при взаимодействии альдегида с HCN и NH3 c последующим гидролизом его в аминокислоту. В качестве реагента применяют смесь NaCN и NH4Cl. 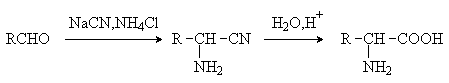 Метод применим для синтеза только a -аминокислот. 3) Алкилирование N-фталимидмалонового эфира 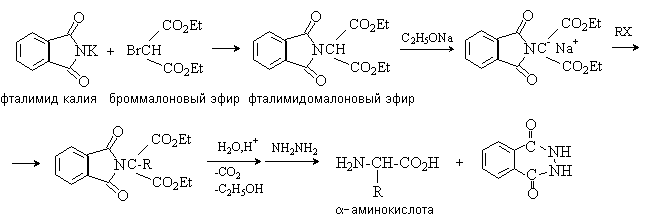 4) Присоединение аммиака к a ,b -непредельным карбоновым кислотам. 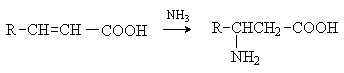 Метод применим для синтеза b -аминокислот. 5) Из оксимов циклических кетонов перегруппировкой Бекмана. 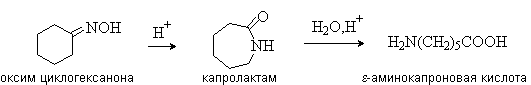 Метод используется для синтеза w -аминокислот. 2. Химические свойства Аминокислоты дают реакции, характерные для карбоксильной и аминогрупп, и, кроме того, проявляют специфические свойства, которые определяются наличием двух функциональных групп и их взаимным расположением. 2.1. Кислотно-основные свойства Аминокислоты содержат кислотный и основный центры и являются амфотерными соединениями. В кристаллическом состоянии они существуют в виде внутренних солей (биполярных ионов), которые образуются в результате внутримолекулярного переноса протона от более слабого основного центра (СОО-) к более сильному основному центру (NH2). 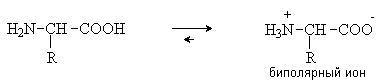 Ионное строение аминокислот подтверждается их физическими свойствами. Аминокислоты – нелетучие кристаллические вещества с высокими температурами плавления. Они нерастворимы в неполярных органических растворителях и растворимы в воде. Их молекулы обладают большими дипольными моментами. Форма существования аминокислот в водных растворах зависит от рН. В кислых растворах аминокислоты присоединяют протон и существуют преимущественно в виде катионов. В щелочной среде биполярный ион отдает протон и превращается в анион. 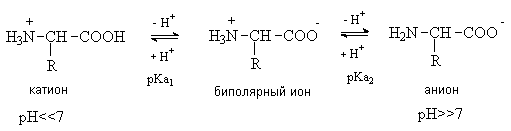 При некотором значении рН, строго определенном для каждой аминокислоты, она существует преимущественно в виде биполярного иона. Это значение рН называют изоэлектрической точкой (рI). В изоэлектрической точке аминокислота не имеет заряда и обладает наименьшей растворимостью в воде. Катионная форма аминокислоты содержит два кислотных центра (COOH и NH3+) и характеризуется двумя константами диссоциации рКа1 и рКа2. Значение рI определяется по уравнению: 2.2. Реакции по аминогруппе Дезаминирование Аминокислоты содержат первичную аминогруппу и подобно первичным аминам взаимодействуют с азотистой кислотой с выделением азота. При этом происходит замещение аминогруппы на гидроксильную. RCH(NH2)COOH + HNO2 ® RCH(OH)COOH + N2 + H2O Реакция используется для количественного определения аминокислот по объему выделившегося азота (метод Ван-Слайка). Алкилирование и арилирование При взаимодействии аминокислот с избытком алкилгалогенида происходит исчерпывающее алкилирование аминогруппы и образуются внутренние соли. 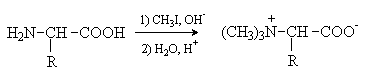 Аминокислоты арилируются 2,4-динитрофторбензолом (ДНФБ) в щелочной среде. Реакция протекает как нуклеофильное замещение в активированном ароматическом кольце. 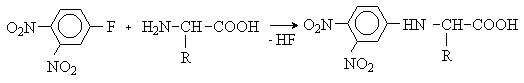 Реакция используется для установления аминокислотной последовательности в пептидах. Ацилирование Аминокислоты взаимодействуют с ангидридами и хлорангидридами с образованием N-ацильных производных. 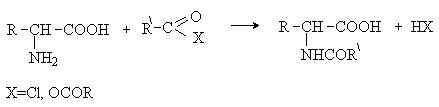 Реакция используется для защиты аминогруппы в синтезе пептидов. Такая защита должна легко сниматься, а амиды, как известно, гидролизуются в жестких условиях. При разработке методов синтеза пептидов были найдены защитные группы, которые легко удаляются путем гидролиза или гидрогенолиза. Карбобензоксизащита: 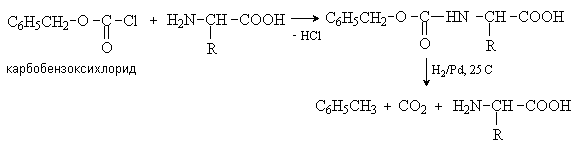 трет-Бутоксикарбонильная защита (БОК-защита). 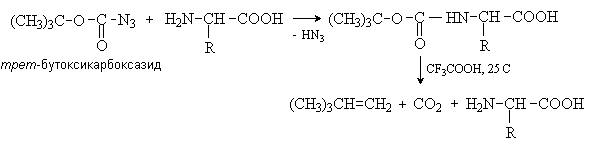 Легкость снятия защиты обусловлена устойчивостью бензил- и трет-бутил-катионов, которые образуются в качестве интермедиатов. 2.3. Реакции по карбоксильной группе Декарбоксилирование При сухой перегонке в присутствии гидроксида бария аминокислоты декарбоксилируются с образованием аминов. 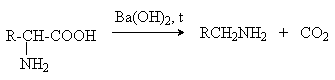 Этерификация Аминокислоты взаимодействуют со спиртами в присутствии газообразного HCl как катализатора с образованием сложных эфиров. 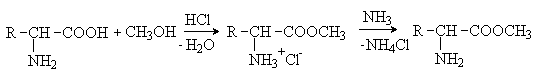 В отличие от самих аминокислот, их сложные эфиры – легко летучие соединения и могут быть разделены путем перегонки или газожидкостной хроматографии, что используется для анализа и разделения смесей аминокислот, полученных при гидролизе белков. Получение галогенангидридов и ангидридов При действии на защищенные по аминогруппе аминокислоты галогенидов фосфора или серы образуются хлорангидриды. 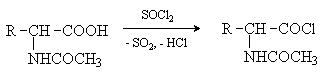 Реакция используется для активации карбоксильной группы при нуклеофильном замещении. Чаще для этой цели получают смешанные ангидриды, которые являются более селективными ацилирующими реагентами. 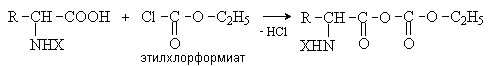 Реакция используется для активации аминогруппы в синтезе пептидов. 2.4. Специфические реакции аминокислот Реакции с одновременным участием карбоксильной и аминогрупп идут, как правило, с образованием продуктов, содержащих термодинамически устойчивые 5-ти- и 6-тичленные гетероциклы. Комплексообразование a -Аминокислоты образуют прочные хелатные комплексы с ионами переходных металлов (Cu, Ni, Co, Cr и др.). 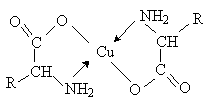 Отношение аминокислот к нагреванию Превращения аминокислот при нагревании зависят от взаимного расположения карбоксильной и аминогруппы и определяются возможностью образования термодинамически стабильных 5-ти- 6-тичленных циклов a -Аминокислоты вступают в реакцию межмолекулярного самоацилирования. При этом образуются циклические амиды – дикетопиперазины. 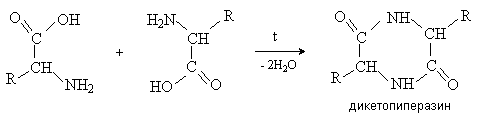 b -Аминокислоты при нагревании переходят a ,b -непредельные кислоты. 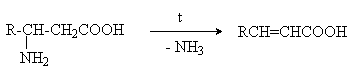 g - и d -Аминокислот претерпевают внутримолекулярное ацилирование с образованием циклических амидов – лактамов. 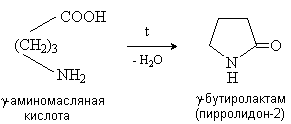 Нингидриновая реакция При взаимодействии a -аминокислот с трикетоном – нингидрином происходит одновременное окислительное дезаминирование и декарбоксилирование с образованием альдегида и окрашенного продукта конденсации. 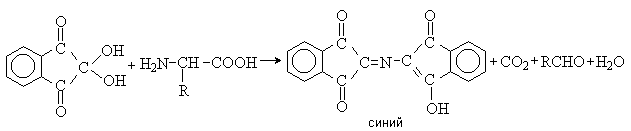 Реакция используется для количественного анализа аминокислот методом фотометрии.
3.1. Строение и классификация Природные аминокислоты отвечают общей формуле RCH(NH2)COOH и отличаются строением радикала R. Формулы и тривиальные названия важнейших аминокислот приведены в таблице. Для биологического функционирования аминокислот в составе белков определяющим является полярность радикала R. По этому признаку аминокислоты разделяют на следующие основные группы (см. таблицу). Общие способы получения аминокислот Приведенные ниже способы получения аминокислот разобраны на примере моноаминомонокарбоновых кислот. Но они применимы также для синтеза аминокислот с другим числом амино- и карбоксильных групп при условии соответствующего подбора исходных соединений. 1. Действие аммиака на галоидзамещенные жирные кислоты: Чтобы свести к минимуму нежелательное образование иминодиуксусной кислоты по реакции 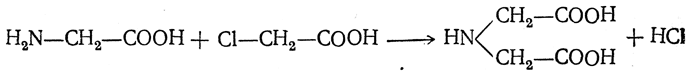 реакцию ведут с очень большим избытком аммиака или в присутствии карбоната аммония, который защищает аминогруппу. Образующееся карбаминовое производное аминокислоты легко разлагается при нагревании. 2. Получение из циангидринов альдегидов и кетонов (циангидринный метод). Важной реакцией получения α-аминокислот является действие аммиака на циангидрины альдегидов и кетонов 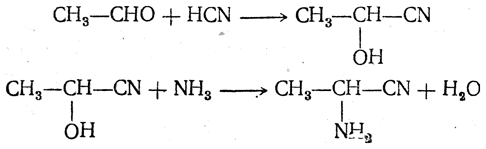 с последующим омылением аминонитрила в аминокислоту: 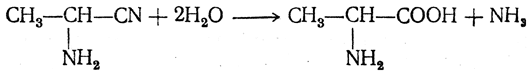 Аминонитрилы можно получить также, действуя на альдегиды или кетоны непосредственно цианистым аммонием. Эта реакция приобрела особое значение после того, как Н. Д. Зелинский с сотрудниками показали, что синильную кислоту и аммиак или цианистый аммоний можно заменить смесью водных растворов хлористого аммония и цианистого калия, в результате обменного разложения дающих цианистый аммоний, который и вступает в реакцию с альдегидами или кетонами: 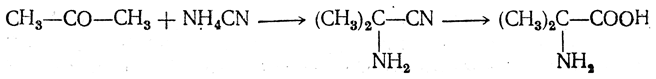 3. Синтезы из сложных эфиров, содержащих подвижный атом водорода. Большое значение приобрели синтезы аминокислот из малонового, циануксусного и ацетоуксусного эфиров. Пользуясь этими методами, можно получить аминокислоты, содержащие различные радикалы. а) Синтез из малонового эфира. Из малонового эфира получают нитрозомалоновый эфир, который восстанавливают в аминомалоновый эфир водородом в присутствии катализатора или цинком в кислой среде:  Защитив аминогруппу ацетилированием 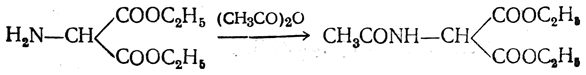 полученный ацетиламиномалоновый эфир алкилируют, действуя на него последовательно металлическим натрием и галоидным алкилом: 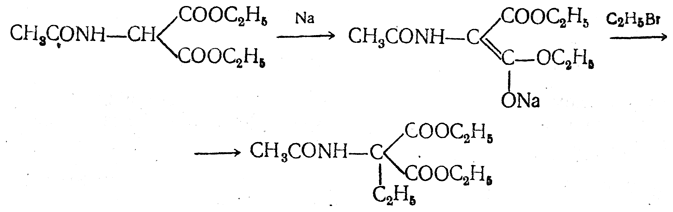 После омыления и декарбоксилирования получается α-аминокислота: 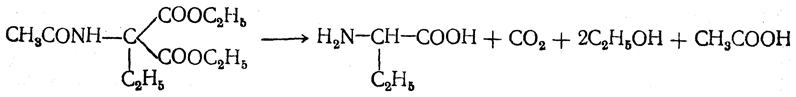 б) Синтез из циануксусного эфира проводится аналогично синтезу из малонового эфира. в) Синтез из ацетоуксусного эфира. При действии на однозамещенные ацетоуксусные эфиры растворомфенилдиазотата, а затем щелочью отщепляется уксусная кислота и образуется неустойчивое азосоединение, которое изомеризуется в фенилгидразон соответствующей кетокислоты: 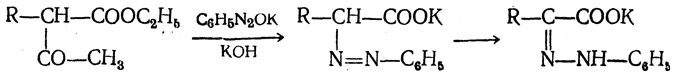 Восстановление фенилгидразона кетокислоты цинком в солянокислой спиртовой среде приводит к α-аминокислоте: 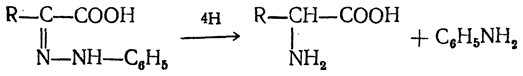 Этот метод синтеза аминокислот предложен В. В. Феофилактовым. 4. В осст а н ов л ен и е оксимов или гидразонов альдегид о- или кетонокислот. Например: 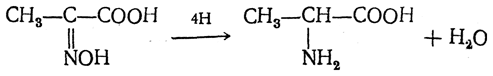 Особенно удачным оказался метод, состоящий в одновременном действии на кетокислоту аммиака и водорода в присутствии катализатора (платины или палладия). По-видимому, при этом промежуточно образуется иминопроизводное: 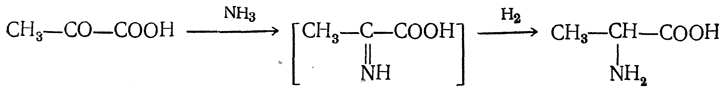 Этим методом синтезируют аминокислоты, содержащие изотоп азота N15(«меченый азот»), которыми пользуются при изучении поведения аминокислот вживом организме. В последние годы предложено еще два новых общих метода синтеза аминокислот, основанных на использовании дешевого промышленного сырья — фурана и тиофена. 5. Синтез аминокислот из фурановых производных (метод А. П. Терентьева и Р. А. Грачевой) основан на легкости окисления фуранового кольца перманганатом с образованием карбоксильной группы. Если в боковой цепи у фуранового кольца имеется аминогруппа (обычно защищенная бензоильной группой), то в результате окисления получается бензоиламинокислота, а после омыления — сама аминокислота. В зависимости от положения аминогруппы в цепи получается α-, β-, γ- и т. п. кислота. Так, при окислении 1-бензоиламино-1-(α-фурил)-алкилов получается α-кислота, например из 1-бензоиламино-1-(α-фурил)-этана — бензоил-α-аланин: 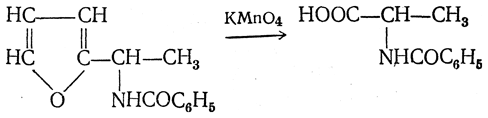 Для получения β-аминокислот пользуются 2-бензоиламино-1-(α-фурил)алкилами 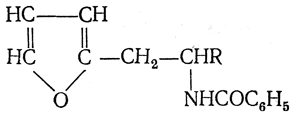 адля синтеза γ-аминокислот берут 3-бензоиламино-1-(α-фурил)-алкилы: 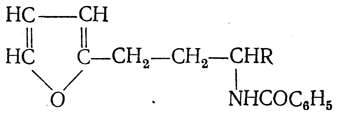 6. Синтез аминокислот из производных тиофен а (метод Я. Л. Гольдфарба, Б. П. Фабричного и И. Ф. Шалавиной) основан на восстановительном десульфировании производных тиофена или его гомологов водородом скелетного никелевого катализатора. В зависимости от взятого производного десульфирование приводит к аминокислотам с разным положением аминогруппы. Изтиенилальдегида обычными методами получают тиенил-α- илитиенил-β-аминокислоты 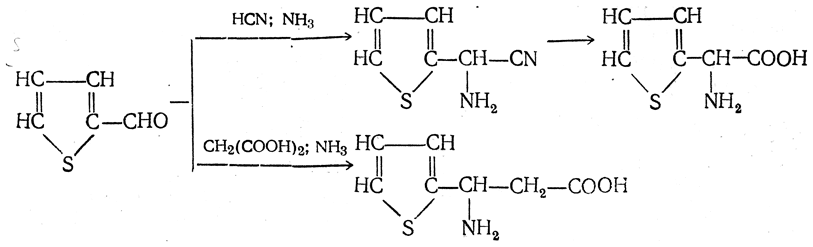 которые затем десульфируют: 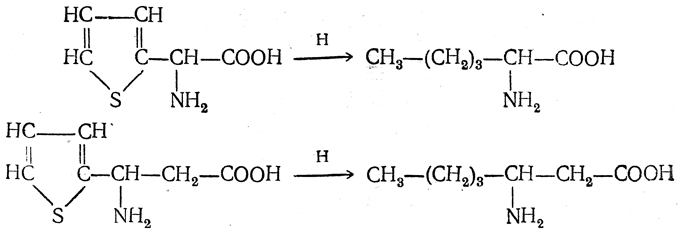 Изразных оксиминокислот тиофенового ряда 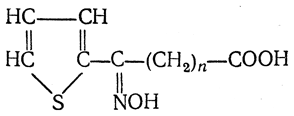 можно получатьаминокислоты с любым положением аминогруппы. Наконец, можно ввестинепосредственно вядро тиофена нитро- икарбоксильную группы, например 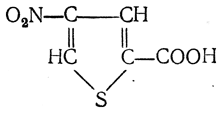 изатем прогидрировать полученное соединение никелем Ренея. Этим путем можно получать только γ- и δ-аминокислоты. Способы получения аминокислот с удаленной аминогруппой (β-, γ-, δ-, ε-, . . ., ω-аминокислот). Кроме общих способов получения аминокислот, дающих возможность синтезировать как α-аминокислоты, так и кислоты с удаленной аминогруппой, для получения последних имеются и специальные методы, рассматриваемые ниже. 1. Присоединение аммиака к ненасыщенным кислотам. При действии аммиака в спиртовом растворе на α,β-ненасыщенные кислоты или их эфиры аминогруппа вступает в β-положение. Как и в случае присоединения воды при образовании оксикислот, аммиак, вероятно, сначала присоединяется в положение 1,4 системы сопряженных двойных связей: 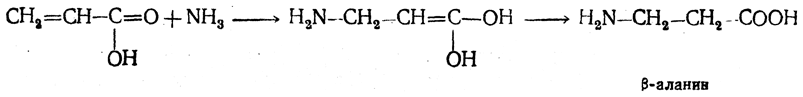 Поэтому присоединение аммиака идет против правила Марковникова. Реакцию удобнее проводить, действуя на эфир акриловой кислоты не аммиаком, афталимидом (в присутствии гидроокиситриметилфениламмония как катализатора): 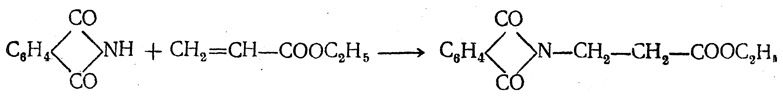 Гидролизом образующегося эфира фталил-β-аланина можно получить исам β-аланин: 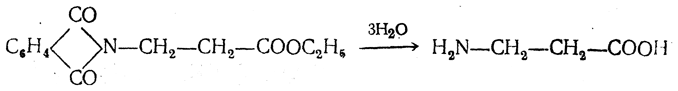 2. Конденсация альдегидов с малоновой кислотой в присутствии спиртового раствора аммиака. Этот путь синтеза, разработанный В. М. Родионовым с сотрудниками, является общим методом получения β-аминокислот: 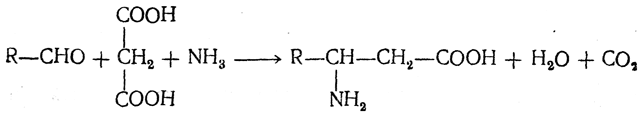 3. Получение из оксимов циклических кетон о в. δ- и ε-Аминокислоты получают чаще всего из оксимов циклических кетонов путем так называемой бекмановской перегруппировки. Так, например, оксим циклогексанона под действием серной кислоты изомеризуется с расширением цикла, в результате чего образуется ε-капролактам: 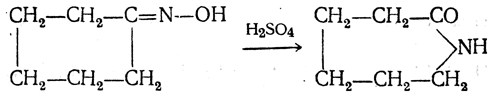 Эта реакция используется для производства капролактама в промышленном масштабе. Гидролиз капролактама приводит к ε-аминокапроновой кислоте: 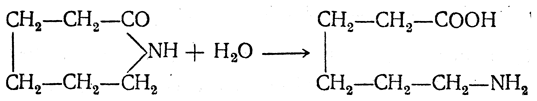 4. Получение «-аминокислот действием аммиака на ω-га л о и дз а м еще н н ы е кислоты. ω-Аминокислоты с нечетным числом углеродных атомов получаются из тетрахлоралканов типа Сl—(СН2—СН2)n—ССl3, являющихся продуктами реакции теломеризации. Гидролиз тетрахлоралканов указанного типа, полученных из этилена и четыреххлористого углерода, приводит к ω-хлоркарбоновым кислотам, которые действием избытка аммиакапревращаются в соответствующие ω-аминокислоты, например: 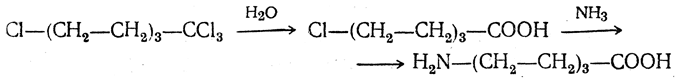 Этим путем получается ω-аминоэнантовая кислота — исходный продукт для получения синтетического волокна энант (А. Н. Несмеянов, Р. X. Фрейдлина и др.). Пептиды Петиды – это полиамиды, построенные из a -аминокислот. По числу аминокислотных остатков в молекуле пептида различают дипептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами, более 10 аминокислотных остатков – полипептидами. Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками. 4.1. Строение пептидов Формально пептиды можно рассматривать как продукты поликонденсации аминокислот. 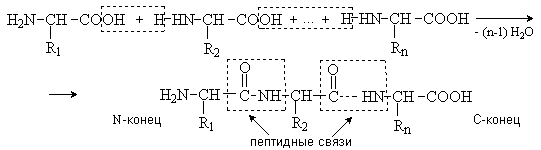 Аминокислотные остатки в пептиде связаны амидными (пептидными) связями. Один конец цепи, на котором находится аминокислота со свободной аминогруппой, называют N-концом. Другой конец, на котором находится аминокислота со свободной карбоксильной группой, называют С-концом. Пептиды принято записывать и называть, начиная с N-конца. Название пептида строят на основе тривиальных названий, входящих в его состав аминокислотных остатков, которые перечисляют, начиная с N-конца. При этом в названиях всех аминокислот за исключением С-концевой суффикс “ин” заменяют на суффикс “ил”. Для сокращенного обозначения пептидов используют трехбуквенные обозначения входящих в его состав аминокислот. 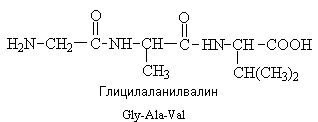 Пептид характеризуется аминокислотным составом и аминокислотной последовательностью. Аминокислотный состав пептида может быть установлен путем полного гидролиза пептида (расщепления до аминокислот) с последующим качественным и количественным анализом образовавшихся аминокислот методом ионобменной хроматографии или ГЖХ-анализом сложных эфиров аминокислот. Полный гидролиз пептидов проводят в кислой среде при кипячении их с 6н. HCl. Одному и тому же аминокислотному составу отвечает несколько пептидов. Так, из 2-х разных аминокислот может быть построено 2 дипептида, из трех разных аминокислот – 6 трипептидов, из n разных аминокислот n! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечают следующие 6 трипептидов. Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val Ala-Val-Glu Таким образом, для полной характеристики пептида необходимо знать его аминокислотный состав и аминокислотную последовательность. 4.3. Синтез петидов Синтез пептида с заданной аминокислотной последовательностью – чрезвычайно сложная задача. В простейшем случае синтеза дипептида из 2-х разных аминокислот возможно образование 4-х разных продуктов. В настоящее время разработана стратегия синтеза пептидов, основанная на использовании методов активации и защиты функциональных групп на соответствующих этапах синтеза. Процесс синтеза дипептида включает следующие стадии:
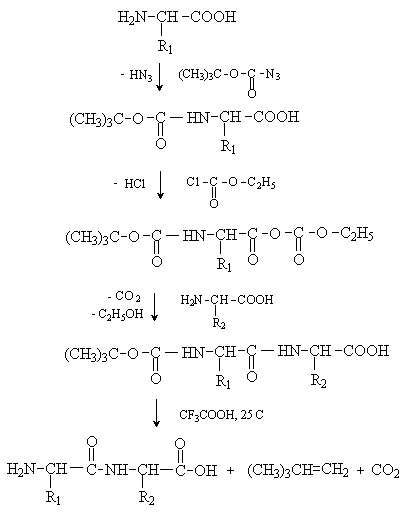 Таким образом, последовательно присоединяя аминокислоты, шаг за шагом наращивают цепь полипептида. Такой синтез очень длителен, трудоемок и дает низкий выход конечного продукта. Основные потери связаны с необходимостью выделения и очистки продуктов на каждой стадии. Этих недостатков лишен используемый в настоящее время твердофазный синтез пептидов. На первой стадии защищенная по аминогруппе С-концевая аминокислота закрепляется на твердом полимерном носителе (полистироле, модифицированном введением групп –CH2Cl). После снятия защиты проводят ацилирование аминогруппы закрепленной на носителе аминокислоты другой аминокислотой, которая содержит активированную карбоксильную и защищенную аминогруппу. После снятия защиты проводят следующую стадию ацилирования. Отмывание продукта от примесей проводят прямо на носителе и лишь после окончания синтеза полипептид снимают с носителя действием бромистоводородной кислоты. Твердофазный синтез автоматизирован и проводится с помощью приборов – автоматических синтезаторов. 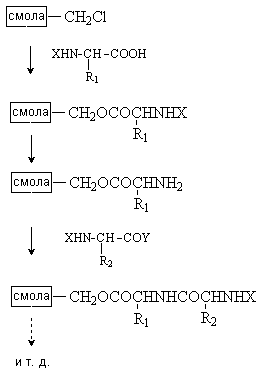 Методом твердофазного синтеза получено большое количество пептидов, содержащих 50 и более аминокислотных остатков, в том числе инсулин (51 аминокислотный остаток) и рибонуклеаза (124 аминокислотных остатка). |
