Химия. Химия_билет 15. 1. Применение второго начала термодинамики к процессам, происходящим в закрытой системе. Свободная энергия Гиббса, полезная работа Гельмгольца
 Скачать 385.75 Kb. Скачать 385.75 Kb.
|
|
Билет № 15 1. Применение второго начала термодинамики к процессам, происходящим в закрытой системе. Свободная энергия Гиббса, полезная работа Гельмгольца. Ответ: Подавляющее большинство реальных химических систем не являются изолированными, так как могут обмениваться с внешней средой теплотой и работой. Для определения возможности самопроизвольного протекания химических процессов вводятся еще две функции состояния: 1) для изобарно-изотермических условий – свободная энергия Гиббса (G): при p = const, T = const G = H - TS 2) для изохорно-изотермических условий – полезная работа Гельмгольца (F): при V = const, T = const F = U – TS. На практике обычно используется энергия Гиббса, так как условия, близкие к изобарно-изотермическим, встречаются чаще. Из второго начала термодинамики следует, что в закрытой системе (т.е. системе, которая может обмениваться с внешней средой теплом, но не может обмениваться с ней веществом) процесс может протекать самопроизвольно, если ΔG (ΔF) < 0. Процессы, для которых расчет показывает ΔG (ΔF) > 0, в закрытой системе сами по себе идти не могут (они осуществимы только при действии на систему внешних сил). 2. Найти изменение энтропии в реакции: 2C2H2 + 5О2 = 4СО2 + 2Н2О, при стандартных условиях, если S° (Н2О) = 188,78 Дж/моль • К, S° (CО2) =213,65 Дж/моль • К, S° (C2H2) = 200,80 Дж/моль • К. Решение: Из справочника найдем недостающую стандартную энтропию для кислорода: S°(О2) = 205,0 Дж/моль • К. По следствию из закона Гесса: ΔS° = 4S°(CО2) + 2S°(Н2О) – 2S°(C2H2) – 5S°(О2) = = 4·213,65 + 2·188,78 - 2·200,8 - 5·205 = -194,44 Дж/моль • К. Как видно ΔS° < 0, энтропия системы уменьшается, так как из семи молей газов образовалось только шесть молей других газов. Ответ: ΔS° = -194,44 Дж/моль • К. Что такое буферное действие? Покажите буферное действие аммиачного буферного раствора при прибавлении к нему щелочи. Ответ: Буферность (буферное действие) – это способность системы противостоять нарушению установившегося в ней равновесия при внешнем воздействии. Внешними воздействиями могут быть изменения давления, температуры, разбавление, введение в систему новых веществ. Механизм действия буферной системы рассмотрим на примере аммиачной буферной системы: NН4ОН (NН3 х Н2О) + NН4С1. Гидроксид аммония – слабый электролит, в растворе частично диссоциирует на ионы: NН4ОН <=> NН4+ + ОН- При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы NН4С1 <=> NН4+ + С1- и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции. Способность буферных смесей поддерживать практически постоянное значение рН раствора основана на том, что входящие в них компоненты связывают ионы Н+ и ОН-, вводимые в раствор или образующиеся в результате реакции, протекающей в этом растворе. При добавлении к аммиачной буферной смеси щелочи ионы ОН- будут связывать ионы NН4+, образуя при этом малодиссоциированное соединение, а не увеличивать рН раствора. Буферное действие прекращается, как только одна из составных частей буферного раствора (сопряженное основание или сопряженная кислота) полностью израсходуется. Вычислить рН буферного раствора состоящего из 10 мл уксусной кислоты и 20 мл ацетата натрия одинаковой концентрации. Формула для расчета рН кислотной буферной системы: pH = pKa + lg(Cсоли/Cкисл) где Ка – константа диссоциации кислоты. Здесь Ка = 1,8·10-5, pKa = -lgKa = -lg(1,8·10-5) = 4,74 По условию концентрации исходных растворов одинаковы и равны С. Когда их смешали, объем раствора изменился, изменились и обе концентрации. Общий объем раствора стал 10 + 20 мл = 30 мл = 0,03 л. Концентрация ацетата Ссоли станет равной: Ссоли = 0,02С/0,03. Аналогично считаем Скисл: Скисл = 0,01С/0,03. Окончательно рН = 4,74 + lg(0,02/0,01) = 4,74 + 0,30 = 5,04. Ответ: рН = 5,04. Покажите график кондуктометрического титрования смеси сильной и слабой кислоты и объясните его. Ответ: При титровании смеси сильной и слабой кислот сильным основанием первоначальное падение электропроводности (участок ab) 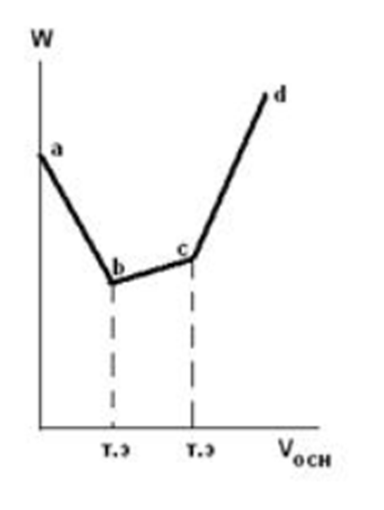 объясняется теми же причинами, что и при титровании сильной кислоты до достижения точки эквивалентности (в результате связывания ионов Н+, обладающих высокой подвижностью. Суммарное число ионов в растворе сохраняется, так как ионы водорода эквивалентно заменяются менее подвижными ионами). Повышение электропроводности раствора после достижения первой точки эквивалентности (на участке bc) вызывается теми же причинами, что и в случае титрования слабой кислоты до точки эквивалентности (происходит замещение слабого электролита (кислоты), мало диссоциирующего на ионы, на сильный электролит. Электропроводность раствора возрастает незначительно вследствие низкой подвижности образующихся при диссоциации соли ионов). После достижения второй точки эквивалентности в растворе накапливаются ионы ОН-, поэтому электропроводность раствора на участке сd растет более резко, чем на участке bc. Вычислить степень электролитической диссоциации 0,01н раствора муравьиной кислоты, если Кдисс. = 1,82 • 10-4 . Решение: Диссоциация муравьиной кислоты идет по уравнению НСООН H+ + HCOO-. Для одноосновной кислоты нормальность равна молярности, то есть С = 0,01 М = 0,01 моль/л. Константа диссоциации запишется в виде К = [H+]·[HCOO-] / [НСООН] = [H+]2 / C. Откуда [H+] = (К·С)0,5 = (1,82 · 10-4 ·0,01)0,5 = 0,00135 моль/л. Окончательно, степень диссоциации муравьиной кислоты составит α = [H+]·100 / С = 0,00135·100 / 0,01 = 13,5 %. Ответ: α = 13,5 %. 7. Электрокинетические явления в коллоидных системах. Что такое электрофорез, электроосмос? Ответ: Электрокинетические явления подразделяют на две группы: прямые и обратные. К прямым относят те электрокинетические явления, которые возникают под действием внешнего электрического поля (электрофорез и электроосмос). Обратными называют электрокинетические явления, в которых при механическом перемещении одной фазы относительно другой возникает электрический потенциал (потенциал протекания и потенциал седиментации). Электрофорез и электроосмос были открыты Ф. Рейссом (1808). Он обнаружил, что если во влажную глину погрузить две стеклянные трубки, заполнить их водой и поместить в них электроды, то при пропускании постоянного тока происходит движение частичек глины к одному из электродов. Это явление перемещения частиц дисперсной фазы в постоянном электрическом поле было названо электрофорезом. В другом опыте средняя часть U-образной трубки, содержащей воду, была заполнена толченым кварцем, в каждое колено трубки помещен электрод и пропущен постоянный ток. Через некоторое время в колене, где находился отрицательный электрод, наблюдалось поднятие уровня воды, в другом опускание. После выключения электрического тока уровни воды в коленах трубки уравнивались. Это явление перемещения дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрическом поле названо электроосмосом. 8. Золь сульфата бария получен при смешивании равных объемов нитрата бария и серной кислоты. Одинаковы ли исходные концентрации электролитов, если в электрическом поле полученный золь перемещается к аноду? Напишите формулу мицеллы золя. Решение: Уравнение реакции получения золя имеет вид: Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3. Если частицы золя перемещаются к аноду (положительному электроду), значит, они заряжены отрицательно. Это означает, что один из реагентов взят в избытке, а именно, серная кислота. Тогда ее исходная концентрация должна быть выше, чем у нитрата бария. Серная кислота будет электролитом-стабилизатором: H2SO4 2H+ + SO42-. Формула мицеллы золя: {m[BaSO4]·nSO42-·2(n-x)H+}2x-·2xH+ То есть заряд коллоидных частиц равен 2х-. 9. Почему вязкость ВМС минимальна в изоэлектрической точке? Ответ: Значение рН, при котором ВМС находится в изоэлектрическом состоянии, т.е. в состоянии, при котором число положительных и отрицательных зарядов одинаково, общий заряд равен нулю, называется изоэлектрической точкой (ИЭТ). В изоэлектрическом состоянии свойства растворов ВМС резко меняются: они имеют наименьшую растворимость, наименьшую вязкость, что связано как с изменением формы макромолекулы, так и степени ее гидратации. При значении рН, близком к изоэлектрической точке, разноименно заряженные группы притягиваются друг к другу и нить закручивается в спираль. При смещении рН среды от ИЭТ одноименно заряженные группы отталкиваются друг от друга и цепь выпрямляется. 10. Покажите схематически формулу белка при рН меньше, чем рНиэт. Ответ: 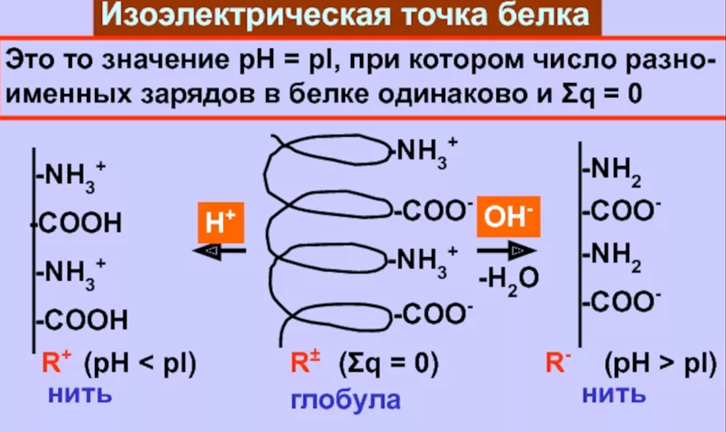 11.По какой формуле можно рассчитать степень электролитической диссоциации с помощью метода криоскопии? Поясните, входящие в нее обозначения. Ответ: Степень диссоциации электролита можно определить по отклонению понижения температуры кристаллизации в растворе электролита от понижения температуры кристаллизации неэлектролита той же моляльной концентрации. Опыт проводится на приборе, изображенном на рисунке (криоскоп). Наружный стакан заполнен охлаждающей смесью из льда или снега с поваренной солью. Во внутренний стакан вставлены термометр с ценой деления 0,1 °С со шкалой до минус 3 °С (на какую положительную температуру он рассчитан, не имеет значения) и проволочная мешалка. Прибор можно использовать для различных хорошо растворимых солей: NaCl, KCl, Kl, KNO3, NaNO3. 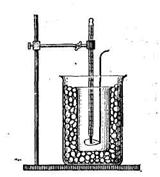 Методика эксперимента следующая. Взять соль, степень диссоциации которой надо определить. Заполнить наружный стакан почти до верха охлаждающей смесью (снег и поваренная соль). Во внутренний стакан налить дистиллированной воды и собрать прибор. Определить температуру кристаллизации (замерзания) чистой воды (она может несколько отклоняться от 0 °С по термометру из-за неточности изготовления последнего). Записывать показания термометра в течение 4 мин через каждые 20 с при периодическом перемешивании. По полученным данным построить график температура-время (удобнее по оси ординат откладывать температуру). Отметить на графике температуру, при которой наблюдается появление первых кристаллов льда, - это и есть температура кристаллизации воды. Иногда вода переохлаждается, и при появлении льда ее температура несколько повышается, а затем снова начинает падать. В этом случае точкой кристаллизации является температура после повышения, но до последнего спуска. Записать полученную таким образом точку кристаллизации чистой воды. Второй (сухой) стакан взвесить нa техно-химических весах и затем взвесить в нем количество полученной соли, отвечающее 0,2 моль ее. Прилить 100 мл дистиллированной воды. Размешать соль до полного растворения раствора и описанным выше способом определить температуру кристаллизации раствора по появлению кристаллов, учитывая, что в этом случае также возможно переохлаждение. Все наблюдения записать в журнал. Результаты измерений записать по следующей форме: Масса стакана, m1 г. Масса стакана с солью, m2, г. Масса соли, m = m2 — m1 г. Масса воды, m(н2о), г (равна ее объему, мл). Температура кристаллизации воды, Tкр , °C. Температура кристаллизации раствора, T'кр , °C. Рассчитать моляльную концентрацию раствора где М – молекулярная масса соли. Вычислить понижение температуры кристаллизации раствора неэлектролита по следствию из закона Рауля: ΔТнеэл == КH2O· где КH2O – криоскопическая постоянная воды, равная 1,86°. Определить понижение температуры кристаллизации взятого раствора электролита ΔТэл по экспериментальным данным: ΔТэл = Tкр – T'кр Найти изотонический коэффициент:  Соотношение между изотоническим коэффициентом и степенью диссоциации α выражается формулой: где n – число ионов, на которые распадается электролит. Если взятые соли - бинарные электролиты, то рассчитать кажущуюся степень диссоциации по формуле: α = i – 1. 12.При какой температуре будет кипеть 50% раствор сахарозы? Решение: Формула сахарозы С12Н22О11, молекулярная масса М = 342 г/моль. По определению массовой доли в 100 г раствора будет содержаться 50 г сахарозы и 50 г воды. Тогда моляльная концентрация раствора составит: Сm = m·1000 / (M·m(воды)) = 50·1000 / (342·50) = 2,924 моль/кг воды. Раствор сахарозы является неэлектролитом, то есть изотонический коэффициент равен единице (i = 1). Тогда по II закону Рауля с учетом эбулиоскопической постоянной воды Е Δtкип = Е·Сm = 0,52·2,924 = 1,52оС. Поскольку температура кипения чистой воды равна 100оС, а раствор всегда кипит при более высокой температуре, чем чистый растворитель, то температура кипения 50%-го раствора сахарозы составит tкип = 100 + 1,52 = 101,52оС. Ответ: tкип = 101,52оС. |
