2 колок. 1. Равновесие в растворах комплексных соединений Строение комплексных соединений
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
1. Равновесие в растворах комплексных соединений: - Строение комплексных соединений. Согласно координационной теории Вернера молекула комплексного соединения содержит центральный ион, несущий обычно положительный заряд и называемый комплексообразователем. Он удерживает (координирует) в непосредственной близости некоторое число ионов с противоположным зарядом (или полярных молекул), называемых лигандами, или аддендами (от лат. слова ligare- связывать). Ионкомплексообразователь и лиганды составляют вместе так называемую внутреннюю координационную сферу. В формулах комплексных соединений внутреннюю координационную сферу ограничивают квадратными скобками. Если комплексное соединение носить ионный характер, то в этом случае у него появляется внешняя сфера, образованная ионами противоположного знака. Комплексообразователями могут быть практически любые металлы s-, p-, d- семейства, лигандами – р- элементы, их ионы или соединения. Лиганды могут иметь положительный или отрицательный заряд или быть нейтральными. - Устойчивость комплексов. Кн– константа нестойкости комплексного иона, отношение концентрации полученных компонентов к концентрации неионизированных комплексных молекул, оставшихся к моменту наступления равновесия. Кн – для данного вещества при данных условиях величина постоянная и от концентрации не зависит, характеризует устойчивость комплексных соединений. Чем устойчивее комплекс, тем меньше константа нестойкости. Величина обратная Кн является константа устойчивости (образования) (Ky), соответственно чем больше Ky тем устойчивее комплекс. - Расчет равновесий в растворах комплексных соединений (функция образования, мольные доли отдельных комплексов). Зная величину Кн или Ky можно рассчитывать концентрацию лиганда, комплексообразователя или всего комплексного иона в растворе. Комплексы диссоциируют ступенчато в растворе, степень этой диссоциации рассчитывают используя функцию образования ( 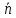 ) , которая представляет собой среднее значение к.ч. и связана с концентрацией свободных лигандов и константами образования каждого комплекса. Функцию образования это среднее число лиганда, приходящееся на один центральный ион металла при определенном значении равновесной концентрации свободного лиганда. Если равновесная концентрация свободного лиганда известна: ) , которая представляет собой среднее значение к.ч. и связана с концентрацией свободных лигандов и константами образования каждого комплекса. Функцию образования это среднее число лиганда, приходящееся на один центральный ион металла при определенном значении равновесной концентрации свободного лиганда. Если равновесная концентрация свободного лиганда известна: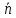 = =  где  общая концентрация лиганда, общая концентрация лиганда,  - концентрация свободных лигандов, - концентрация свободных лигандов,  концентрация комплексообразователя. концентрация комплексообразователя. 2. Окислительно-восстановительные реакции в аналитической химии: - Характер окислительно-восстановительных реакций. Окислительно-восстановительные реакции (ОВР)– это реакции, которые сопровождаются переходом электронов от одних частиц (атомов, молекул и ионов) к другим, что приводит к изменению степеней окисления элементов. Окисление – это процесс, при котором происходит отдача электронов атомом, молекулой или ионом: Восстановление – это процесс, при котором происходит присоединение электронов атомом, молекулой или ионом. В реакциях окисления-восстановления всегда участвуют два вещества, одно из которых является восстановителем, а другое окислителем. При этом количество электронов, принятых окислителем, всегда должно быть равно количеству электронов, отданных восстановителем. Окислительно-восстановительная реакция может происходить лишь при непосредственном взаимодействии окислителя (окисленной формы) одной сопряженной редокс-пары с восстановителями (восстановленной формой) другой сопряженной редокспары. При этом общая редокс-реакция состоит из двух частных. Таким образом, каждую окислительно-восстановительную реакцию можно представить как сумму двух полуреакций. Одна из них отражает превращение окислителя, а другая – восстановителя. - Стандартный и реальный окислительно-восстановительный потенциал. В случае, когда все компоненты полуреакции находятся в стандартном состоянии (гипотетический одномолярный раствор с коэффициентами активности компонентов, равными единице, при нормальном атмосферном давлении и температуре). Потенциал такого электрода называют стандартным электродным потенциалом и обозначают  . Зависимость реального равновесного окислительно-восстановительного потенциала- Е (или электродного потенциала - для металлов) от активностей окисленной, восстановленной форм и от температуры выражается уравнением Нернста: . Зависимость реального равновесного окислительно-восстановительного потенциала- Е (или электродного потенциала - для металлов) от активностей окисленной, восстановленной форм и от температуры выражается уравнением Нернста: Реальный окислительно-восстановительный потенциал - потенциал, зависящий не только от свойств окислительно-восстановительной системы, но и от среды, в которой протекает реакция. В большинстве случаев его значение определяется только экспериментально. На величину реального потенциала оказывают влияние такие факторы, как рН среды, концентрации реагентов, комплексообразование, образование осадков и др - Направление окислительно-восстановительных реакций. - окислительно-восстановительная реакция будет самопроизвольно протекать в таком направлении, при котором полуреакция с более высоким значением окислительно-восстановительного потенциала выступает в качестве окислителя по отношению к полуреакции с более низким потенциалом. Иными словами, окислительно-восстановительная реакция может протекать в том случае, если разность потенциалов полуреакций соответствующего гальванического элемента положительна. По мере протекания реакции концентрации окисленной и восстановленной форм в полуреакциях изменяются таким образом, что потенциал окислителя уменьшается, а восстановителя - возрастает. В результате разность потенциалов уменьшается, движущая сила процесса ослабевает. Окислительно-восстановительная реакция будет протекать до тех пор, пока потенциалы полуреакций не станут равными. При равенстве потенциалов в системе устанавливается химическое равновесие. - Равновесие при окислительно-восстановительных процессах. Так в количественном анализе используют те реакции, которые практически протекают на 100 % (или приближаются к этому). Степень протекания реакции определяется константой равновесия. Если уравнение окислительно-восстановительной реакции представить в общем виде схемой:  При расчете константы равновесия в реальных системах в формулу подставляют не стандартные потенциалы редокс пар, а реальные, рассчитанные по уравнению Нернста. 3. Химическое равновесие в гетерогенных системах: - Произведение растворимости. Оношение двух констант есть константа растворимости - произведение растворимости (ПР):  =const= ПР =const= ПРВ общем виде для бинарного электролита (одинаковый заряд катиона и аниона) выражение ПР имеет следующий вид:  Для насыщенных растворов как бы ни менялась концентрация отдельных ионов при постоянной температуре и давлении произведение концентрации их ионов (ПР) величина постоянная и приводится в справочной литературе. Для более точного вычисления произведений растворимости следовало бы пользоваться не концентрациями ионов малорастворимого электролита, а их активностями, так как в растворе электролита действуют межионные силы. Выражение ПР в общем виде для бинароного электролита с учетом ионной силы приобретает вид: Однако в насыщенных растворах малорастворимых электролитов концентрации ионов весьма незначительны. Поэтому и силы межионного взаимодействия в них настолько слабы и ими можно пренебречь. На практике произведения растворимости электролита вычисляют, пользуясь только концентрациями ионов. Исключение составляют величины ПР относительно хорошо растворимых электролитов.  Правило произведения растворимости (ПР) в 1889 году сформулировал В. Нернст, применив закон действующих масс к выпадению осадка электролита из его насыщенного раствора . Правило ПР гласит, что произведение концентраций (активностей) ионов малорастворимого электролита в его насыщенном растворе есть величина постоянная при постоянной температуре. - Расчет растворимости малорастворимых веществ. Концентрация (молярная) вещества в насыщенном растворе характеризует его растворимость, которую обозначают Р или S (моль/л), которая является величиной постоянной в данном растворителе при данной температуре. Это позволяет вычислить ПР по известной растворимости вещества и наоборот растворимость по известному ПР. Общая формула для расчета растворимости для бинарных электролитов: Общая формула для расчета растворимости для бинарных с учетом ионной силы электролитов:  - Влияние одноименных ионов на растворимость, солевой эффект. Влияние одноименных ионов на растворимость осадков, это условие можно обосновать исходя из величины ПР для малорастворимого электролита. В соответствии с правилом произведения растворимости при увеличении концентрации одного из ионов, входящих в состав осадка, концентрация другого иона уменьшается и, наоборот, если концентрация одного будет уменьшаться, то другого – увеличиваться. Таким образом, для уменьшения растворимости вещества необходимо ввести в раствор ионы, одноименные с осадком. Солевой эффект. При приливании к насыщенному раствору малорастворимой соли сильного электролита, не имеющего общих (одноименных) ионов ионная сила раствора повышается. Вследствие этого коэффициенты активности ионов понижаются и становятся меньше единицы. Это приводит к тому, что произведение активностей ионов становится меньше ПР, т.е. раствор становится ненасыщенным (по сути происходит разбавление), что ведет к растворению осадка. Это явление называют солевым эффектом. - Условия образования осадков, влияние различных факторов на полноту осаждения Для образования осадков необходимо превышение величины произведения концентрации ионов малорастворимого электролита над величиной ПР, т.е. ИП > ПР. Это позволяет решить вопрос, выпадают ли осадки в растворах с определенными концентрациями. Полнота осаждения иона зависит от растворимости осаждаемого соединения, количества реактива-осадителя, его степени диссоциации, гидролизуемости, величины рН раствора и некоторых других факторов. Значение ПР. Порядок дробного (фракционного) осаждения. Нередко прибавляемый реактив образует малорастворимые соединения не с одним, а с двумя или несколькими ионами, находящимися в растворе. Если при этом берут избыток реактива, то образуется смесь осадков нескольких малорастворимых электролитов. Однако если реактив приливать постепенно (по каплям), то осадки этих соединений будут выделяться в определенной последовательности, которую можно предвидеть исходя из величин их произведений растворимости. Таким образом можно сравнивать значения ПР только однотипных электролитов. Если электролиты не однотипны (не бинарные), то для определения порядка осаждения или растворения необходимо сравнивать не величины ПР, а значения растворимости этих осадков. Для практически полного осаждения иона в виде соединения, заметно растворимого в воде, нужно добавлять избыток осаждающего реактива. Установлено, что если осадитель летучий, то его необходимо приливать в полуторократном избытке по сравнению со стехиометрическим значением, если не летучий осадитель, то его необходимо приливать в 30%-50% избытке по сравнению со стехиометрическим рассчитанным значением. Добавление большого избытка осадителя не только не способствует полноте осаждения иона, но, наоборот, часто вызывает растворение осадка. 3) Интервал рН. |
