Семестровая. 2. Физикохимические основы процесса получения битума Химия и механизм процесса
 Скачать 140.49 Kb. Скачать 140.49 Kb.
|
|
2. Физико-химические основы процесса получения битума 2.1. Химия и механизм процесса Процесс окисления сопровождают не только реакции присоединения кислорода к атомам углерода, т.е. образование связей С-О или С-О-О-, но и реакции отщепления протонов Н, приводящие к реакциям конденсации органических молекул и образованию молекул воды. То есть происходит либо присоединение кислорода к молекулам сырья с образованием асфальтогеновых кислот, либо отщепление водорода с образованием более конденсированных соединений – САВ. При окислении протекает множество реакций: окислительное дегидрирование, деалкилирование, окислительная полимеризация, поликонденсация, крекинг с последующим уплотнением его продуктов. 1) Окислительное дегидрирование – это отщепление атомов водорода в углеродной цепи при участии кислорода. а) Окислительное дегидрирование алканов: R – CH2 – СН3 + 0,5 О2 → R – CH= СН2 + Н2О алкен б) Окислительное дегидрирование алкенов: R –СН2 – СН2 - CH = СН2 + 0,5 О2 → R – CH= СН - СН= СН2+ Н2О алкадиен в) Окислительное дегидрирование спиртов: R – CH2 – OH + 0,5 О2 → R – C = O + H2O альдегид │ H R – CH – R1 + 0,5 O2 → R – C – R1 + Н2О кетон │ ║ ОН О г) Окислительное дегидрирование ароматических углеводородов с боковой цепью: Ar – CH2 – СН3 + 0,5 О2 → Ar – CH= СН2 + Н2О 2) Деалкилирование – это замещение алкильной группы в молекуле органического соединения на атом водорода. Деалкилирование проводят под действием кислот Льюиса, минеральных кислот, пиролизе или облучении. Например, деалкилирование применяют для получения бензола из толуола и высших его гомологов: 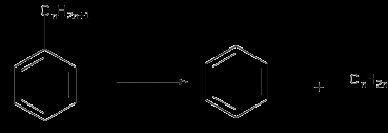 Деалкилирование гомологов бензола можно осуществить в присутствии водяного пара на никелевых или платиновых катализаторах при 350 -500оС. 3) Окислительная полимеризация происходит при образовании полимеров из непредельных органических соединений за счет поглощения ими кислорода. Окислительная полимеризация протекает по радикальному механизму за счет образования пероксидных радикалов по месту разрыва π-связи: ● R1 – CH = CH – R2 + O2 → R1 – CH – CH – R2 │ O │ O● Радикал соединяется с другой молекулой, инициируя полимеризацию: ● R1 – CH – CH – R2 R1 – CH – CH – R2 │ │ O О │ → │ O● О + │ ● R1 – CH = CH – R2 R1 - CH – CH – R2 Образовавшиеся вновь активные центры являются началом появления новых поперечных связей, в результате образуется трехмерный полимер. 4) Поликонденсация – это процесс образования молекул полимеров за счет взаимодействия между функциональными группами одинаковых или различных молекул мономеров сопровождающийся выделением побочных низкомолекулярных продуктов (например, воды). В качестве примера поликонденсации можно привести реакцию поликонденсации фенолов при образовании смол:   …Ar – OH + Ar-OH + Ar-OH … → Ar - O – Ar – O – Ar… + nH2O …Ar – OH + Ar-OH + Ar-OH … → Ar - O – Ar – O – Ar… + nH2On 5) Крекинг с последующим уплотнением его продуктов. Термический крекинг – процесс переработки нефтяных фракций путем их термического разложения с целью получения дополнительного количества светлых нефтепродуктов (бензина), крекинг-остатка для производства игольного кокса и термогазойля для производства сажи. Для крекинга парафинов характерен распад на более низкомолекулярные углеводороды: С8Н18 → С4Н10 + С4Н8 октан бутан бутен Бициклические нафтены при крекинге дают ароматические углеводороды, моноциклические нафтеновые углеводороды, алифатические углеводороды:  Бензол при крекинге переходит в дифенил с выделением водорода:  При термокрекинге, наряду с реакциями разложения, в результате которых получаются бензин и газ, протекают реакции уплотнения образовавшихся продуктов, в результате которых получается кокс и крекинг-остаток. Основная часть кислорода воздуха идет на образование воды и углекислого газа, незначительная часть – на образование органических веществ, содержащих кислород. Реакция окисления нефтяных остатков сильно экзотермическая, тепловой эффект, который составляет 200 – 1000 кДж/кг [17].               Гидроксикислоты Асфальтогеновые кислоты Карбены Асфальтены Смолы Кислоты Углеводороды Черножуков и Крейн [15] указали, что окисление, в зависимости от условий, может идти в двух направлениях:  Карбоиды 1) При жидкофазном окислении углеводородов в условиях относительно низких температур молекулярный кислород присоединяется только по связям С – Н, поэтому получение кислот протекает через промежуточную стадию образования гидроперекисей. СН3 СН3 │ │ R1 –CH2 – CH2 – C – CH2 – R2 + O2 → R1 –CH2 – CH2 – C – CH2 – R2 │ │ H O – O – H СН3 СН3 │ │ R1 –CH2 – CH2 – C – CH2 – R2 + O2 → R1 –CH2 – CH – C – CH2 – R2 │ │ │ O –O-H OO – H O –O –H Появление двух гидроперекисных групп у соседних атомов углерода приводит к разрыву связи С-С. В присутствии кислорода в результате распада двухатомных гидроперекисей образуются кислоты: R1 –CH2 – CH – CH – CH2 – R2 + ½ O2 → R1-CH2-COOH + R2 –CH2-COOH │ │ - H2O O –O-H O –O –H 2) При действии кислорода на образовавшиеся кислоты образуется новая гидроперекись с последующим ее разложением и образованием оксокислот: R – CH2 – CH2 – COOH + O2 → R – CH – CH2 – COOH → │ O – O –H → R – CH – CH2 – COOH + [O] │ OH Распад одноатомных гидроперекисей может происходить как при термическом воздействии, так и в присутствии кислорода и катализаторов. 3) Оксикислоты образуют эстолиды: НО – R- COOH + HO – R1 –COOH → HO – R –OCO –R1- COOH + H2O Эстолид представляет собой сложный эфир, который может снова вступать в реакцию с молекулой оксикислоты и т.д. В результате реакции поликонденсации образуются асфальтеновые кислоты, представляющие собой полимерные молекулы сложного строения. II) Углеводороды → Смолы → Асфальтены → Карбоиды 1) При окислении алкилароматических углеводородов образуются гидроперекиси, которые при распаде дают фенолы и кетоны. R1 R1 │ │ R2 – C - H + O2 → R2 – C – O – O –H → Ar – OH + R1 – C – R2 │ │ ║ Ar Ar O Образующиеся фенолы и кетоны вступают в реакции поликонденсации с образованием смол:   …Ar – OH + Ar-OH + Ar-OH … → Ar - O – Ar – O – Ar… + nH2O n 2) При термополиконденсации смол происходит образование асфальтенов. Превращение смол в асфальтены происходит при нагревании до 300—350 °С, при условии, что в нефтяном растворе содержится не менее 20—25% смол. Основная ячейка асфальтенов – поликонденсированные полиароматические слои, которые налагаются один на другой и соединяются посредством межмолекулярных связей, образуя межмолекулярные или внутримолекулярные ассоциации. Несколько таких ассоциаций могут образовывать агрегаты, или мицеллы, разных размеров. Схематическое строение асфальтенов:  Рисунок 2.1 Модели строения молекул смол и асфальтенов и их генетической связи. а) углеводороды; б) смолы; в) асфальтены; г) модель внутримолекулярной упаковки асфальтенов. 3) Карбоиды – это нерастворимая в органических растворителях часть твердых углеродистых веществ. Они имеют разный состав и разное происхождение. При длительном нагревании до 450оС и выше значительная часть асфальтенов путем дегидратации и уплотнения переходит в карбоиды. Механизм процесса Процесс окисления сырья до битума протекает по радикально цепному механизму и представляет собой гетерогенную реакцию между газовой и жидкой фазами. Кислород воздуха реагирует с водородом, содержащемся в сырье, образуя водяные пары. Потеря водорода сопровождается процессами уплотнения с образованием высокомолекулярных продуктов большой степени ароматичности - асфальтенов. В результате изменяется консистенция битума. Основная часть кислорода воздуха идет на образование воды, (10…20) % - на образование углекислого газа и лишь незначительная часть - на образование органических веществ, содержащих кислород. Основное количество кислорода, подаваемого на окисление, уносится с отходящими газами. Процесс окисления носит дегидрогенизационный характер. Количество химически связанного кислорода в окисленном битуме увеличивается с повышением содержания ароматических углеводородов в сырье - нефтяном остатке.  Рисунок 2.2 Механизм процесса окисления. 2.2. Кинетика и термодинамические характеристики основной реакции Модельной реакцией процесса является реакция окисления толуола с дальнейшим получением бензойной кислоты: 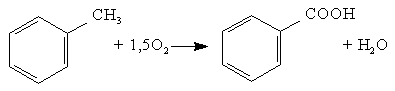 В результате термодинамического анализа основной реакции, можно сделать следующие выводы: Значение 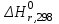 < 0, реакция протекает с выделением теплоты, процесс реакции – экзотермический. < 0, реакция протекает с выделением теплоты, процесс реакции – экзотермический.При повышении температуры величины константы равновесия уменьшаются, следовательно, есть тенденция смещения равновесия в сторону исходных веществ. При стандартных условиях свободная энергия Гиббса ∆G°298 < 0, химическая реакция в этих условиях протекает в прямом направлении. Самопроизвольное протекание реакции возможно при отрицательной энергии Гиббса. Т. к. ∆G°298 < 0 можно сделать вывод, что происходит самопроизвольное протекание реакции. Высокие значения константы равновесия реакции свидетельствуют о том, что реакция необратима. Процесс окисления сырья до битума представляет собой гетерогенную реакцию между газовой и жидкой фазами. Кислород воздуха реагирует с водородом, содержащемся в сырье, образуя водяные пары. Потеря водорода сопровождается процессами уплотнения с образованием высокомолекулярных продуктов большой степени ароматичности - асфальтенов. В результате изменяется консистенция битума. Основная часть кислорода воздуха идет на образование воды, (10…20) % - на образование углекислого газа и лишь незначительная часть - на образование органических веществ, содержащих кислород. Основное количество кислорода, подаваемого на окисление, уносится с отходящими газами. Процесс окисления носит дегидрогенизационный характер. 2.3. Влияние параметров процесса на получение битума Температура процесса Чем выше температура окисления, тем быстрее идет процесс. С повышением температуры окисления расход воздуха на окисление и доля кислорода в окисленном битуме снижаются, что объясняется ростом отношения углерод-углеродных связей к сложноэфирным и повышением эффективности передачи кислорода при увеличении температуры. Оптимальной является температура 265оС (538К). При температурах ниже и выше этой, вследствие усиления побочных реакций, потребление кислорода на образование сложноэфирных групп увеличивается и число межмолекулярных связей на 1 моль прореагировавшего кислорода невелико. С повышением температуры окисления увеличивается доля кислорода, идущего на образование воды. При температуре окисления более (275…300)оС наблюдается интенсивное образование карбенов и карбоидов, что вызывает повышение хрупкости и понижение пенетрации, растяжимости битумов. Повышение температуры размягчения битума в единицу времени возрастает с увеличением температуры окисления, причем это повышение зависит также от природы сырья. Чем выше содержание асфальто-смолистых веществ в нефти, тем больше скорость окисления. С повышением температуры процесса возрастает скорость дегидрирования молекул сырья и увеличивается доля кислорода, участвующего в образовании воды, понижается содержание кислорода и сложноэфирных групп, слабых кислот и фенолов в окисленном битуме. С повышением температуры окисления продолжительность окисления и суммарный расход воздуха снижаются, причем при температуре более 270оС степень использования кислорода воздуха понижается. Расход воздуха Увеличение расхода воздуха до определенного предела при прочих равных условиях ведет к пропорциональному повышению скорости окисления. Давление Повышение давления в зоне реакции способствует интенсификации процесса окисления и улучшению качества окисленных битумов. Тепловой эффект реакции окисления Процесс окисления сырья в битумы - экзотермический, количество выделяющегося при этом тепла зависит от химической природы сырья, глубины его окисления, и температуры, при которой оно было начато. Наибольшее количество тепла выделяется в начальный период, когда наблюдается резкое уменьшение количества бициклических ароматических соединений и значительное увеличение асфальтенов. Тепловой эффект окисления асфальта деасфальтизации ниже, чем гудронов. Поглощение кислорода, выход воды, образование легких органических продуктов и тепловой эффект по мере углубления процесса окисления изменяются и зависят от природы сырья. Тепловой эффект окисления для битумов одной и той же температуры размягчения увеличивается с понижением температуры процесса. |
