Курсовая работа_Проектирование магистрального газопровода. Курсовая работа_Проектирование магистрального газопровода (1). 2 Общие положения. Основные термины и понятия 1 Общие сведения о термодинамике Термодинамическая система
 Скачать 137.7 Kb. Скачать 137.7 Kb.
|
|
2.1. Общие положения. Основные термины и понятия 2.1.1. Общие сведения о термодинамике Термодинамическая система – представляет собой совокупность тел, способных энергетически взаимодействовать между собой и другими телами и обмениваться с ними веществом. Все, лежащее вне термодинамической системы, относится к окружающей среде. Термодинамическая система закрытая – система, в которой отсутствует обмен вещества с другими системами. Термодинамическая система открытая – система, в которой между ней и окружением имеют место материальные потоки. Термодинамическая система изолированная – система, которая не может обмениваться ни энергией, ни веществом с другими системами. Однородной называют термодинамическую систему, во всех частях которой свойства одинаковы. В противном случае – система неоднородна. Под равновесным понимают такое состояние, в которое приходит система при постоянных внешних условиях, характеризующихся неизменностью во времени термодинамических параметров и отсутствием в ней потоков вещества и теплоты. Под неравновесным понимают состояние системы, в которой отсутствует равновесие. Стационарным называется состояние термодинамической системы, при котором в результате постоянных внешних воздействий распределение значений параметров во всех ее частях остается неизменным во времени нормальные условия (н. у), характеризующиеся температурой tн = 0 °С, давлением pн = 101 333 Па (760 мм рт. ст). Иногда применяются стандартные условия, отличающиеся от н.у.: температура tс.у = 20 °С, давление рс.у = 735,6 мм рт. ст. Адиабатный процесс – равновесный процесс, в котором к термодинамической системе не подводится от окружающей среды (и не отводится в окружающую среду) теплота. Изобарный процесс – равновесный процесс, протекающий при постоянном давлении. Изотермический процесс – равновесный процесс, в течение которого температура системы сохраняется постоянной. Изохорный процесс – равновесный процесс, протекающий при постоянном объеме. 2.1.3. Параметры состояния Для того чтобы определить конкретные физические условия, при которых мы рассматриваем вещество, и тем самым однозначно определить состояние вещества, вводятся удобные характеристики состояния вещества – так называемые параметры состояния. Интенсивными называются свойства, не зависящие от количества вещества в системе (давление, температура и некоторые другие). Их можно измерить локально (они одинаковы в любой точке термодинамической системы). Свойства, зависящие от количества вещества, называются экстенсивными. Экстенсивные свойства могут быть измерены только для всей термодинамической системы в целом. Примером экстенсивных свойств является объем параметрами состояния являются абсолютная температура Т, абсолютное давление р и удельный объем v (или плотность) тела 2.1.4. Термодинамические параметры состояния Давление термодинамической системы (р) – термодинамический параметр, определяемый отношением силы, действующей на поверхность по нормали, к величине поверхности. 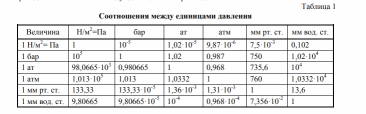 Чаще всего при измерении давления в качестве эталонных жидкостей используется ртуть, вода, этиловый спирт. Температура термодинамической системы (Т) – термодинамический параметр, пропорциональный кинетической энергии теплового движения термодинамической системы температура – это мера интенсивности теплового движения молекул. - Сегодня применяются различные температурные шкалы: Цельсия, Фаренгейта, Реомюра, Ранкина. По шкале Цельсия (t, °C) приняты следующие постоянные температурные точки: 0 °С – температура таяния льда, 100 °С – температура кипения воды при нормальном атмосферном давлении. - Фаренгейт предложил термометр, в качестве реперных точек которого приняты: 0 °F – температура смеси равных частей льда, поваренной соли и нашатыря; 212 °F – температура кипения воды при нормальном атмосферном давлении. В шкале Фаренгейта температура таяния льда равна +32 °F. Что представляет термодинамика, какие вопросы, задачи рассматриваются с ее помощью? Общая термодинамика разрабатывает методы, определения, математический аппарат безотносительно конкретного преобразования форм движения материи, их направленного приложения. Техническая термодинамика изучает применение законов термодинамики к процессам взаимного превращения теплоты и работы 2.4. Энергия 3. Что представляет собой тепловая энергия? Как она проявляется? Тепловая энергия – выражается в молекулярном и внутримолекулярном хаотическом движении, представляя собой энергию хаотического движения атомов и молекул вещества. Тепловая энергия газов проявляется в колебательном, вращательном и поступательных движениях молекул, которые постоянно меняют свою скорость по величине и направлению; 4. В каких формах происходит передача энергии в закрытых термодинамических системах? В закрытых термодинамических системах, рассматриваемых в термодинамике, передача энергии происходит только в двух возможных формах – в форме теплоты или в форме работы. 5. Что называют количеством теплоты, теплотой процесса? Количество энергии, переданной в форме хаотического (теплового) движения частиц, называют количеством теплоты, теплотой процесса, или теплотой Q. Теплота процесса – энергия, передаваемая одним телом другому при их взаимодействии, зависящая только от температуры этих тел и не связанная с переносом вещества от одного тела другому. 6. Положительными или отрицательными считают подводимую теплоту, работу? При этом подводимую теплоту считают положительной, а отводимую – отрицательной. В случае, когда работа передается к системе, ее принято считать отрицательной и использовать со знаком «–». Если же работа отводится от системы, ее считают положительной и используют со знаком «+» (тепловой двигатель). 7. Что называют работой процесса? Работа процесса – энергия, передаваемая одним телом другому при их взаимодействии, не зависящая от температуры этих тел и не связанная с переносом вещества от одного тела к другому. Работа не может содержаться в каком-либо теле, она возникает только тогда, когда появляется процесс превращения энергии. 8. Что называют работой расширения (сжатия), технической работой системы в термодинамическом процессе? Работа изменения объема (L, Дж) – работа сил давления при изменении объема системы в некотором термодинамическом процессе. Называют ее также термодеформационной работой, работой расширения или работой сжатия соответственно в процессах расширения и сжатия термодинамической системы 9. Как определяется работа расширения (сжатия), техническая работа системы в термодинамическом процессе? 10. Дайте определение теплоемкости. Поясните, от чего зависит теплоемкость Теплоемкость – величина, равная отношению сообщаемой телу или отводимой от него теплоты к соответствующему изменению его температуры: С= Q/ T С – теплоемкость; Q – подведенная (или отведенная) теплота; ΔТ – изменение температуры тела. теплоемкость зависит: 1) от физической природы вещества (для газа – от количества атомов); 2) для идеальных газов от их температуры, а для реальных газов и паров также и от их давления; 3) от способа подвода теплоты (от характера процесса), например, при p = const: р, средняя массоваямассовая изобарная теплоемкость ср, объемная изобарная теплоемкость с ср.теплоемкость при постоянном давлении 11. Что такое истинная теплоемкость, средняя теплоемкость? Средняя теплоемкость – среднее значение теплоемкости в заданном интервале температур, в пределах которых производится подвод или отвод теплоты Истинной называется теплоемкость при заданной температуре. Истинная теплоемкость определяется как производная от количества теплоты, подводимого к телу в процессе его нагрева по температуре этого тела : Cх dq/dt 12. Какие единицы измерения имеют массовая, объемная и мольная теплоемкости?  13. Как записывается уравнение Майера? R=Cp-Cv где R – работа расширения одного моля газа при р = const или универсальная газовая постоянная, Дж/(кг∙К). 14. Что больше: изобарная теплоемкость или изохорная. Почему? что бы нагреть газ на 1К при изохорном процессе нужно затратить меньше энергии чем при изобарном, отсюда теплоемкость при изобаре больше чем при изохорном процессе. 15. Как найти объемную теплоемкость, если известна соответствующая массовая? 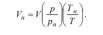 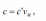  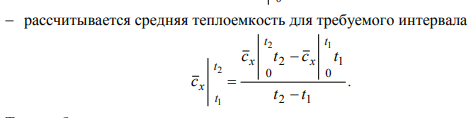 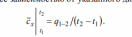 srednyaya tepl srednyaya tepl |
