34-36 химия. 34. Общая характеристика коррозии металлов и способы защиты от коррозии
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
34. Общая характеристика коррозии металлов и способы защиты от коррозии. Коррозия — это процесс самопроизвольного разрушения металлов и их сплавов под влиянием внешней среды. В результате коррозии ухудшаются многие свойства изделий: уменьшаются их прочность, пластичность, блеск, снижается электропроводность и т. д. Пример — кислородная коррозия железа в воде: Гидроксид железа Fe(OH)3 и является тем, что называют ржавчиной. Коррозионная стойкость металла зависит от его природы, характера среды и температуры. Благородные металлы не подвергаются коррозии из-за химической инертности. Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии. Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо. Различают химическую и электрохимическую коррозию.
3Fe + 2O2 = Fe3O4 При химической коррозии также возможны процессы: Fe + 2HCl → FeCl2+ H2 2Fe + 3Cl2→ 2FeCl3
(например, ржавление стали в морской воде). Под электрохимической коррозией подразумевают самопроизвольное разрушение металла вследствие электрохимического взаимодействия его с электролитом в виде водных растворов. В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе. При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
Анод: Fe –2e → Fe 2+ Катод: 2H+ + 2e → H2 Суммарная реакция: Fe + 2H+ → H2 + Fe2+ Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы: Анод: Fe –2e → Fe 2+ Катод: O2 + 2H2O + 4e → 4OH– Суммарная реакция: Fe 2+ + 2OH – → Fe(OH)2 4Fe(OH)2+ O2+ 2H2O → 4Fe(OH)3 (При этом образуется ржавчина.) Способы защиты от коррозии Промышленные методы: Пассивация. При выплавке стали в ее состав добавляют легирующие присадки, такие, как Cr, Mo, Nb, Ni. Они способствуют образованию на поверхности детали прочной и химически стойкой пленки окислов, препятствующей доступу агрессивных газов и жидкостей к железу. (Слово пассивация означает, что металл делается невосприимчивым к кислороду - становится пассивным). Защитное металлическое покрытие. На поверхность изделия наносят тонкий слой другого металлического элемента — Zn , Al, Co и др. Этот слой защищает железо о т ржавления. Электрозащита. Рядом с защищаемой деталью размещают пластины из другого металлического элемента или сплава, так называемые аноды. Токи в электролите текут через эти пластины, а не через деталь. Так защищают подводные детали морского транспорта и буровых платформ. Ингибиторы. Специальные вещества, замедляющие или вовсе останавливающие химические реакции. Защитное лакокрасочное покрытие. Термообработка. Бытовые: Бытовые методы защиты металлов от коррозии сводятся, как правило, к нанесению защитных лакокрасочных покрытий. Состав их может быть самый разнообразный, включая: силиконовые смолы; полимерные материалы; ингибиторы; мелкие металлические опилки. Отдельной группой стоят преобразователи ржавчины — составы, которые наносят на уже затронутые коррозией конструкции. Они восстанавливают железо из окислов и предотвращают повторную коррозию. Преобразователи делятся на следующие виды: Грунты. Наносятся на зачищенную поверхность, обладают высокой адгезией. Содержат в своем составе ингибирующие вещества, позволяют экономить финишную краску. Стабилизаторы. Преобразуют оксиды железа в другие вещества. Преобразователи оксидов железа в соли. Масла и смолы, обволакивающие частички ржавчины и нейтрализующие ее. Защита металла в бытовых условияхЧтобы надежно защитить металлические изделия от коррозии, следует выполнить следующую последовательность действий: очистить поверхность от ржавчины и старой краски с помощью проволочной щетки или абразивной бумаги; обезжирить поверхность; сразу же нанести слой грунта; после высыхания грунта нанести два слоя основной краски. 35. Способы выражения состава растворов. 1. Массовая доля – отношение (обычно процентное) массы растворенного вещества к массе раствора. Например, 15% (масс.) водный раствор NaCl на 100 единиц массы содержит 15 единиц массы NaCl и 85 единиц массы Н2О. 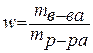 . .2. Мольная доля – отношение химического количества растворенного вещества (или растворителя) к сумме химических количеств всех веществ, составляющих раствор. В случае раствора одного вещества в другом мольная доля растворенного вещества (N2) равна  , ,а мольная доля растворителя (N1) 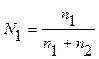 , ,где n1 и n2 – соответственно количество растворителя и растворенного вещества. 3. Молярная концентрация (молярность) – отношение химического количества растворенного вещества к объему раствора. Так, 2 М Н2SO4 означает раствор, в каждом литре которого содержится два моля серной кислоты, то есть См = 2 моль/дм3. 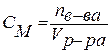 . .4. Моляльность (моляльная концентрация) – отношение химического количества растворенного вещества к массе растворителя. Так, для раствора H2SO4 запись m=2 моль/кг (Н2О) означает, что в этом растворе на каждый килограмм растворителя (воды) приходится два моля Н2SO4. Моляльность раствора в отличие от молярности не изменяется при изменении температуры. 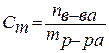 . .5. Нормальность (нормальная или эквивалентная концентрация) – отношение числа эквивалентов растворенного вещества к объему раствора. Концентрация, выраженная этим способом.Так, 2 н. Н2SO4 означает раствор, в каждом литре которого содержится 2 эквивалента Н2SO4, то есть 98 г Н2SO4. 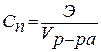 . .Эквивалент кислоты – это её количество, содержащее один эквивалент водорода, способного замещаться металлом. 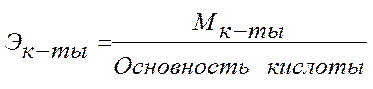 Эквивалент основания – это его количество, которые реагирует с эквивалентами кислот. 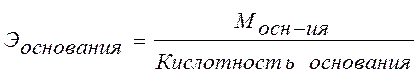 Эквивалент соли может быть вычислен как частное от деления ее молярной массы на произведение числа ионов металла и его валентности: 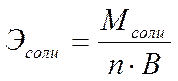 Пользуясь растворами, состав которых выражен нормальностью, легко рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка. Пусть V1 раствора вещества 1 с нормальностью N1 реагирует с V2 раствора вещества 2 с нормальностью N2. Это означает, что в реакцию вступило N1V1 эквивалентов вещества 1 и N2V2 эквивалентов вещества 2. Но вещества реагируют в эквивалентных количествах, следовательно N1V1 = N2V2 и 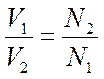 Т.е. объемы растворов реагирующих веществ обратно пропорциональны их нормальностям. 36. Водород. Особое положение в периодической системе. Свойства водорода. Гидриды и их классификации. Водород находится в 1-м периоде, I группе, главной (А) подгруппе. Химический знак водорода обычно проставляют и в VII группе. Это связано с тем, что ядро атома водорода представляет из себя протон (элементарную частицу), заряд его равен +1. Электронная оболочка имеет один уровень, на котором расположен один электрон. Водород, как и металлы I группы, легко окисляется. Валентность водорода равна I. В то же время водороду недостает только одного электрона, чтобы заполнить внешний электронный уровень (т.к. на I уровне может разместиться только 2 электрона). В этом он сходен с галогенами. Водород - простое вещество, как и галогены, является неметаллом. Поэтому химический знак водорода помещают также в VII группу. Молекула водорода состоит из двух атомов, связанных ковалентной неполярной связью. Водород – газ, без цвета и запаха, легче воздуха. Растворимость в воде очень мала. Химические свойства:   С оксидами металлов (используется для восстановления металлов): CuO + H2 → Cu + H2O Fe3O4 + 4H2 → 3Fe + 4Н2О с оксидом углерода (II): CO + 2H2 → CH3OH Синтез — газ (смесь водорода и угарного газа) имеет важное практическое значение, тк в зависимости от температуры, давления и катализатора образуются различные органические соединения, например НСНО, СН3ОН и другие. Ненасыщенные углеводороды реагируют с водородом, переходя в насыщенные: СnН2n + Н2 → СnН2n+2.  Гидриды и их классификации. Гидриды – это соединения элементов с водородом. Все гидриды можно разделить на четыре типа: три из которых образованы элементами главных подгрупп, а один – d элементами.  |
