Химия. 9. Химическая термодинамика. Изохорный тепловой эффект химической реакции. Внутренняя энергия
 Скачать 18.42 Kb. Скачать 18.42 Kb.
|
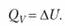 9.Химическая термодинамика. Изохорный тепловой эффект химической реакции. Внутренняя энергия 9.Химическая термодинамика. Изохорный тепловой эффект химической реакции. Внутренняя энергия Химическая термодинамика – это наука, которая применяет общие термодинамические соотношения к явлениям, в которых процессы обмена энергией сопровождаются изменениями химического состава вступающих в химическую реакцию тел. Тепловой эффект химической реакции – это количество теплоты, которое выделяется или поглощается в результате реакции между определенными количествами реагентов. Тепловой эффект химической реакции, протекающей при по стоянном объеме, называется изохорным тепловым эффектом Изохорный тепловой эффект реакции (про текающей при изохорно-изотермическом процессе) равен изменению внутренней энергии системы. Если процесс протекает в изохорных условиях (AV = 0), то работа расширения идеального газа отсутствует (pAV = 0). При этом теплота, поглощаемая системой, равна приросту внутренней энергии, т.е. вся теплота идет на нагревание системы: 10. Изобарный тепловой эффект химической реакции. Энтальпия. Стандартные энтальпии образования и сгорания химических веществ. Существуют такие процессы, в ходе протекания которых остаются неизменными только один или несколько параметров системы, а все остальные меняются. Так, процесс, протекающий при при постоянном давлении – изобарным. В изобарных процессах для поддержания давления постоянным приходится изменять объем системы, т.е. увеличивать или уменьшать ее размеры. Говоря другими словами – совершать работу, которая определяется по формуле: А = р · S·h= р ·V, где р – давление системы; ΔV – изменение объема системы (V2 – V1). Энтальпия (Н) - термодинамическая функция состояния химической системы, отвечающая тепловому (энергетическому) эффекту реакции в этой системе при постоянном давлении. Для вычисления величины стандартной энтальпии (теплового эффекта) реакции ∆Н0r используют следствие из закона Гесса: стандартная энтальпия (тепловой эффект) реакции ∆Н0r равна сумме стандартных энтальпий (теплот) образования продуктов реакции Σ∆Н0f(прод) за вычетом суммы стандартных энтальпий (теплот) образования исходных веществ Σ∆Н0f(исх) с учетом стехиометрических количеств всех веществ и их агрегатных состояний: ∆Н0r = Σ∆Н0f(прод) - Σ∆Н0f(исх) Стандартная энтальпия сгорания ΔHoсгор – тепловой эффект реакции сгорания одного моля вещества до образования высших оксидов. Для органических веществ –до CO2(г) и H2O(ж). Теплота сгорания негорючих веществ принимается равной нулю. Теплота сгорания топлива характеризует его теплотворную способность. Стандартная энтальпия образования вещества (ΔfH0) – увеличение или уменьшение энтальпии, сопровождающее образование 1 моль вещества из простых веществ, при условии, что все участники реакции находятся в стандартном состоянии Стандартная энтальпия сгорания вещества (ΔсH0) – уменьшение энтальпии при окислении в избытке кислорода 1 моль вещества, взятого в стандартном состоянии, до конечных продуктов окисления. В изобарном процессе тепловой эффект реакции равен изменению энтальпии системы. |
