химия. 92 В реакции сгорания газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 54,2 л no в пересчете на нормальные условия
 Скачать 51.54 Kb. Скачать 51.54 Kb.
|
|
№ 92 В реакции сгорания газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 54,2 л NO в пересчете на нормальные условия? 4NH3+5O2=4NO+6H2O Теплота сгорания: NH3=-46,19кДж H2O=-241,83кДж NO=90,37кДж. По закону Гесса: ∆H=4∙90,37+6∙(-241,83)-(4∙(-46,19)+5∙0)=-904,74кДж Так как теплота сгорания равна теплоте разложения с обратным знаком, то ∆H=904,74кДж - количество теплоты при образовании 4 моль продукта (4NO) 1моль продукта=22,4л., а из условия получено 54,2(2,42 моля),поэтому надо: ∆H = 904,74 / 2,42 = 373,86 кДж. Ответ: ∆H = 373,86 кДж. № 108 Используя значения стандартных теплоты и энтропии образования при стандартных условиях веществ, приведенных в реакции, вычислите 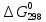 реакции: реакции: NH3(г) + HCl(г) = NH4Cl(к) ∆Hх.р. = -315,39 + 46,19 + 92,31 = -176,89 кДж ∆Sх.р. = 94,5 - 192,5 - 186,68 = -284,68 Дж/моль∙К ∆Gх.р. = -176,89 - 298∙(-284,68/1000) = -92,06 кДж Реакция может идти самопроизвольно при стандартных условиях, т.к. Gх.р. < 0. №171 При растворении 66,3 г некоторого неэлектролита в 500 г воды температура кристаллизации этого раствора составила –0,558°С. Определите мольную массу растворенного вещества. Криоскопическая константа 1,86. 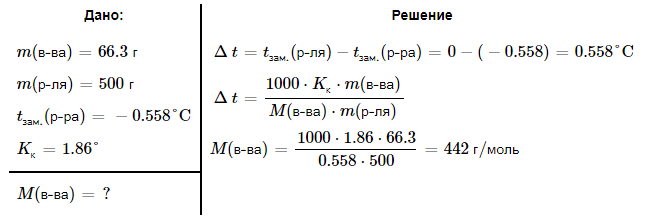 Ответ: М(в-ва)=442 г/моль №193 Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a)Na3PO4 и CaCl2; б)К2СО3 и ВаСl2; в) Zn(OH)2 и КОН. Молекулярные формы реакций: а) 2Na3PO4 + 3СаСI2 = Са3(РО4)2↓ + 6NaCl; б) К2CO3 + ВаСl2 = BaCO3↓ + 2KCl; в) Zn(OH)2 + 2КОН = K2[Zn(OH)4]. Отметим, что взаимодействие этих веществ возможно, ибо в результате реакций происходит связывание ионов с образованием осадков Са3(РО4)2 и BaCO3 соответственно в реакциях (а) и (б), а в реакции (в) ионы ОН- связываются с нерастворимым основанием Zn(OH)2 с образованием комплексного иона [Zn(OH)4]2-. Исключив одинаковые ионы из обеих частей равенств [а) Na+, Cl-; б) K+, Cl-; в) K+], получим ионно-молекулярные уравнения реакций: а) 2PO43- + 3Са2+ = Са3(РО4)2↓; б) CO32- + Ва2+ = BaCO3↓; в) Zn(OH)2 + 2ОН- = [Zn(OH)4]2-. №203 Какие из солей Al2(SO4)3, K2S, Pb(NO3)2, КСl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (>7<) имеют растворы этих солей? Гидролизу подвергаются соли: Аl2(SO4)3, K2S и Pb(NO3)2. Хлорид калия гидролизу не подвергается т. к. это соль сильного основания и сильной кислоты. Аl2(SO4)3 + 2HOH ⇄ 2AlOHSO4 + H2SO4 2Al3+ + 3SO42- + 2HOH ⇄ 2AlOH2+ + 2SO42- + 2H+ + SO42- Al3+ + HOH ⇄ AlOH2+ + H+ Раствор имеет pH < 7. K2S + HOH ⇄ KOH + KHS 2K+ + S2- + HOH ⇄ K+ + OH- + K+ + HS- S2- + HOH ⇄ OH- + HS- Раствор имеет pH > 7. Pb(NO3)2 + HOH ⇄ PbOHNO3 + HNO3 Pb2+ + 2NO3- + HOH ⇄ PbOH+ + NO3- + H+ + NO3- Pb2+ + HOH ⇄ PbOH+ + H+ Раствор имеет pH < 7. №224 Исходя из степени окисления фосфора в соединениях РН3, Н3РО4, H3PO3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: PbS+HNO3 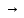 S+Pb(NO3)2+NO2+H2O S+Pb(NO3)2+NO2+H2OPH3 - проявляет только восстановительные свойства, т.к. фосфор имеет минимальную степень окисления -3, т.е. фосфор уже не в состоянии принимать электроны, а только может отдавать их. H3PO4 - проявляет только окислительные свойства, т.к. фосфор имеет максимальную степень окисления +5, т.е. фосфор уже не в состоянии отдавать электроны, а может только принимать их. H3PO3 - проявляет как окислительные, так и восстановительные свойства, т.к. фосфор имеет промежуточную степень окисления +3, т.е. фосфор может как принимать, так и отдавать электроны. PbS + 4HNO3 → S + Pb(NO3)2 + 2NO2 + 2H2O S2- - 2e → S0 | 2 | 1 N5+ + 1e → N4+ | 1 | 2 №252 Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+] = 0,02 моль/л, [Mg2+] = 0,03 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого, из ионов увеличить в одинаковое число раз? Е0Mg/Mg2+ = -2,36 В Е0Pb/Pb2+ = -0,13 В Схема гальванического элемента: А(-) Mg|Mg2+ || Zn2+|Zn (+)К А: Mg0 → Mg2+ + 2e К: Pb2+ + 2e → Pb0 EPb/Pb2+ = Е0Pb/Pb2+ + (0,059/n)∙lg[Pb2+] EMg/Mg2+ = Е0Mg/Mg2+ + (0,059/n)∙lg[Mg2+] ЭДС = EPb/Pb2+ - EMg/Mg2+ = Е0Pb/Pb2+ + 0,0295∙lg[Pb2+] - Е0Mg/Mg2+ - 0,0295∙lg[Mg2+] ЭДС = Е0Pb/Pb2+ - Е0Mg/Mg2+ + 0,0295∙lg([Pb2+]/[Mg2+]) = -0,13 + 2,36 + +0,0295∙lg(0,02/0,03) = 2,23 В Если концентрацию каждого из ионов увеличить в одинаковое число раз ЭДС гальванического элемента не изменится, т.к. исходные концентрации были равны, а значит выражение lg([Pb2+]/[Mg2+]), при равном увеличении и уменьшении концентраций солей, даст 0. №277 При электролизе растворов МgSО4 и ZnCl2, соединенных последовательно с источником тока, на одном из катодов выделилось 0,35 г водорода. Какая масса вещества выделится на другом катоде; на анодах? MgCl2 + 2H2O -электролиз→ Mg(OH)2 + H2 + Cl2 ZnSO4 + H2O -электролиз→ Zn + 1/2O2 + H2SO4 Суммарная реакция: MgCl2 + 3H2O + ZnSO4 = Mg(OH)2 + H2 + Cl2 + Zn + 1/2O2 + H2SO4 v(H2) = 0,35/2 = 0,175 моль На катоде: m(Zn) = v(Zn)∙M(Zn) = 0,175∙65,39 = 8,17 г На аноде: m(О2) = 0,175∙32/2 = 2,8 г; m(Cl2) = 0,175∙71 = 12,43 г. №283 Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов. Луженое железо в нейтральной среде: E(Fe2+/Fe) = -0,473 B E(Sn2+/Sn) = -0,14 B A: Fe - 2e → Fe2+ K: 1/2O2 + H2O + 2e → 2OH- Луженая медь в нейтральной среде: E(Cu2+/Cu) = 0,34 B E(Sn2+/Sn) = -0,14 B A: Sn - 2e → Sn2+ K: 1/2O2 + H2O + 2e → 2OH- №303 Составьте координационные формулы следующих комплексных соединений кобальта: СоС13∙6NH3, CoCl3∙5NH3, СоС13∙4NH3. Координационное число кобальта (III) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах. 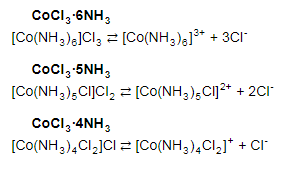 №332 Удельная электропроводность 0,05N уксусной кислоты ϰ= 3,24⋅10–4 Ом–1⋅см–1. Удельная электропроводность 0,0001 N уксуснокислого натрия ϰ = 7,75⋅10-6Ом-1⋅см-1. Подвижности ионов водорода 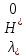 , и натрия , и натрия 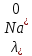 , соответственно равны 349,8 и 50,11 Ом–1⋅см2. Найти константу диссоциации КД уксусной кислоты, считая соль полностью диссоциированной. , соответственно равны 349,8 и 50,11 Ом–1⋅см2. Найти константу диссоциации КД уксусной кислоты, считая соль полностью диссоциированной. 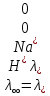 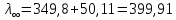 Ом–1⋅см2 Ом–1⋅см2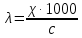 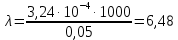 Ом–1⋅см2 Ом–1⋅см2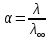 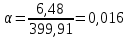 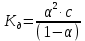 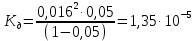 моль/л моль/лОтвет: 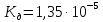 моль/л моль/л№343 Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 180 см3 воды, требуется 14,5 см3 0,08 н., раствора HCl. Ca(HCO3)2 + 2HCl → CaCl2 + CO2 + H2O Ж = Cн(HCl)∙V(HCl)/V(H2O) = 0,08∙0,0145/0,18 = 0,0064 г-экв = 6,4 мг-экв |
