Алкины. Ацетилен. Особенности его строения и его химические свойства
 Скачать 89.88 Kb. Скачать 89.88 Kb.
|
|
Оглавление Введение 1. Ацетилен. Особенности его строения и его химические свойства. 2. Реакции с ацетиленом и его использование в промышленности Заключение Список литературы Алкины. Ацетилен. Введение. Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие ттройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации. Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обусловливает кислотные свойства алкинов в реакциях замещения. Целью реферата является рассмотрение ацетилена, особенностей его строения, его химические свойства, реакции с ацетиленом и его использование в промышленности. Ацетилен. Особенности его строения и его химические свойства. Ацетилен — продукт неполного разложения метана. Этот процесс называют пиролизом. Теоретически ацетилен можно представить как продукт дегидрирования этилена:  На практике ацетилен, кроме пиролизного способа, очень часто получают из карбида кальция: 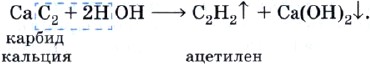 Особенность строения молекулы ацетилена состоит в том, что между атомами углерода имеется тройная связь, т. е. он является еще более непредельным соединением, чем этилен, молекула которого содержит двойную углерод-углеродную связь. Ацетилен является родоначальником гомологического ряда алкинов, или ацетиленовых углеводородов. Ацетилен — это бесцветный газ без запаха, малорастворимый в воде. Рассмотрим химические свойства ацетилена, которые лежат в основе его применения. Ацетилен на воздухе горит коптящим пламенем из-за высокого содержания углерода в его молекуле, поэтому для сжигания ацетилена используют кислород: Температура ацетиленокислородного пламени достигает 3200 °С. Таким пламенем можно резать и сваривать металлы. Реакции с ацетиленом и его использование в промышленности . Как и все непредельные соединения, ацетилен активно вступает в реакции присоединения. 1) галогенов (галогенирование), 2) водорода (гидрирование), 3) галогеноводородов (гидрогалогенирование), 4) воды (гидратация). Реакция гидрохлорирования — присоединения хлороводорода: 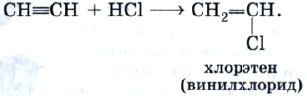 Продукт гидрохлорирования ацетилена называют винилхлоридом потому что одновалентный радикал этилена СН2=СН— называют винилом. Винилхлорид — это исходное соединение для получения полимера — поливинилхлорида, который находит широкое применение. В настоящее время винилхлорид получают не гидрохлорированием ацетилена, а другими способами. Поливинилхлорид получают с помощью уже знакомой вам реакции полимеризации. Полимеризация винилхлорида в поливинилхлорид может быть описана с помощью следующей схемы:  или уравнения реакции: 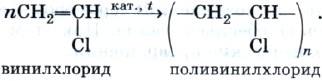 Реакция гидратации, протекающая в присутствии солей ртути, содержащих катион Hg2+, в качестве катализатора, носит имя выдающегося русского химика-органика М. Г. Кучерова и раньше широко использовалась для получения очень важного органического соединения — уксусного альдегида:  Реакцию присоединения брома — бромирование — используют как качественную реакцию на кратную (двойную или тройную) связь. При пропускании ацетилена (или этилена, или большинства других непредельных органических соединений) через бромную воду можно наблюдать ее обесцвечивание. При этом происходят следующие химические превращения: 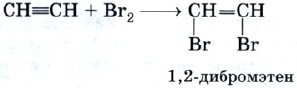 и далее: 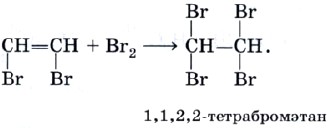 Еще одной качественной реакцией на ацетилен и непредельные органические соединения является обесцвечивание раствора перманганата калия. Ацетилен — важнейший продукт химической промышленности, который имеет широкое применение. В промышленности ацетилен получают гидролизом карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом и примесями других углеводородов. Карбидный метод позволяет получать очень чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз существенно менее энергозатратен, т.к. для нагрева реактора используется сгорание того же рабочего газа во внешнем контуре, но в газовом потоке продуктов концентрация самого ацетилена низка. Выделение и концентрирование индивидуального ацетилена в таком случае представляет сложную задачу. Экономические оценки обоих методов многочисленны, но противоречивы. Заключение. Таким образом мы узнали об особенностях строения молекулы ацетилена, химических свойствах ацетилена ,о реакциях ,в которые вступает ацетилен . Также Ацетилен используется в промышленности: для газовой сварки и резки металлов как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа, в производстве взрывчатых веществ (см. ацетилениды), для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов. для получения технического углерода в атомно-абсорбционной спектрофотометрии при пламенной атомизации в ракетных двигателях (вместе с аммиаком) Список литературы: 1.Википедия: https://ru.wikipedia.org/wiki/%D0%90%D1%86%D0%B5%D1%82%D0%B8%D0%BB%D0%B5%D0%BD 2. https://infourok.ru/referat-po-himii-na-temu-alkini-acetilen-3021226.html |
