Синтез этилацетата(2). Ацилирование спиртов I. Теоретические основы ацилирования спиртов. Техника выполнения, технологические особенности реакции этерификации
 Скачать 157 Kb. Скачать 157 Kb.
|
  АЦИЛИРОВАНИЕ СПИРТОВ I. Теоретические основы ацилирования спиртов. Техника выполнения, технологические особенности реакции этерификации. Ацилирование спиртов приводит к сложным эфирам. Основным методом получения последних является этерификация, то есть взаимодействие спиртов с кислотами. В случае использования карбоновых кислот образуются их сложные эфиры: 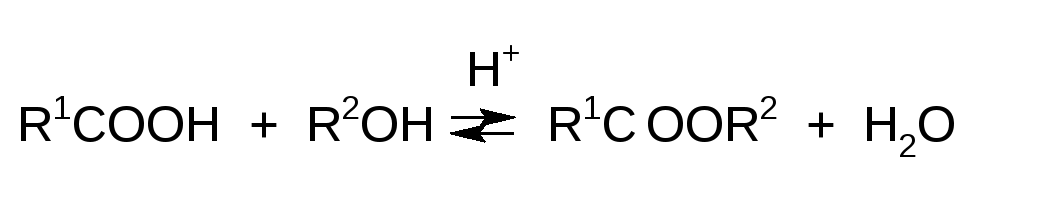 . .Этерификация является равновесным процессом. При использовании эквимольных количеств реагентов около 60 % их реагируют с образованием сложного эфира и воды; остальное количество кислоты и спирта остается неизменным, так как образующаяся вода вызывает гидролиз эфира (обратная реакция). В момент установления равновесия скорости прямой (этерификация) и обратной (гидролиз эфира) реакций выравниваются. Скорость обеих реакций возрастает при добавлении кислот и при повышении температуры. Однако, положение равновесия (следовательно, и выход эфира) при этом не изменяется. Сместить равновесие в сторону образования продукта можно, применяя избыток одного из реагентов – карбоновой кислоты или спирта, а также путем удаления из сферы реакции одного из продуктов (сложного эфира или воды). Обычно при реакции этерификации используют серную кислоту. Уже в малых количествах она действует каталитически: введенная в больших количествах она связывает образующуюся воду, что благоприятно влияет на выход эфира. Легче протекает этерификация первичных спиртов, несколько труднее – вторичных, труднее всего вступают в реакцию третичные спирты. В последнем случае реакция осложняется побочными реакциями дегидратации спирта или образования простых эфиров. В этих случаях используют другие схемы реакций, например, сложные эфиры получают либо действием серебряных или натриевых солей кислоты на галоидные алкилы (а), либо действием спиртов на хлорангидриды или ангидриды кислот (б), либо по реакции переэтерификации (г): 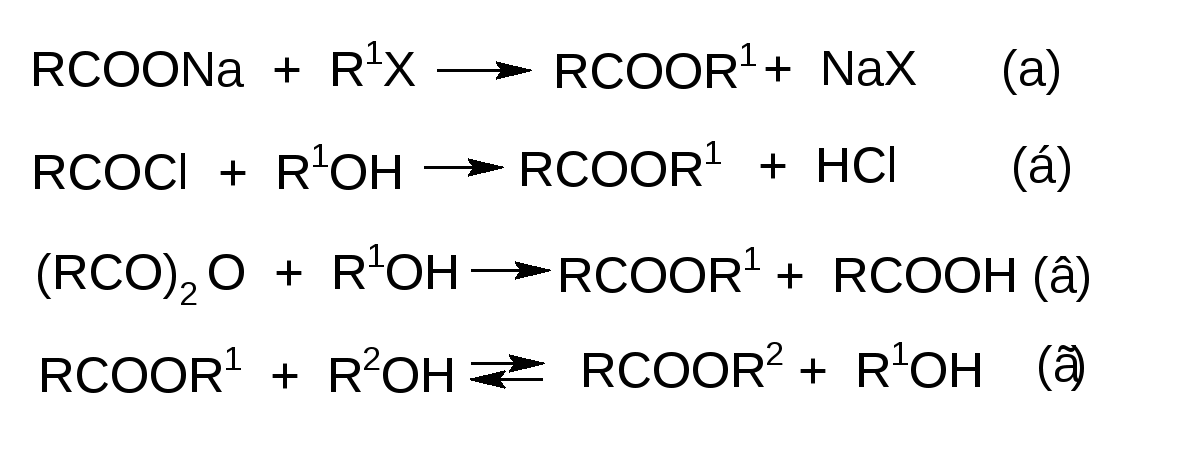 . .Сложные эфиры фенолов получают с использованием более активных ацилирующих агентов, чем сами карбоновые кислоты, а именно, применяют галогенангидриды (б) и ангидриды (в) карбоновых кислот. Обмен алкильного радикала в молекуле сложного эфира, т.е. переэтерификация (г), главным образом, используется для получения эфиров малостойких кислот, например, эфиров ацетоуксусной кислоты, а также для синтезов эфиров спиртов с более высоким молекулярным весом. Принципиальным является вопрос отщепления водорода и гидроксила из реагирующих веществ, который был разрешен методом изотопной метки. При использовании спирта с меченным O18, последний оказался в сложном эфире: Это свидетельствует о том, что водород отщепляется от спирта, а не от карбоновой кислоты, хотя последняя по кислотным свойствам значительно превосходит спирт (СН3СООН, рК 4,3; С2Н5ОН, рК 18). Все дело в кислотном катализе этерификации. Из механизма кислотного катализа видно, что спирт проявляет основные, а не кислотные свойства. Ниже приводятся структуры n-орбиталей кислорода в карбоксильной и гидроксильной группах: 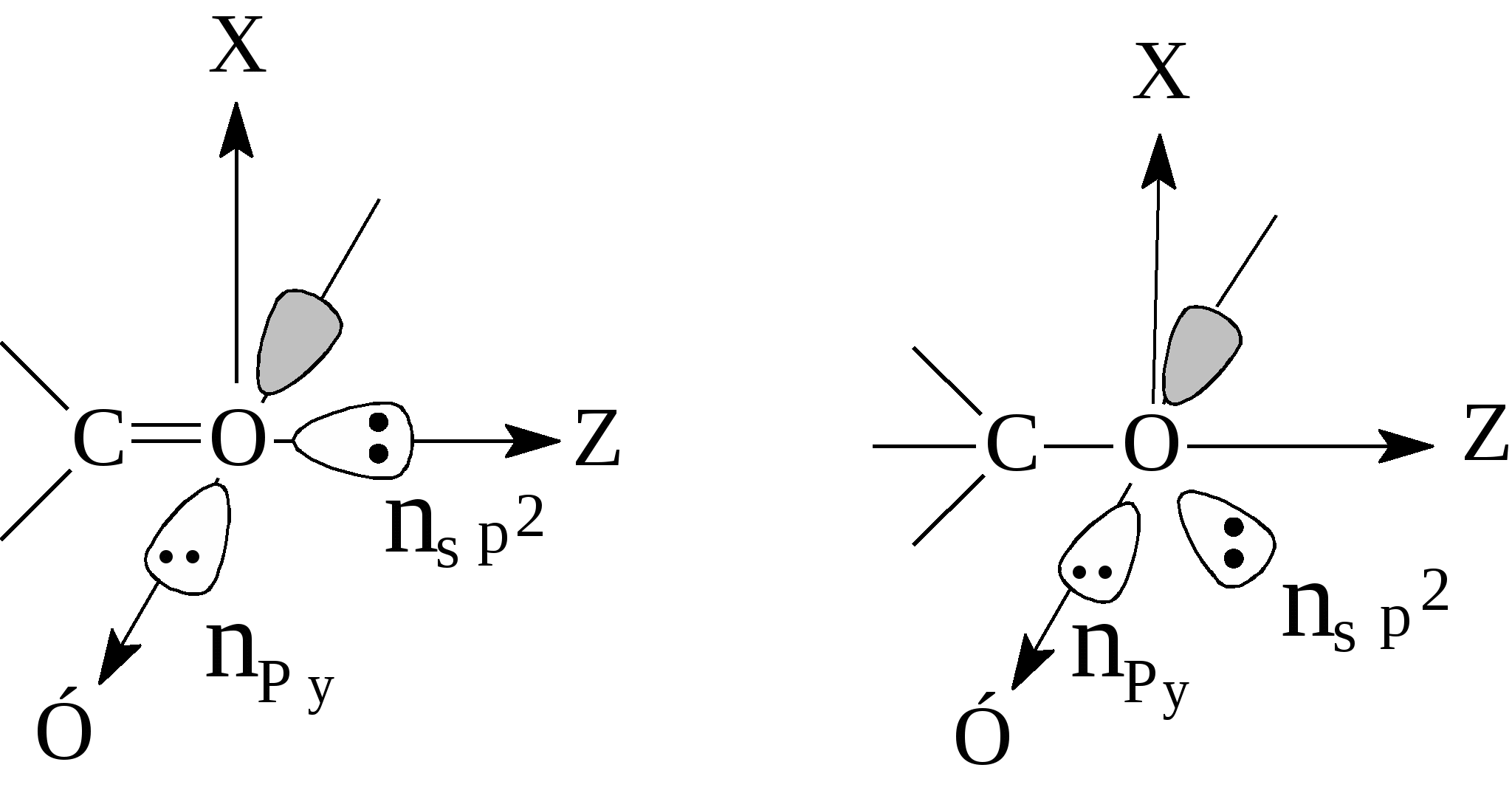 . .npy–орбитали в карбоксильной и гидроксильной группах являются ВЗМО. Потенциалы ионизации электронов этих орбиталей для кислот и спиртов 10,84 и 10,94 ЭВ, соответственно. Значения довольно близкие, но npy–орбиталь в карбоксильной группе является более электронодонорной и поэтому происходит протонирование кислорода этой группы: 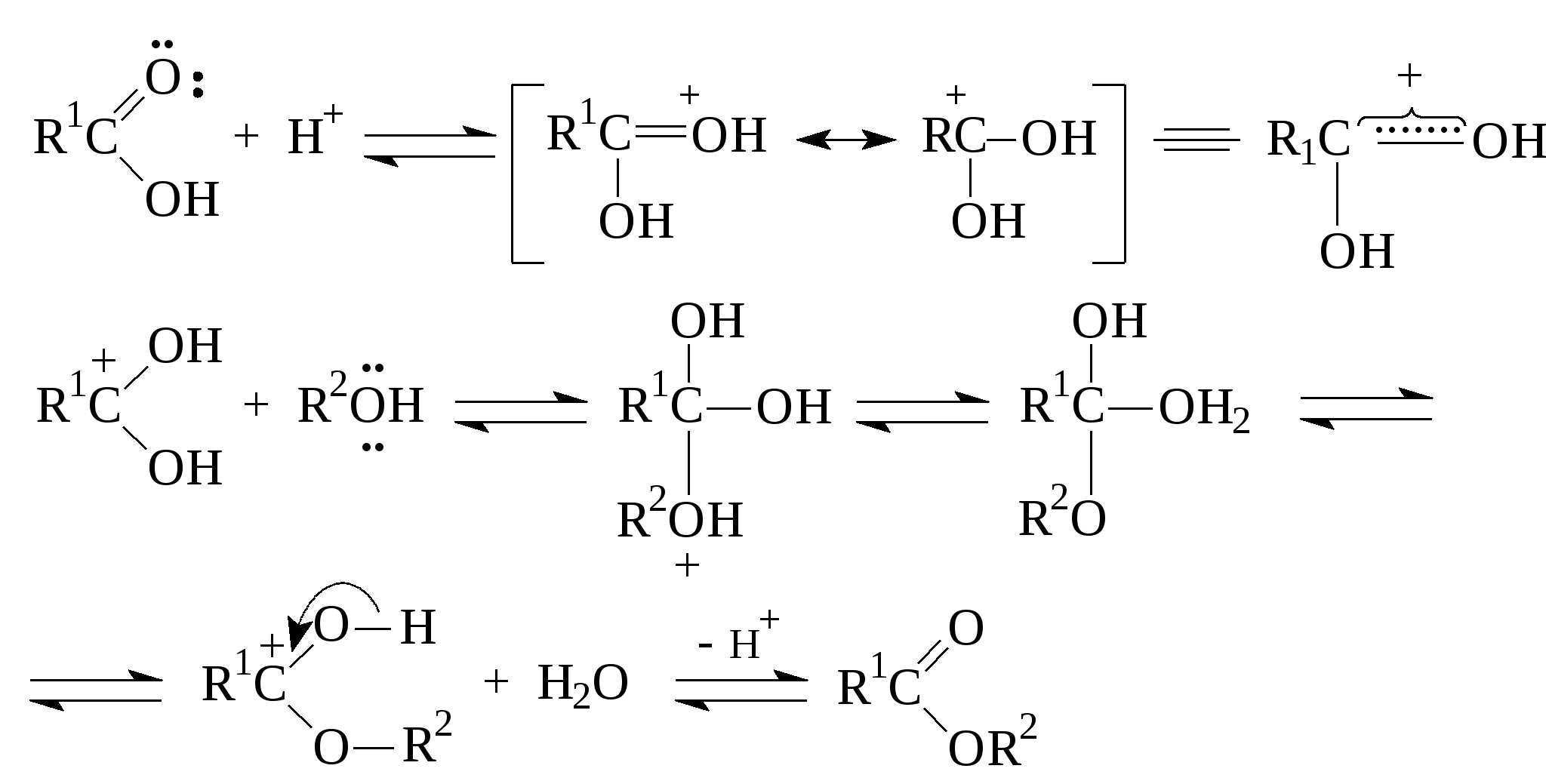 . .Механизм для ацилирования ангидридами карбоновых кислот: 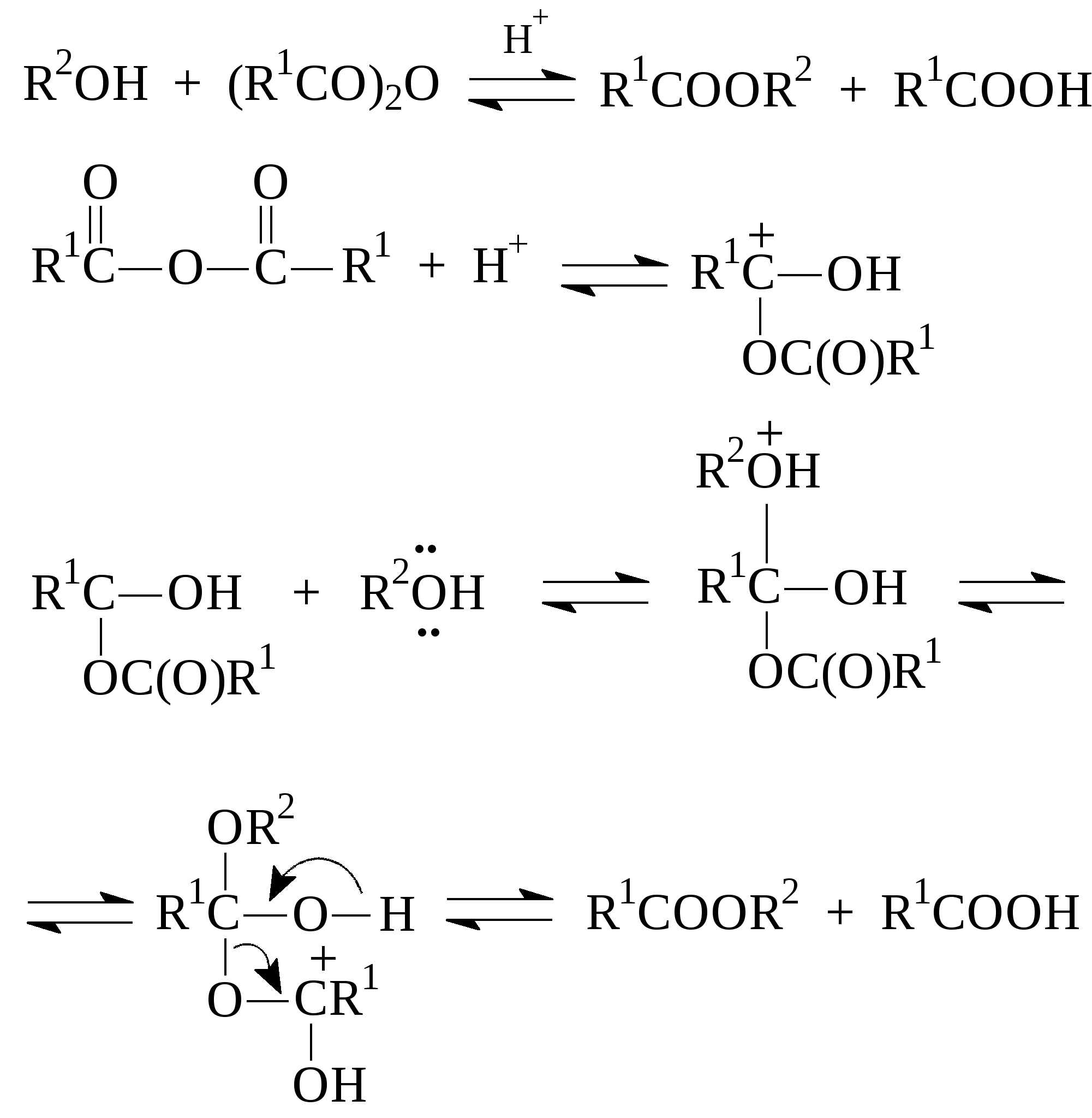 . .Существенное влияние на скорость реакции этерификации оказывают пространственные факторы. С ростом объема алкильных остатков, связанных с карбоксильной группой, и с увеличением объема радикала в этерифицирующем спирте скорость реакции понижается. СИНТЕЗ ЭТИЛАЦЕТАТА II. Учебные вопросы
III. Уравнения реакций Основная реакция: 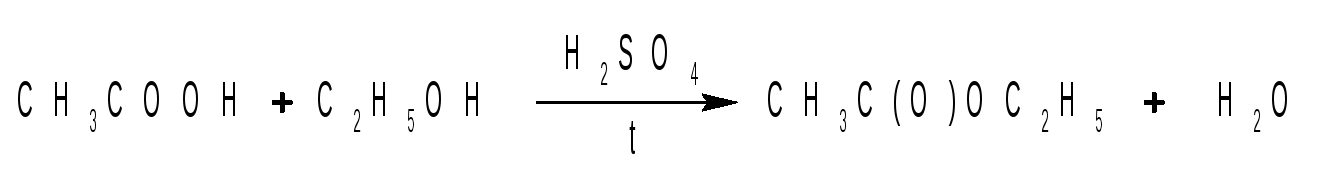 . .Побочная реакция: IV. Реактивы:
V. Таблица физико-химических констант исходных веществи полученных соединений
VI. Составление расчетной таблицы
VII. Схемы приборов и установок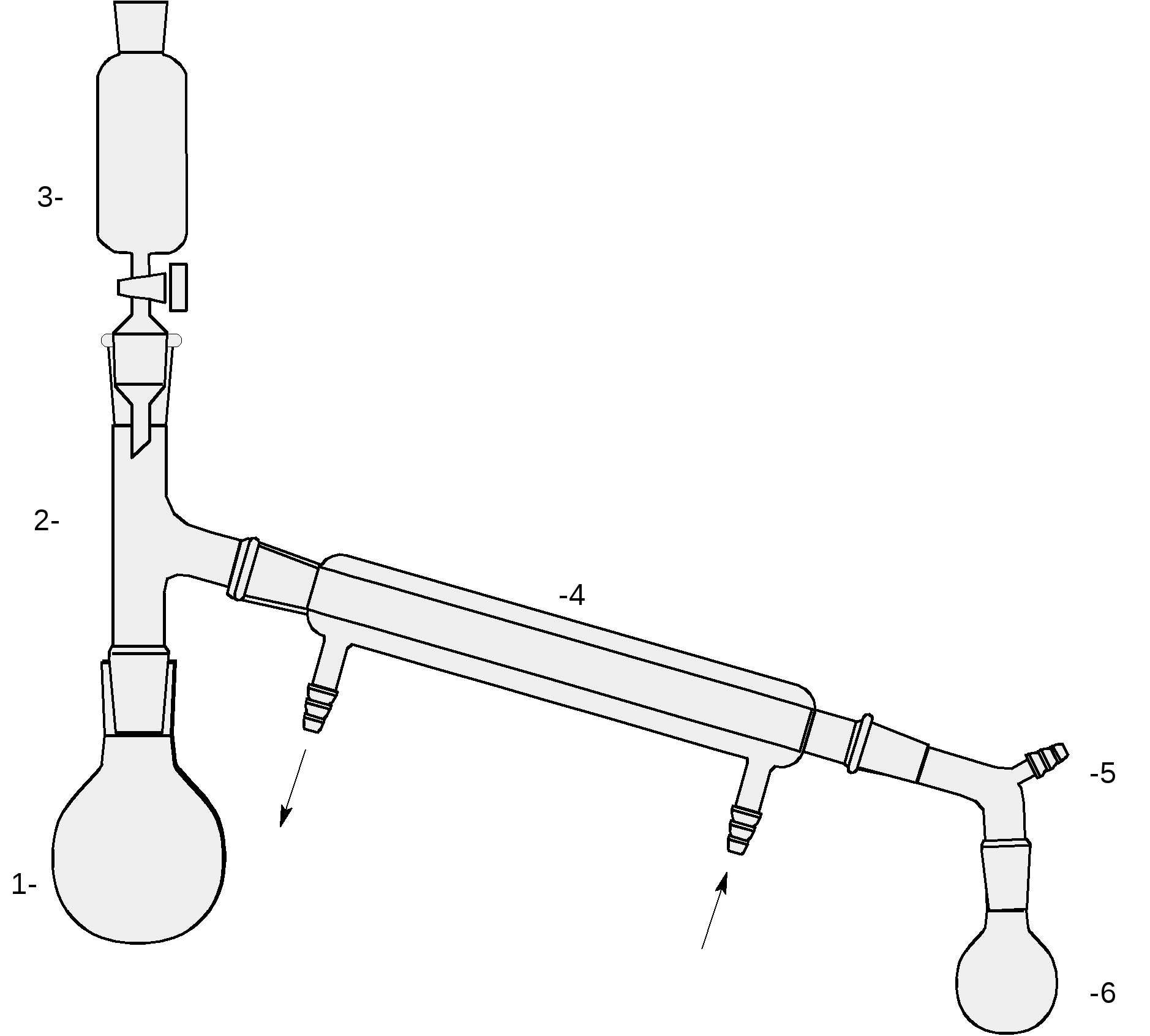 Рис.1. Прибор для синтеза этилацетата: 1- реакционная колба, 2-насадка Вюрца, 3-капельная воронка, 4-холодильник, 5-аллонж, 6-приемник. 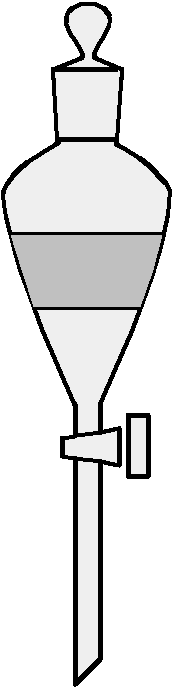 Рис. 2. Делительная воронка. 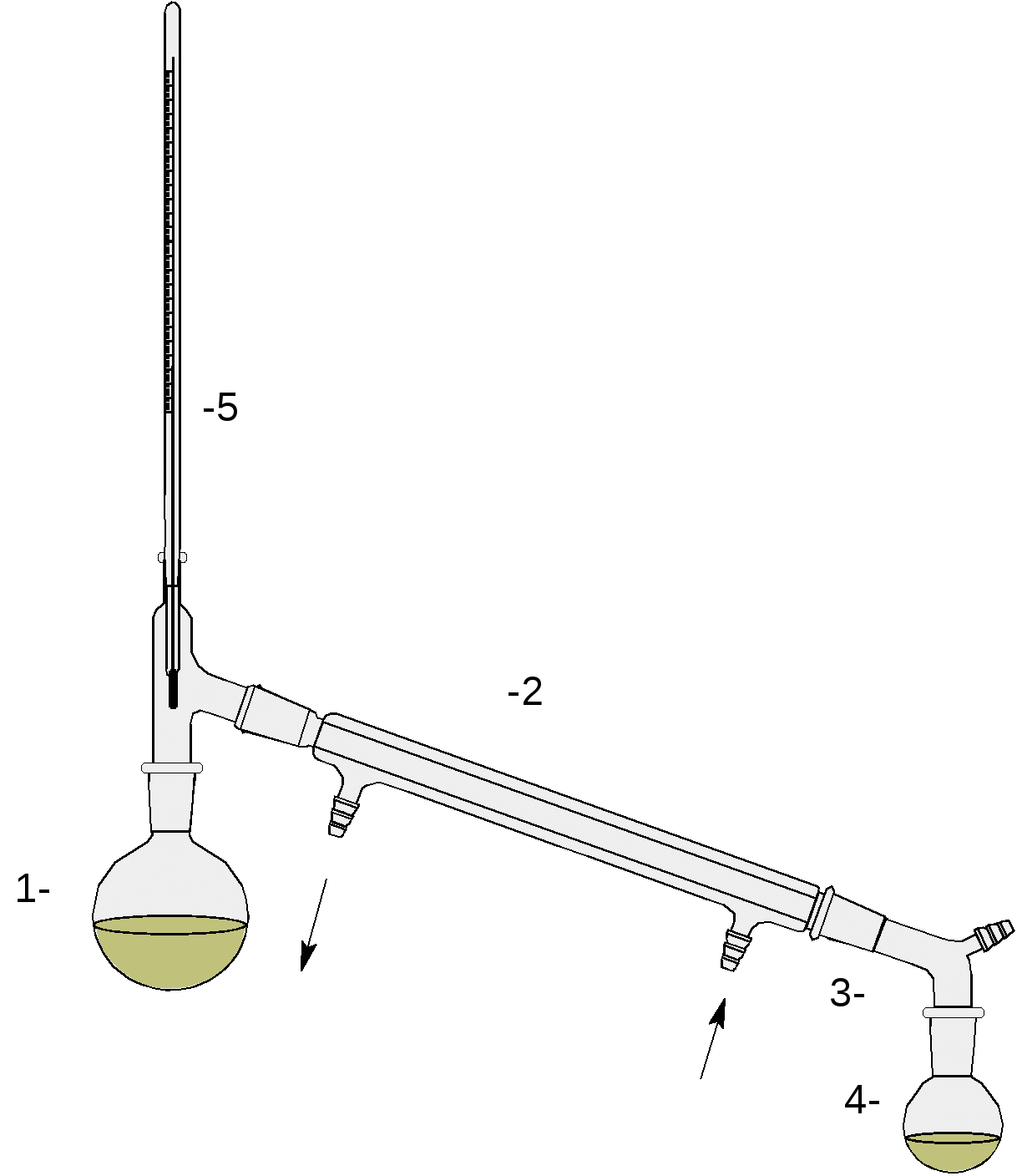 Рис.3. Прибор для простой перегонки: 1- перегонная колба с насадкой Вюрца, 2-холодильник, 3-аллонж, 4-приемник. VIII. Примечания и меры предосторожности
IX. Методика проведения синтеза Собирают установку по рис. 1. В реакционную колбу объемом 100-200 мл помещают 6 г этанола и осторожно при перемешивании приливают 10 г серной кислоты. Колбу присоединяют к холодильнику, сверху помещают капельную воронку, в которую наливают смесь 10 г спирта и 15 г уксусной кислоты. Реакционную колбу нагревают на масляной бане до 1400С. Когда температура в бане достигнет 1400С, из капельной воронки начинают прикапывание смеси спирта и уксусной кислоты. Через некоторое время начинается отгонка образующегося эфира. Прикапывание ведут такой же скоростью, с какой отгоняется эфир. После окончания прикапывания реакционную смесь кипятят еще 10 минут. X. Выделение полученного продукта Приемник с этилацетатом снимают с установки. К получившемуся дистилляту прибавляют 10 мл воды и небольшими порциями при взбалтывании добавляют соду до нейтральной реакции на лакмус. Эфирный слой отделяют от водного с помощью делительной воронки (рис.2). Для освобождения от примеси спирта прибавляют 10 мл 50%-ного раствора хлористого кальция. Смесь взбалтывают, эфир отделяют с помощью делительной воронки, переносят в сухую колбу и сушат прокаленным хлористым кальцием. XI. Очистка полученного продукта Высушенный эфир перегоняют (рис.3) на водяной бане. Собирают в качестве основной фракцию в интервале 75-780С. XII. Вопросы по теоретическим основам работы 1. Дайте определение реакции ацилирования. 2. Какие ацилирующие реагенты Вы знаете? 3. Какие факторы влияют на скорость прямой (этерификация) и обратной (гидролиз эфира) реакций. Какие приемы следует использовать для смещения равновесия в сторону образования продукта? 4. Как меняется скорость реакции этерификации при изменении условий проведения реакции (температура, избыток одного из реагентов, катализатор и его концентрация, удаление одного из продуктов реакции)? 5. Как скорость реакции этерификации зависит от строения спирта и кислоты? 6. Какая роль отводится серной кислоте в данном синтезе? 7. Какие схемы получения сложных эфиров Вам известны? Укажите области возможного их применения. 8. Как получить сложный эфир фенола? 9. Почему при ацилировании фенолов используют щелочь? 10. Приведите схему механизма этерификации свободных карбоновых кислот спиртами. 11. Какие примеси содержит продукт реакции этерификации спиртов? 12. Напишите реакцию ацилирования целлюлозы уксусным ангидридом (используется в производстве ацетатного волокна). 13. Напишите реакцию переэтерификации диметилтерефталата этиленгликолем (используется в производстве полиэфирного волокна – лавсана). |
