Лекция анионы 7-8 группы. Анионы iiii аналитических групп Классификация анионов Общая характеристика анионов
 Скачать 55.28 Kb. Скачать 55.28 Kb.
|
|
Анионы I-III аналитических групп Классификация анионов Общая характеристика анионов: В зависимости от способности образовывать не растворимые в воде осадки солей бария и серебра все анионы делятся на три группы. К I аналитической группе анионов относятся:SO32-; SO42-; СО32-; РО43-; S2O32-; CrO42-; C2O42-; B4O72-; BO2-; (сульфит-, сульфат-, карбонат-, фосфат-, тиосульфат-, хромат-, оксалат-, борат-, метаборат - ионы). Бариевые соли анионов I группы не растворимы в воде, но растворимы в кислотах, за исключением сульфата бария, серебряные соли анионов в I группы не растворимы в воде. Групповым реактивом I группы является хлорид бария. Все анионы I группы в растворе бесцветны, кроме хромат- иона, имеющего желтую окраску. Ко II аналитической группе анионов относятся: Cl-; Br; I -; SCN-; (хлорид-, бромид-, иодид-, роданид- ионы). Бариевые соли анионов II группы растворимы в воде, а серебряные соли не растворимы в воде и азотной кислоте. Групповым реактивом данной группы является нитрат серебра в присутствии азотной кислоты. Все анионы II группы в растворе бесцветны. К III аналитической группе анионов относятся: NO3-; NO2-; CH3COO-; (нитрат-, нитрит-, ацетат- ионы). Группового реактива не имеют, т.к. соли бария, серебра анионов III группы бесцветны. Анионы I АГ: Реакции сульфат - ионов.(SO42- )  а) С солями Ва образуется белый осадок сульфата бария, не растворимый в кислотах и щелочах (ГФ). Na2SO4 + BaCl2 = BaSO4 + 2NaCl б) С ацетатом свинца (ГФ) образуется белый осадок сульфата свинца растворимый в едких щелочах.  Na2SO4 + (CH3COO)2Pb = 2CH3COONa + PbSO4 PbSO4 + 4NaOH = Na2PbO2 +Na2SO4 + 2 H2O Реакции сульфит - ионов.(SO32- ) Эти ионы окисляются до сульфат ионов и поэтому являются сильными восстановителями. а) С солями Ва2+ образуется белый осадок сульфита бария, растворимый в азотной кислоте.  Na2SO3 +BaCl2 = BaSO3 +2NaCl BaSO3 + 2HNO3 = Ba(NO3)2 + SO2 + H2O б) Обесцвечивание раствора йода. Na2SO3 +I20 +H2O = Na2SO4 +2HI SO32- + H2O – 2e = 2H+ +SO42- I20 + 2e = 2I- в) Обесцвечивание раствора фуксина (ГФ). Реакции тиосульфат - ионов.(S2O32-): а) При взаимодействии с кислотами (ГФ) раствор мутнеет, затем желтеет вследствие выпадения серы.     Na2S2O3 +2HCl =2NaCl +S +SO2 +H2O S2O32- +2H+ = S +SO2 + H2O  б) С солями бария выпадает белый осадок тиосульфата бария, затем желтеет. Осадок растворяется в кислотах с выделением серы. Na2S2O3 + BaCl2 = BaS2O3 + 2 NaCl в) С нитратом серебра (ГФ) образуется белый осадок тиосульфата серебра, который быстро желтеет, краснеет, буреет и чернеет, вследствие образования сульфида серебра.  Na2S2O3 +2 AgNO3 = Ag2S2O3 + 2 NaNO3  Ag2S2O3 + H2O = Ag2S + H2SO4 г) Обесцвечивание раствора йода. 2Na2S2О3 + I2 = Na2S4O6 +2NaI I20 + 2e = 2I 2S2O2- – 2e = S4O6 2- тетратионат - ион Реакции карбонат – ионов.(CO32-): а) С солями Ва2+ выпадает белый осадок карбоната натрия, растворимый с выделением углекислого газа.   Na2CO3 +BaCl2 = BaCO3 +2NaCl BaCO3 + 2HCl = BaCl2 +CO2 + H2O  б) При взаимодействии с кислотами (ГФ) выделяется углекислый газ, при пропускании которого через известковую воду происходит помутнение, вследствие выпадения осадка карбоната кальция. Na2CO3 + 2HCl = 2 NaCl + CO2 + H2O 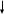 Ca(ОН)2 + CO2 = CaCO3 +H2O Реакции фосфат- ионов.(PO43-) а) С солями Ва2+ выпадает осадок гидрофосфата бария растворимый в азотной кислоте. 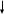 Na2HPO4 +BaCl2 = BaHPO4 + 2NaCl б) С магнезиальной смесью (ГФ) выпадает белый осадок фосфата магния аммония. 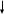 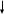 Na2HPO4 + MgCl2 + NH4OH = MgNH4PO4 + 2 NaCl + H2O HPO42- +Mg2+ + NH4OH = MgNH4PO4 + H2O в) С молибденовой жидкостью (ГФ) (раствор молибдата аммония в азотной кислоте). При сливании равных объёмов реактива и гидрофосфата натрия, при нагревании образуется жёлтый кристаллический осадок. Реакции борат – ионов. (В4О72-): а) С солями Ва2+ выпадает белый осадок метабората бария. К раствору борной кислоты добавляем гидроксид аммония и хлорид бария. 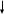 1. H3BO3 + NH4OH = NH4BO2 + 2H2O 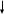 2. 2NH4BO2 + BaCl2 = 2NH4Cl + Ba(BO2)2 3. BaCl2 + Na2B4O7 = Ba(BO2)2 + 2NaCl + 2H3BO3 б) Образование и горение борно-этилового эфира (ГФ). В фарфоровую чашечку помещаем борную кислоту, этиловый спирт и поджигаем, пламя окрашивается в зеленый цвет. / O - H / O – C2H5 B – O - H + 3C2H5OH = B – O – C2H5 + 3 H2O \ O - H \ O – C2H5 борноэтиловый эфир в) С куркумовой бумажкой (ГФ) . Бумажку смачиваем раствором борной кислоты. Розовеет. Смачиваем щелочью - появляется грязно-синее или серо - черное окрашивание. Реакции оксалат – ионов. а) Реакция с солями бария, образуется белый осадок оксалат бария, растворимый в растворах кислот: хлороводородной и уксусной. Na2C2O4 +BaCl2 = BaC2O4 +2NaCl BaC2O4 + 2HCl = BaCl2 + Н2C2O4 б) Реакция с солями кальция (ГФ) , образуется белый осадок оксалат кальция, растворимый в растворах кислот: хлороводородной и уксусной. Na2C2O4 +СaCl2 = СaC2O4 +2NaCl СaC2O4 + 2HCl = СaCl2 + Н2C2O4 в) Реакция взаимодействия с перманганатом калия, происходит обесцвечивание раствора KMnO4. Легче реакция идет при нагревании. 5Н2C2O4 + 2KMnO4 + 3H2SO4 = 10СО2 + 2MnSO4 + K2SO4 + 8H2O 2 | (MnO4) - + 8H + + 5e = Mn 2+ + 4H2O 5 | C2O4- – 2e = 2 CO2 Реакции хромат – ионов. а) Реакция с солями бария (ГФ), образуется желтый осадок хромат бария, растворимый в хлороводородной кислоте. Na2CrO4 +BaCl2 = BaCrO4 +2NaCl BaCrO4 + 2HCl = BaCl2 + Н2CrO4 б) Реакция с солями серебра, образуется осадок хромат серебра кирпично – красного цвета. Na2CrO4 +2 AgNO3 = Ag2CrO4 +2 NaNO3 в) Реакция солями свинца, образуется осадок хромат свинца желтого цвета. Na2CrO4 + PbNO3 = PbCrO4 +2 NaNO3 Анионы II АГ. Реакции хлорид-ионов Действием нитрата серебра (ГФ), гидроксида аммония и азотной кислоты. При действии на хлориды нитратом серебра выпадает белый осадок хлорида серебра, растворимый в гидроксиде аммония с образованием комплексной соли – хлорида диамминсеребра I. При добавлении азотной кислоты, вновь выпадает белый осадок хлорида серебра. 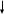 HCl + AgNO3 = AgCl + HNO3 AgCl + 2NH4OH = [Ag (NH3)2]Cl + 2H2O 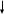 [Ag (NH3)2]Cl + 2HNO3 = AgCl + 2NH4NO3 [Ag (NH3)2]Cl + 2HNO3 = AgCl + 2NH4NO3 2.Реакции бромид – ионов  а) С нитратом серебра выпадает бледно – желтый осадок бромида серебра. KBr + AgNO3 = AgBr +KNO3 б) С окислителями KMnO4; хлораммином (ГФ) и HCl; MnO и т.д. Реакция идет в кислой среде, в присутствии хлороформа или бензола. Слой органического растворителя окрашивается в желто-бурый цвет. 10KBr + 2KMnO4 + 8H2SO4 = 5Br2 + 2MnSO4 + 6K2SO4 + 8H2O 5 | 2Br - – 2e = Br20 2 | (MnO4) - + 8H + + 5e = Mn 2+ + 4H2O Хлорамин + НС1 → С12 2 NaBr + С12 → Br2 +2 NaC1 3.Реакция йодид – ионов а) С нитратом серебра выпадает желтый осадок йодида серебра.  KI + AgNO3 = AgI + KNO3 б) С солями свинца (ГФ) выпадает желтый осадок йодида свинца.  2KI + (CH3COO)2Pb = PbI2 + 2CH3COOK в) С окислителями (KMnO4, FeCl3 - ГФ) в серно – кислой среде в присутствии хлороформа или бензола, слой органического растворителя окрашивается в фиолетовый цвет. 10KI + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O 5 | 2I - – 2e = I20 2 | (MnO4) - + 8H + + 5e = Mn 2+ + 4H2O 2Fe+3Cl3 + 2КI- → 2FeCl2 + 2KCl + I2 Fe+3 + e → Fe+2 | | 2 2I- - 2e → I02 | 2 | 1 4.Реакцияроданид – ионов а) С нитратом серебра выпадает белый осадок роданида серебра.  NH4SCN + AgNO3 = AgSCN + NH4NO3 б) С хлоридом железа III (ГФ) - раствор окрашивается в кроваво – красный цвет за счет образования роданида железа III 3NH4SCN + FeCl3 = Fe(SCN)3 + 3NH4Cl Анионы III АГ. Реакция нитрат – ионов Реакция с дифениламином (ДФА) - ГФ. 1% р-р ДФА в концентрированной серной кислоте, проводится в фарфоровой чашке. Смесь окрашивается в синий цвет. Реакции ацетат – ионов а) С кислотами выделяется уксусная кислота, обладающая характерным запахом. 2CH3COONa + H2SO4 = 2CH3COOH + Na2SO4 б) С хлоридом железа III (ГФ) раствор окрашивается в красно – бурый цвет, вследствие образования ацетата железа III 3CH3COONa + FeCl3 = (СH3COO)3Fe + 3NaCl Реакции нитрит – ионов а) С кислотами выделяется оксид азота бурого цвета.   2KNO2 + H2SO4 = K2SO4 + 2HNO2 2HNO2 = NO2 + NO + H2O б) С антипирином (ГФ), образуется нитрозоантипирин, изумрудно- зеленого цвета. NaNO2+ Ant +HC1 → Ant-N=O + NaC1+ H2O |
