уцацуа. Б. 1 Термодинамическая система
 Скачать 70.07 Kb. Скачать 70.07 Kb.
|
|
Б.1 Термодинамическая система - это тело или группа тел, находящихся во взаимодействии и отделенных от окружающей среды границей раздела. Система может быть: гомогенная - это однородная система, между отдельными частями которой нет поверхностей раздела. Гетерогенная - состоит из различных по свойствам частей, между которыми существует граница раздела. По отношению к окружающей среде системы могут быть: изолированные - не обмениваются с окружающей средой ни массой, ни энергией (в форме теплоты или работы) и имеют постоянный объем; закрытые - обмениваются с окружающей средой энергией, но не обмениваются массой; открытые - обмениваются с окружающей средой и массой, и энергией. Параметры системы – это величины, характеризующие состояние системы. Реальная система обладает большим числом параметров. Параметры делятся на: экстенсивные (емкостные), количественно пропорциональны массе. К таким параметрам относятся объем(V),масса(m),вн.энерг(U),энтальпия(H) и др.; интенсивные, не зависят от массы, а определяются специфической природой системы. Это давл(Р),темп.(Т),хим.потенциал() и др. Параметры, которые измеряются непосредственно и выражают интенсивные свойства системы, называются термодинамическими параметрами. Экстенсивный параметр станет интенсивным, если он будет отнесен к единице количества вещества. Например, масса и объем - экстенсивные параметры, а плотность и удельный объем - интенсивные свойства в-ва или системы. Б.2 Система-тело или группа взаимодействующих тел условно выделенных в пространстве. Часть пространства- это окружающая среда или простая среда. Гомогенные системы состоят из одной фаза(газ,жидкость,твёрдые), а гетерогенные из разных фаз, у них существует границы раздела (твёрдое вещество и жидкое). Фаза- это совокупность гомогенных частей гетерогенной системы, одинаковых по физ. и хим. св-вам, отделенная от других частей системы видимыми поверхностями раздела. Системы могут быть открытые, закрытые и изолированные Параметры системы – это величины, хар-ющие состояние системы. Делятся на экстенсивные, интенсивные, Функции процесса- это функции связанные с процессом. Не являются функциями системы. Величина будет зависит от вида процесса. Функция состояния системы зависит только от состояния системы и не зависит от пути по которому эта система получена. Теплота - это способ передачи энергии от одной части системы к другой через хаотическое движение молекул. Т связана с процессом, она зависит от пути процесса. Т, полученную системой от окружающей среды, считают положительной, а Т, отданную системой, - отрицательной. (Q-кол.тепл.,.Дж/кДж) Работа - это способ передачи энергии путем упорядоченного движения большого числа частиц под действием каких-либо сил. Зависит от пути процесса. (W, Дж/кДж) Б.9 Тепловой эффект реакции при изобарном и изохорном процессе не зависит от пути процесса, а определяется только начальным и конечным состоянием системы.(рис)∆Н1=∆Н2+∆Н3=∆Н4+∆Н5+∆Н6 Под тепловым эффектом реакции понимают кол-во теплоты, которое выделяется или поглащается при условиях: процесс протекает необратимо при постоянном объеме или давлении; продукты реакции имеют ту же Т, что и исходн.вещ-ва; в системе не совершается никаких работ, кроме работы расширения. Сл.з.Гесса 1. Тепловой эффект реакции равен разности между суммой теплот образования конечных продуктов и суммой теплот образования исходных веществ с учетом стехиометрических коэффициентов. 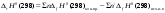 , Сл. 2. Тепловой эффект химической реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания конечных продуктов с учетом стехиометрических коэффициентов. , Сл. 2. Тепловой эффект химической реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания конечных продуктов с учетом стехиометрических коэффициентов. 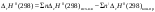 , Сл. 3. Тепловой эффект разложения соединения ( , Сл. 3. Тепловой эффект разложения соединения ( ) равен по величине, но противоположен по знаку тепловому эффекту образования этого соединения. ) равен по величине, но противоположен по знаку тепловому эффекту образования этого соединения.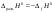 Сл. 4. Если две реакции имеют одинаковые начальные состояния и разные конечные, то разность их тепловых эффектов равна тепловому эффекту перехода из одного конечного состояния в другое. Сл. 4. Если две реакции имеют одинаковые начальные состояния и разные конечные, то разность их тепловых эффектов равна тепловому эффекту перехода из одного конечного состояния в другое.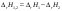 . Сл. 5. Если две реакции из различных начальных состояний приходят к одному конечному состоянию, то разность их тепловых эффектов равна тепловому эффекту перехода из одного начального состояния в другое. . Сл. 5. Если две реакции из различных начальных состояний приходят к одному конечному состоянию, то разность их тепловых эффектов равна тепловому эффекту перехода из одного начального состояния в другое.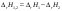 . .Б.3 Внутренняя энергия - совокупность всех видов энергий частиц в системе.  функция состояния, при круговых процессах изменение внутренней энергии системы равно нулю. Зависит от природы вещества, его массы, параметров состояния системы. Является экстенсивным свойством системы, изм. в Дж/кДж. Для системы, содержащей 1 моль вещества, в.э. зависит от P,V,Т, т.е. функция состояния, при круговых процессах изменение внутренней энергии системы равно нулю. Зависит от природы вещества, его массы, параметров состояния системы. Является экстенсивным свойством системы, изм. в Дж/кДж. Для системы, содержащей 1 моль вещества, в.э. зависит от P,V,Т, т.е. 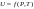  . В идеальном газе, где отсутствуют силы межмолекулярного взаимодействия, энергия не зависит от Р и V, т.е. . В идеальном газе, где отсутствуют силы межмолекулярного взаимодействия, энергия не зависит от Р и V, т.е.   .В.Э. идеального газа является только функцией температуры U = f(T). Энтальпия – в.э. системы при постоянном давлении. .В.Э. идеального газа является только функцией температуры U = f(T). Энтальпия – в.э. системы при постоянном давлении.  . Хар-ет энерг. состояние системы, энергию, затрачиваемую на преодоление внешнего давления, на работу расширения (PV).Определяется состоянием системы. . Хар-ет энерг. состояние системы, энергию, затрачиваемую на преодоление внешнего давления, на работу расширения (PV).Определяется состоянием системы.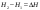 Является экстенсивным свойством системы, изм. в Дж/кДж. Если системы не содержат газов, изменения внутренней энергии и энтальпии похожи. Потому что изменения объема в процессах, протекающих в системах с тв. и жид. вещ-ми, обычно маленькие и велич. РV мала чем Н. В случае газов разница U и Н в ходе процесса может быть большой. Является экстенсивным свойством системы, изм. в Дж/кДж. Если системы не содержат газов, изменения внутренней энергии и энтальпии похожи. Потому что изменения объема в процессах, протекающих в системах с тв. и жид. вещ-ми, обычно маленькие и велич. РV мала чем Н. В случае газов разница U и Н в ходе процесса может быть большой. , ,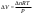 , ,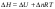 Б.5иБ.4. 4 1й-зак.устанавливает связь между количеством теплоты, полученной или выделенной в процессе, количеством полученной или произведенной работы и изменением внутренней энергии системы. 1.Если в каком-либо процессе исчезает энергия определенного вида, то взамен появляется энергия другого вида в эквивалентном количестве.2.В изолированной системе полный запас энергии не изменяется.3.Вечный двигатель первого рода невозможен. Под вечным двигателем первого рода подразумевается такой механизм или машина, которая давала бы возможность получать работу без затраты энергии. Когда система участвует в каких-либо процессах, то она может при этом производить работу либо принимать участие в теплообмене с окружающей средой. 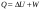 , Q-кол.теплотыU-вн.эн W-сум. Работа Для бесконечно малых процессов , Q-кол.теплотыU-вн.эн W-сум. Работа Для бесконечно малых процессов  , Если , Если 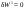 , то , то 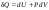 .PdV-элементарная раб. Соверш. системой против сил внешнего давлния, bW -сумма других работ .PdV-элементарная раб. Соверш. системой против сил внешнего давлния, bW -сумма других работМатематическое выражение первого закона термодинамики для различных процессовИзохорный процесс (V = const) W=0, Qv=∆U+W, Qv=∆U Всё тепло, переданное системе, идёт на изменение ее внутренней энергии. Изобарный процесс (Р = const) W=p∆V=nR∆T, Qp=∆U+W=U2-U1+pV2-pV1=(H2+pV2)-(H2+pV2)-(H1+pV1)=H2-H1=∆H Всё тепло, сообщенное системе, расходуется на изменение энтальпии системы. Адиабатный процесс ( Q = 0) В системе отсутствуют теплообменные процессы.  При адиабатном процессе работа совершается системой за счет убыли её внутренней энергии. Изотермический процесс (Т = const) W=  = = =nRT =nRT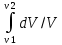 =nRTln =nRTln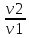 =nRTln =nRTln Для идеального газа, как и для реального, при невысоких температурах внутренняя энергия является функцией температуры, поэтому 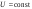  .В изотермическом процессе всё тепло, сообщенное системе, тратится на работу против сил внешнего давления. Если система находится в газообразном состоянии и подчиняется законам идеального газа, то для 1 моля газа .В изотермическом процессе всё тепло, сообщенное системе, тратится на работу против сил внешнего давления. Если система находится в газообразном состоянии и подчиняется законам идеального газа, то для 1 моля газа 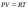 , тогда , тогда  . . Б.13.Энергия Гиббса G (изобарно-изометрич. потенциал) – это та часть всей энергии системы, которую можно использовать для совершения максимальной работы. ΔG= Gкон – Gисх. При P,T=const G = H– TS (ΔG = ΔH– TΔS). Это значит в системе, находящейся при постоянном давлении или темпер, изобарный потенциал является мерой энергии, способной полностью переходить в полезную работу. Другая часть полной энергии (TS) -связанная энергия - не дает работы, а переходит только в теплоту, которая бесполезно рассеивается в окр. среду. Изменение энергии Г учитывает одновременно изменение энергетического запаса системы и степень ее беспорядка (самопроизвольность протекания процесса). ΔG<0, то р-я протекает самопроизвольно в прямом направлении. ΔG=0, то р-я в равновесии. ΔG>0, то р-я не самопроизвольно. А обратная р-я идет самопроизвольно. 2й-зак. позволяет: находить направление и глубину протекания процессов, т.е. определять условия, при которых будет протекать самопроизвольный процесс, и условия, при которых в системе наступает состояние равновесия, устанавливать возможность или невозможность этих процессов, устанавливать те условия, при которых превращение какого-либо запаса тепловой энергии в полезную работу будет происходить наиболее полно. 1.Теплота не может переходить от холодного тела к горячему сама собой, даровым путем. 2.Невозможно создать вечный двигатель второго рода. Под вечным двигателем второго рода подразумевается такая периодически действующая тепловая машина, которая была бы способна полностью превращать теплоту в работу, т.е. без передачи части ее холодильнику. 3. Наибольший кпд () тепловой машины не зависит от природы и вида рабочего тела (пар, газ, воздух и т. д.), а определяется только интервалом температур между теплоисточником и холодильником (теорема Карно - Клаузиуса). Математическое выражение теоремы Карно-Клаузиуса для квазистатических (равновесных) процессов. 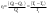 - кпд теепловой машины для равновесных процессов; Q1 -кол-во теплоты, переданное рабоч. телу теплоисточником при температуре T1; Q2 - количество теплоты, переданное рабочим телом холодильнику при Т2. - кпд теепловой машины для равновесных процессов; Q1 -кол-во теплоты, переданное рабоч. телу теплоисточником при температуре T1; Q2 - количество теплоты, переданное рабочим телом холодильнику при Т2.Энтропия является мерой бесполезной теплоты, мерой обесцененной энергии, которая не м.б. превращена в полезн.работу, мерой неупорядоченности системы. Явл. Функцией определяющей направление протекающего процесса в изолированной системе: если в изолированной системе процесс сопровождается увеличением энтропии ∆S>0 то зн.самопроизв. Если ∆S<0 несамопроизв. Если S∆=0 система в равновесии. Изобарный процесс (Р-const.) Теплоемкость не зависит от to Завивисимость от to. При стандартн.услов. (св.эн.Гельмгольца)Изохорно-изометрический потенциал F=U-TS (∆F=∆U-T∆S)F определяет направление и предел самопроизвольного протекания процесса в закрытой системе находящейся в изохорно-изометрических условиях. Свободная энергия – это та часть внутренней энергии системы, которая может быть превращена в работу при T,V=const. TS – бесполезная или связанная энергия, т.е. это та часть внутренней энергии системы которая не может быть превращена в полезную работу. ∆F<0 самопроизвольный процесс, ∆F=0 в равновесии, ∆F<0 несамопроизвольный процесс. Общая теплоемкость системы – это количество теплоты, которое необходимо для повышения to системы га 1o. Удельная (на 1г или 1кг) мольная (на 1 моль). Средняя теплоемкость определяется в заданном темпер.интервале  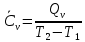 . Истинная теплоемкость определяется при заданном темпер.интервале . Истинная теплоемкость определяется при заданном темпер.интервале 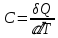 . 1)Сv – изохорная теплоемкость . 1)Сv – изохорная теплоемкость 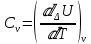 .2)Ср – изобарная теплоемскость .2)Ср – изобарная теплоемскость  .Ур-я Кирхгофа оба равенства справедливы для любых чистых в-в в любом агрегатном состоянии, а также для любой гомогенной системы с постоянным составом. Теплоемкость в-в зависит от to .Ур-я Кирхгофа оба равенства справедливы для любых чистых в-в в любом агрегатном состоянии, а также для любой гомогенной системы с постоянным составом. Теплоемкость в-в зависит от to 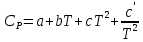 Для орг. в-в c Для орг. в-в c =0 для неорганич.в-в с=0 =0 для неорганич.в-в с=0 |
